温度对厌氧环境中硫酸盐还原菌所致铜镍合金腐蚀行为的影响
2022-03-31宋翼陈守刚
宋翼,陈守刚
腐蚀与防护
温度对厌氧环境中硫酸盐还原菌所致铜镍合金腐蚀行为的影响
宋翼,陈守刚
(中国海洋大学 材料科学与工程学院,山东 青岛 266100)
探究环境因素(温度)在微生物腐蚀(Microbiologically Influenced Corrosion,MIC)过程中的影响以及细菌最适宜的温度条件,初步探索铜合金的MIC机理,为微生物的腐蚀与防护提供依据。利用生物学分析、表面分析以及电化学手段,研究不同温度(25、37、45 ℃)条件下培养基中硫酸盐还原菌(Sulfate-reducing bacteria,SRB)的生长状况和铜镍合金表面的腐蚀状态,进而对微生物体系中的MIC行为进行分析。从生物学分析来看,培养周期内SRB细胞的数量先迅速增加,之后又逐渐减少。温度为37 ℃时,检测出的SRB细胞数和培养基中生成的H2S最多。从表面分析来看,铜镍合金表面生成不致密的生物膜,在生物膜下面检测出点蚀坑,且点蚀密度小。温度为37 ℃时,生物膜覆盖的区域最大,且该温度下检测到最大的平均点蚀坑深度,约9.3 μm。从电化学分析来看,在各种温度下,浸泡在生物介质中的试样的开路电位(OCP)大致向正方向移动,p曲线呈现先上升后下降的趋势,温度为37 ℃,试样检测出的p值最小。温度能够影响SRB所导致的铜镍合金的MIC行为,且温度为37 ℃时,SRB的生长状态最好,铜镍合金的腐蚀最严重。SRB所导致的铜镍合金腐蚀的腐蚀机制可能是EET-MIC和M-MIC同时存在,且与铜镍含量的差异相关。
铜镍合金;温度;SRB;H2S;MIC
全球腐蚀调查表明,世界平均腐蚀损失约占全球国民生产总值(GDP)的3.4%。其中,微生物腐蚀的成本占所有腐蚀损失的20%[1-5]。MIC是指微生物直接或间接地参与材料(通常是金属)腐蚀的过程,一般是通过微生物自身的新陈代谢及其分泌产生的代谢产物来影响材料的腐蚀行为[6-8]。MIC现象早在100多年前被发现[9]。研究表明,几乎所有的工业材料都难逃MIC的影响,其中海洋工业各种机械设备的腐蚀尤为严重[10-11]。
几十年来,由于硫酸盐广泛分布在许多环境之中,如海水、土壤等,硫酸盐还原菌作为MIC中代表性的厌氧微生物被广泛研究[12-13]。微生物自身生命活动及其分泌的代谢产物,如多糖类聚合物、酶、有机酸性物质以及易挥发物质(硫化氢)等,可以通过相互影响与作用改变生物膜与金属之间的电化学反应过程[14]。
铜镍合金主要是以镍元素为主要的添加元素,机械性能和耐腐蚀性能也有了明显的提升。通常,铜合金表面会形成氧化产物膜,对基体起到了良好的保护作用。在过去的几十年中,MIC机制取得了相当大的进展,提出了各种机制来解释不同的MIC过程[15-16]。MIC的存在会对许多金属材料造成腐蚀[15]。例如,MIC对碳钢产生严重腐蚀的现象最为普遍[17]。Dou等人[18]研究SRB对Cu的腐蚀特性和机理,实验发现,SRB引起的Cu的质量损失比碳钢大近10倍。韩晓梅等人[19]发现脱硫弧菌能够引起铝的微生物腐蚀。
长期的研究发现温度是影响腐蚀的关键环境因素。当温度适合细菌的生长繁殖时,工程设施和设备可能会遭受更严重的MIC。根据SRB对温度的要求,一般分为中温SRB和嗜热SRB,中温SRB的最佳生存温度为37 ℃,嗜热SRB的最佳生存温度为55 ℃[20]。温度主要通过影响SRB的生物活性、生物膜和腐蚀产物来影响细菌对金属的腐蚀。酶是细菌完成新陈代谢的必要条件,而酶的活性又恰恰与温度密切相关[21-24]。
目前,Cu的MIC机理已有较为深入的研究,但与铜合金MIC相关的理论和机制还存在很多不足,环境因素对SRB所导致的铜合金腐蚀的影响需要进一步研究。因此,本文主要研究厌氧环境下不同温度条件对SRB引起的铜镍合金的腐蚀行为的影响,为金属的微生物腐蚀与防护提供理论支持。
1 材料与方法
1.1 样品准备
铜镍合金选取B10合金,铜基材中镍元素的添加量约为10%。将其切割成尺寸为10 mm×10 mm×5 mm的试样,将试样依次用80、180、600目的砂纸在抛光机上进行研磨,只露出一个面积为1 cm2的工作表面,其他表面用惰性聚四氟乙烯涂覆。
1.2 细菌和培养基
脱硫弧菌(ATCC 7757)在ATCC 1249培养基中培养。培养基的组成为:CaSO41.0 g/L,NH4Cl 1.0 g/L,MgSO42.0 g/L,(NH4)2Fe(SO4)21.0 g/L,K2HPO40.5 g/L,酵母提取物1.0 g/L,柠檬酸钠5.0 g/L,乳酸钠3.5 g/L。配制完培养基之后,调节培养基的pH为7左右。将实验中所有需要灭菌的实验材料进行121 ℃高压灭菌。灭菌完成后,向培养基中通入高纯氩气,该过程持续60 min。在培养基中加入0.01%(质量分数)经过滤灭菌的L-半胱氨酸(除氧剂),以去除培养基中的残余溶氧。所有需要厌氧环境的操作均在充满氩气氛围的手套箱中完成。
1.3 SRB的培养
将3个B10样块放入每个厌氧小瓶中,加入50 ml灭菌除氧完的培养基,然后用注射器向每个厌氧小瓶注入1 ml已经提前培育好的SRB 菌液,最后用塞子和铝盖将瓶口密封。将厌氧小瓶放入温度为37 ℃的恒温恒湿箱(JYH-253,佳语,中国)中培养7 d,同时设置多组平行实验和没有接种细菌的对照组。7 d之后,取出培养基中的B10样块并对其进行分析。
1.4 SRB生长曲线测定
采用血细胞计数法对浮游细胞和固着细胞进行计数。培养7 d结束后,将样块取出放至磷酸盐缓冲盐水(PBS)溶液中清洗,除去样品表面附着的浮游细胞。用灭菌的刷子将处理好的样品表面的生物膜剥落至10 ml的PBS溶液中,搅拌离心,使固着细胞均匀地分布在溶液中。
用荧光显微镜(fluorescent microscope,FM,AxioScope A1,Carl Zeiss,Jena,Germany)观察试样表面的活细胞和死细胞。观察前,使用LIVE/DEAD BacLight细菌活力试剂盒(Life Technologies,Grand Island,NY,USA)对试样表面进行染色,放在暗室里15 min。
1.5 生物膜和腐蚀产物的观察
通过扫描电子显微镜(SEM,Gemini300,ZEISS,Germany)观察试样表面的生物膜形态以及腐蚀产物分布。首先,将从培养基中取出的试样用 PBS溶液轻轻清洗一下,放入体积分数为2.5%的戊二醛溶液中2 h固定表面的生物膜;然后,将试样依次在体积分数为25%、50%、75%、100%的乙醇中脱水10 min;最后,将试样放入真空干燥箱干燥。
1.6 腐蚀行为分析
用共聚焦激光扫描显微镜(CLSM,Model VK- X250 K,Keyence,Osaka,Japan)来检测样品表面最深的点蚀坑,用10%(质量分数)H2SO4水溶液去除生物膜与腐蚀产物膜[25],并观察试样表面结构。此外,用微气相色谱仪(micro-GC,Agilent 490,Agilent Technologies,Palo Alto,CA,USA)检测厌氧瓶顶空的H2S浓度。
1.7 电化学测试
采用电化学工作站(Reference 600+,Gamry,Philadelphia,PA,USA)进行电化学测量。线性极化电阻(LPR)以0.167 mV/s的速率在相对于开路电位的–10 mV和+10 mV之间扫描得到。电化学阻抗谱(EIS)用10 mV正弦电压信号在稳定的OCP下,于10–2~105Hz的频率范围内进行测试。
2 结果和讨论
图1给出的是不同温度条件下的培养基培养7 d后SRB的浮游细胞和固着细胞数量的变化情况。可以看出,3种不同温度条件下,前3 d浮游细胞数都迅速增加,到第3 d达到高峰,然后浮游细胞数量逐渐减少。由于一开始营养物质和空间充足,细菌大量生长和繁殖,随着营养物质不断被消耗,部分细菌无法继续生长而逐渐凋亡。此外,在7 d的培养过程中,温度为37 ℃的培养基中的浮游细胞数和固着细胞数高于其他温度的细胞数。
培养7 d后,不同温度的厌氧瓶中培养的试样上生物膜的荧光显微镜图像如图2所示。可以看出,显示绿色的活细胞聚集在样品表面,且几乎看不到显示红色的死细胞。培养7 d后,温度为37 ℃的培养基中的B10样品表面固着细胞的密度比其他温度条件下更高,这与图1中展示的细胞计数的结果相对应。
图3显示了不同温度下培养7 d后B10试样表面生物膜和腐蚀产物的SEM图像,可以明显看到SRB细胞附着在B10试样表面,并伴有生物膜和腐蚀产物的形成。温度为25 ℃时,固着细胞和腐蚀产物比37℃和45 ℃时的少,生物膜和腐蚀产物分布不均匀。3种温度条件下B10试样并非完全被生物膜和腐蚀产物覆盖。温度为45 ℃时,试样上的生物膜密度比37 ℃时的小。
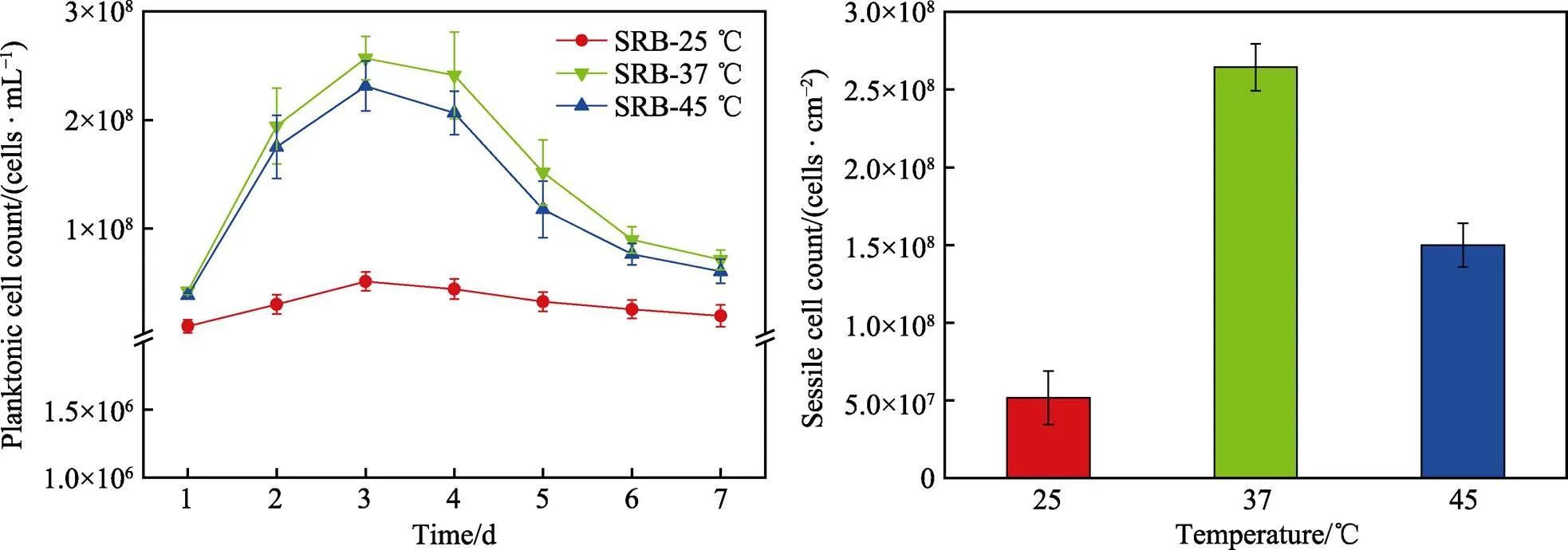
图1 不同温度下在厌氧小瓶中7 d培养期间的浮游细胞计数(a)和培养7 d后B10试样上的固着细胞计数(b)
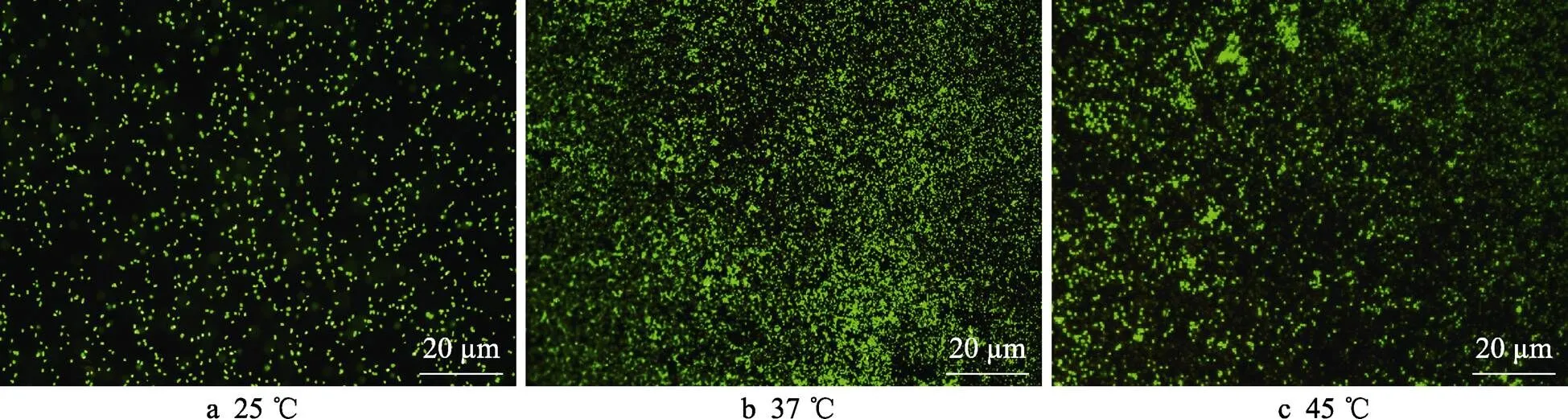
图2 不同温度下培育7 d后从厌氧小瓶中取出的B10试样上的生物膜的荧光显微镜图像

图3 不同温度下培养7 d后从厌氧小瓶中取出的B10试样表面生物膜表面形态和腐蚀产物的SEM图像
在厌氧瓶中不同温度培养7 d后,浸泡在非生物介质中的B10试样和去除掉表面生物膜和腐蚀产物的B10试样的CLSM图谱如图4所示。从图4中可见,浸泡在非生物介质中的B10试样并没有发现点蚀坑,温度为25、37、45 ℃培养的B10试样上的最大坑深分别为5.2、9.3、7.1 μm。同时,3种温度下的点蚀坑的密度均很小,平均点蚀坑深度分别为4.2、7.5、5.9 μm。如图4b—d所示,相同放大倍数下,温度为37 ℃的点蚀坑的宽度比其他温度下的更大,说明该温度下的点蚀最严重。
用微气相色谱仪检测出温度为25、37、45 ℃的厌氧瓶顶空中的h2s浓度,如表1所示。通过不同温度下H2S的亨利定律常数的计算[26],液相中溶解的[H2S]在温度为25、37、45 ℃时分别约为5.9×10‒4、2.7×10‒3、2.3×10‒3mol/l。结合图5,温度为37 ℃时液相中溶解的[H2S]比其他温度多。SRB在温度为25、37、45 ℃的条件下培养7 d后,溶液中的pH值分别为6.81、7.12、7.09(图5)。很明显,所有的pH值都接近中性,37 ℃下的pH值略高。对比培养基的初始pH和实验结束后的pH,均处于中性,这也排除了培养过程中H+腐蚀的可能性。
图6显示了在温度为37 ℃的厌氧瓶中浸泡在非生物介质中的B10试样和在不同温度(25、37、45 ℃)的厌氧瓶中浸泡在生物介质中的B10试样在7 d培养期间的开路电位(OCP)。由于不同温度下浸泡在非生物介质中的B10试样的OCP差别不大,只选取了一种温度条件绘制图像。在7 d的培养过程中,非生物对照试样的OCP值保持在‒280 mV,波动不大。而在不同温度下培育的试样的OCP值远低于非生物系统。3种温度对应的OCP在7 d培养期间均向正方向移动,且37 ℃相比于其他温度条件下OCP所处的电位更负,说明该温度下的腐蚀热力学趋势更严重。
图6b显示了在温度为37 ℃的厌氧瓶中浸泡在非生物介质中的B10试样和在不同温度(25、37、45 ℃)的厌氧瓶中浸泡在生物介质中的B10试样在7 d培养期间的线性极化电阻p。同样,不同温度下浸泡在非生物介质中的B10试样的p差别不大,只选取了一种温度条件绘制图像。从图中可以看出,非生物对照试样的p值在整个培养时间内保持稳定,远高于生物组试样的p值。p代表腐蚀动力学趋势,温度为37 ℃时,试样的p最低,对应的腐蚀速率最高。
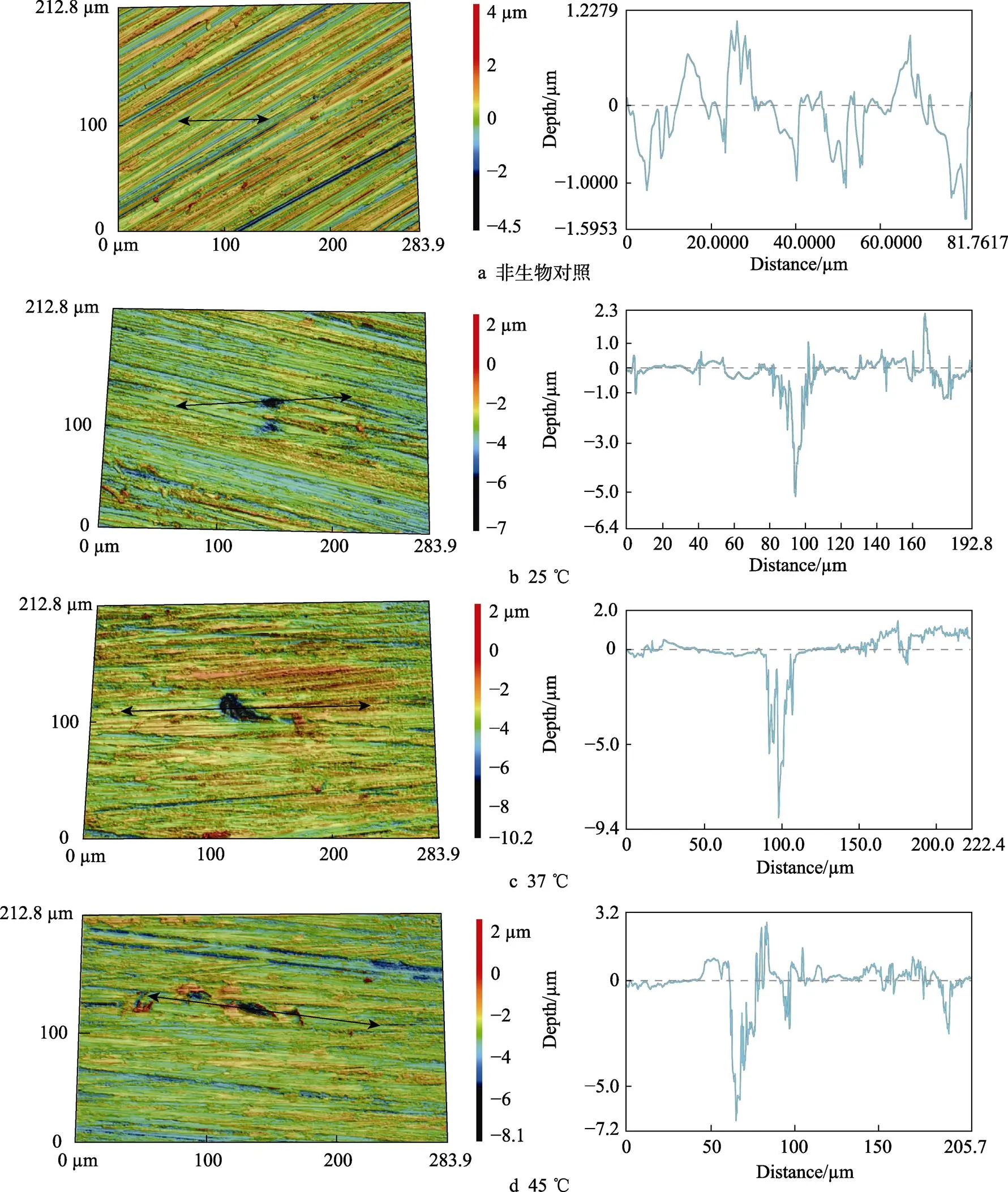
图4 不同温度下的厌氧小瓶中培育7 d后厌氧小瓶中的B10试样表面轮廓及去除生物膜和腐蚀产物后表面的CLSM图像
表1 不同温度下培育7 d后含有B10试样和SRB培养基的厌氧小瓶中顶空中的H2S浓度及液相中溶解的H2S浓度
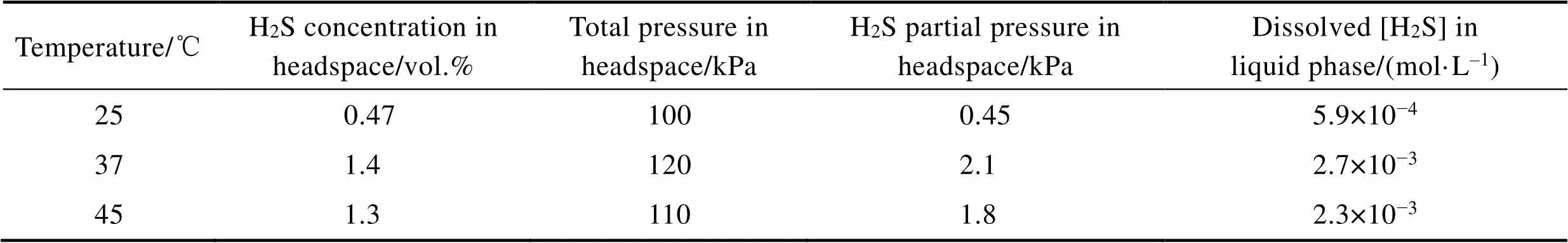
Tab.1 H2S concentration in headspace and dissolved H2S concentration in liquid phase in anaerobic vials in anaerobic vials containing B10 specimens and SRB medium after the 7-day incubation under different temperature (25 ℃, 37 ℃ and 45 ℃)
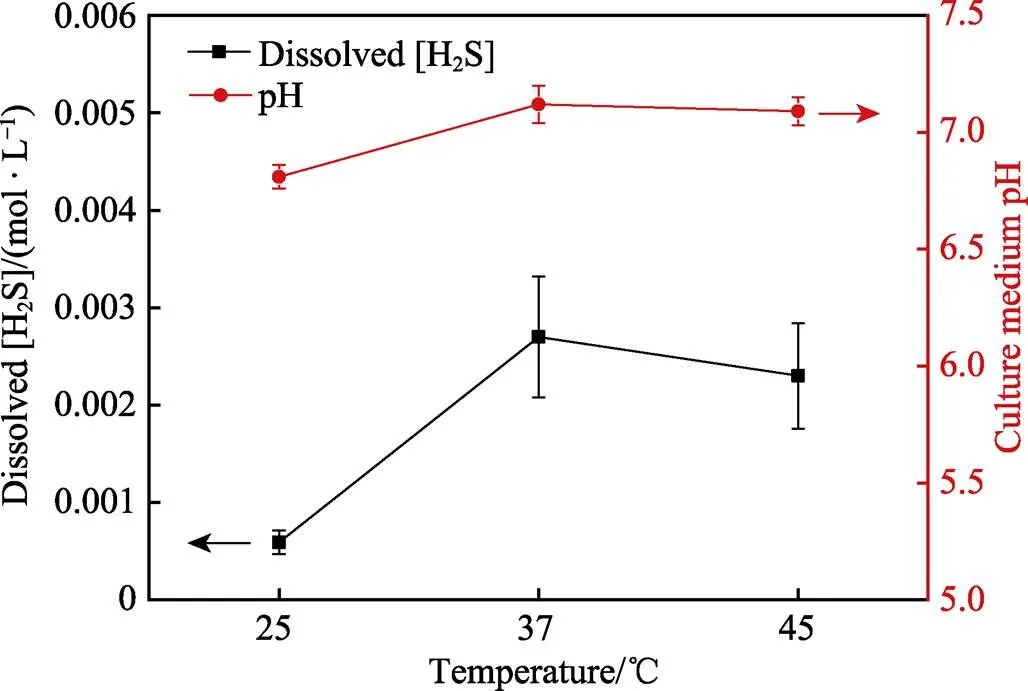
图5 不同温度下在厌氧小瓶中培育7 d后液相中溶解的H2S浓度及pH值
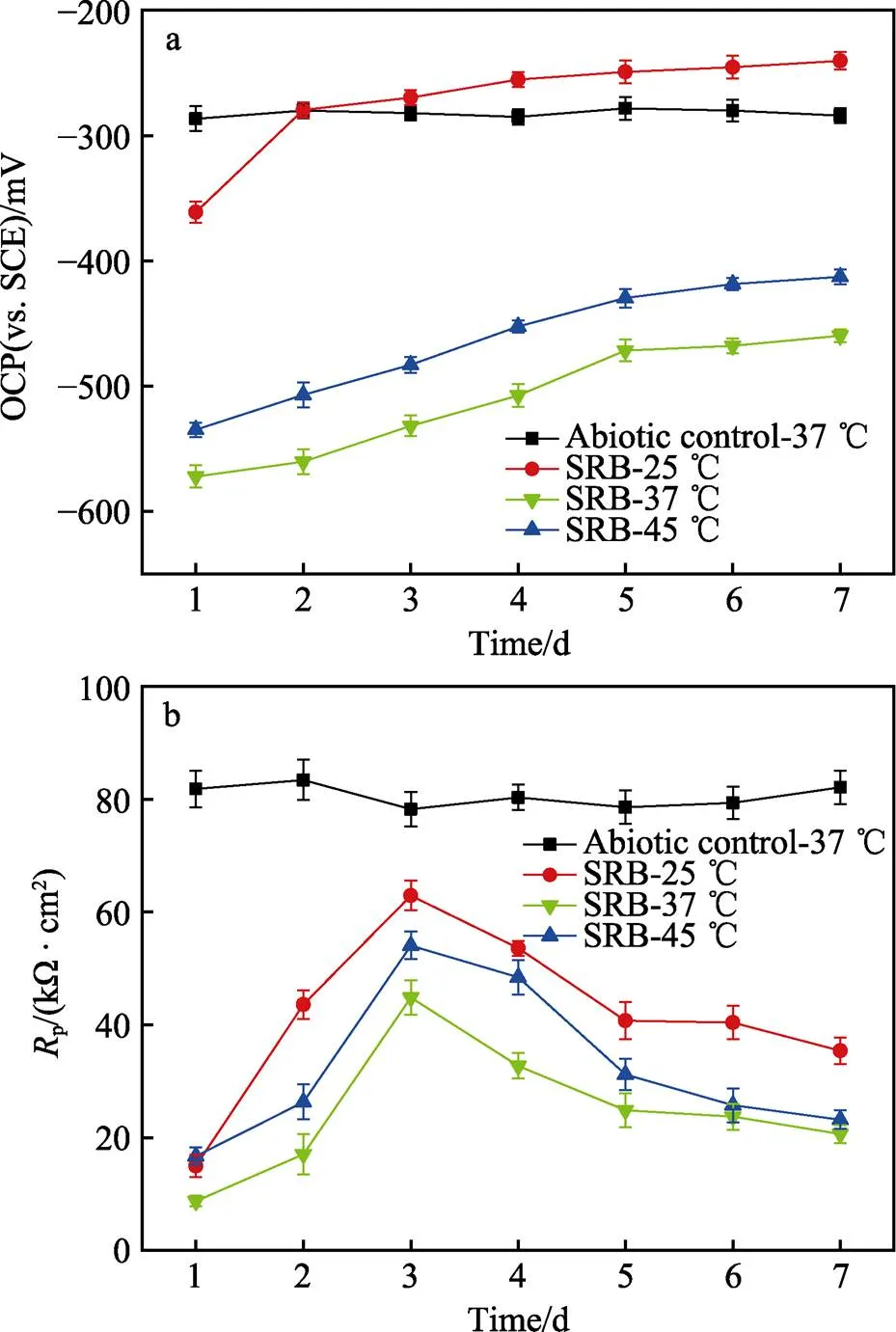
图6 浸在37 ℃的非生物体系的厌氧小瓶和浸在不同温度下的SRB培养基中B10试样培养7 d期间的OCP(a)和线性极化电阻(Rp)(b)
值得注意的是,在各种温度下,B10样品的p曲线都是先上升后下降,说明B10样品的腐蚀速率先下降后上升。对于前3 d,是由生物膜的形成造成的。生物膜中含有的EPS是一种不良导体,其在样品表面积累导致Cu基底与培养基之间的实际接触面积减小,电子传递速度减慢。3 d后,SRB的生长达到高峰,产生了大量的H2S,高浓度溶解的H2S对样品成分中Cu的氧化反应在动力学上是有利的。因此,虽然生物膜不断积累,但腐蚀速度仍在增加。另一方面,疏松多孔的生物膜为SRB提供了一个完美的藏身之处,阻碍了HS–从膜内向溶液扩散,导致HS–浓度较高,增加了腐蚀速率并造成局部区域点蚀的发生。
图7显示了温度为37 ℃的厌氧瓶中浸泡在非生物介质中的B10试样和不同温度下的厌氧瓶中浸泡在生物介质中的B10试样的动电位极化扫描曲线(Tafel曲线)。由于不同温度下浸泡在非生物介质中的B10试样的Tafel曲线差别不大,只选取了一种温度条件绘制图像。图中可以清楚地看到在3种温度下生物系统中B10 样品的阳极极化曲线的钝化区域,说明B10样品在SRB的作用下发生钝化。如表2所示,37 ℃下接种的B10样品的腐蚀电流密度(corr)最大,25 ℃下接种的B10样品的corr最小,说明温度为37 ℃下接种的B10样品的腐蚀速率比其他两个温度的快。
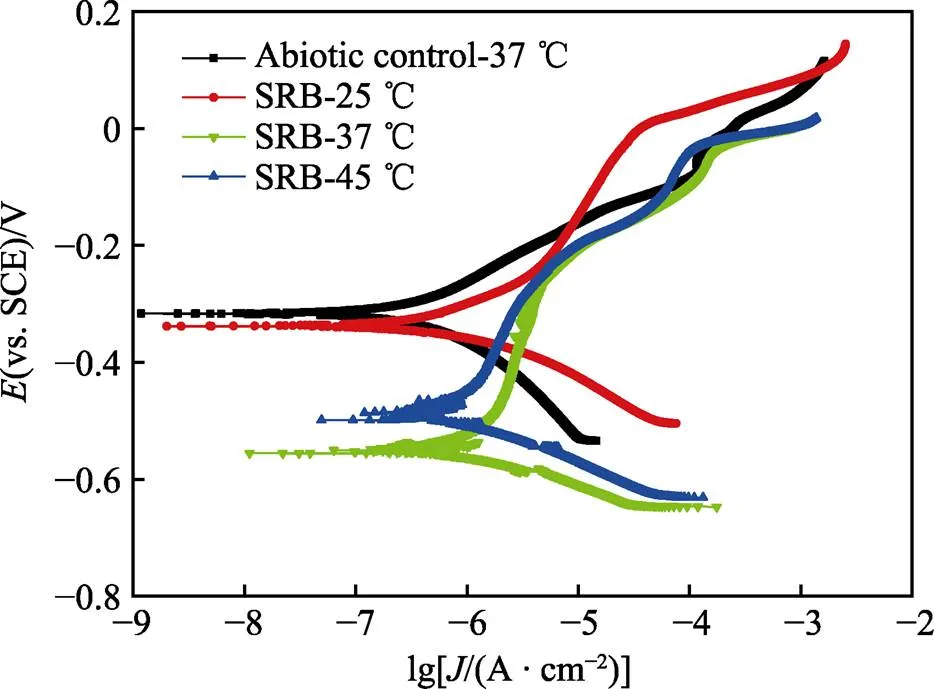
图7 浸在37 ℃的非生物体系的厌氧小瓶中和浸在不同温度下的SRB培养基中的B10试样培养7 d结束时的动电位极化曲线(非生物体系试样在25 ℃和45 ℃培育下的动电位极化曲线与37 ℃相近)
结合不同温度下的生物表征、表面分析和电化学分析等实验结果可以看出,3种温度下铜镍合金的微生物腐蚀机理相同。温度是影响腐蚀的关键环境因素,温度主要通过影响SRB的生物活性、生物膜和腐蚀产物来影响细菌对金属的腐蚀。所以温度本身对腐蚀机理没有影响,其变化会对金属的腐蚀程度造成影响。
表2 浸在37 ℃的非生物体系和浸在不同温度下的SRB培养基中的B10试样培养7 d结束时极化曲线拟合的电化学参数
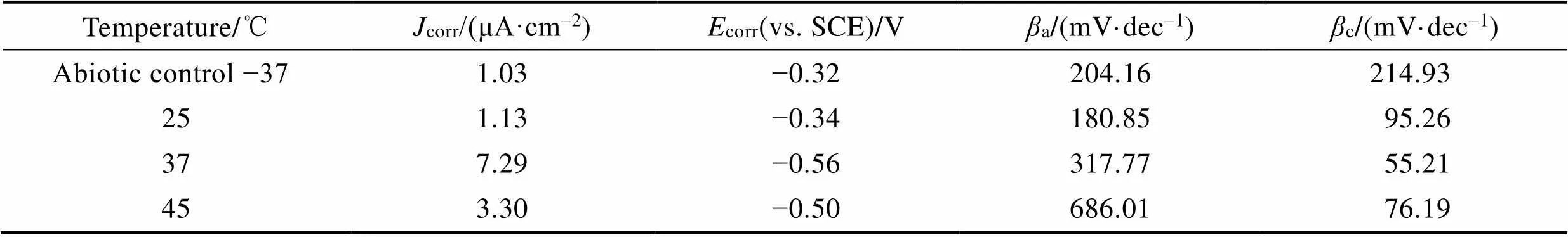
Tab.2 The electrochemical parameters of polarization curve fitting at the end of 7 days of culture of B10 samples immersed in abiotic system at 37 ℃ and SRB medium at different temperatures (25 ℃, 37 ℃ and 45 ℃)
在自然环境中,SRB常从有机碳源(如乳酸)作为电子供体获得能量进行自身的呼吸作用。同时,硫酸盐作为末端电子受体[6,27]。反应式(1)—(4)合理地解释了生物催化阴极硫酸盐还原(Biocatalytic Cathodic Sulfate Reduction,BCSR)理论[6]。
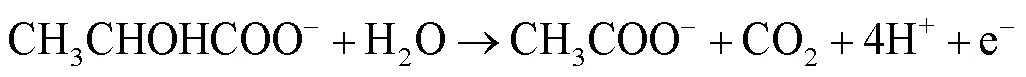
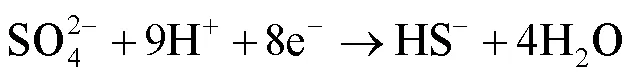
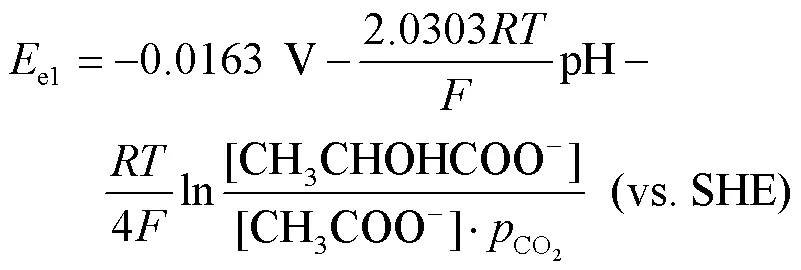
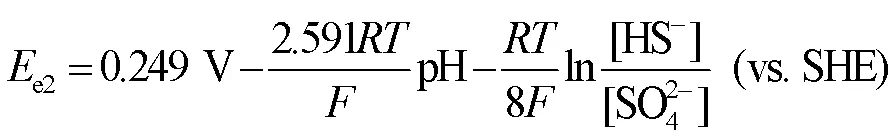
研究表明,Fe可以作为电子供体为SRB提供能量[28],而Cu不能作为电子供体[29]。铜镍合金主要是在铜基材里添加镍元素以及其他微量的金属元素。计算Ni的还原电势用到的能斯特方程式为:
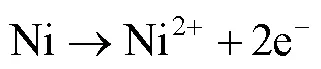
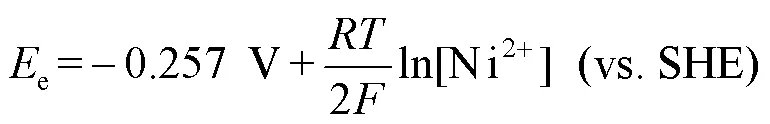
显然,在25 ℃、1 mol/l溶质(0.1 mpa气体)、pH值为7的条件下,Ni的氧化与硫酸根的还原的耦合电势为cell=+40 mV,这意味着SRB所导致的镍腐蚀在热力学中是有利的,即SRB可以通过胞外电子传递型微生物腐蚀(Extracellular Electron Transfer MIC,EET-MIC)从Ni中获得能量。因此,SRB所导致的铜镍合金的MIC机制可能是EET-MIC和代谢产物型微生物腐蚀(Metabolite MIC,M-MIC)同时存在,所以SRB所导致的铜镍合金腐蚀的腐蚀机理有以下几种情况:(1)两种腐蚀机理同时存在,可能对某种金属的腐蚀会占主导或两者相当;(2)只发生其中一种MIC,这与铜镍含量的差异相关。
3 结论
1)温度能够影响SRB所导致的铜镍合金的MIC行为,且温度为37 ℃时,SRB的生长状态最好,铜镍合金的腐蚀最严重。腐蚀性代谢产物H2S的浓度对点蚀的产生至关重要。
2)SRB所导致的铜镍合金腐蚀的腐蚀机制可能是EET-MIC和M-MIC同时存在,对某种金属的腐蚀会占主导或两者相当,这可能与铜镍含量的差异相关。SRB所导致的铜镍合金腐蚀的腐蚀机理仍需进一步研究。
[1] WANG Hai-tao, YAO Lei-jiang, LI Xiao-feng, et al. Effective Utilization for Data of Natural Environment Corrosion of Materials[J]. Data Science Journal, 2015, 14: 18.
[2] GOOCH J W. National Association of Corrosion Engineers Encyclopedic Dictionary of Polymers[M]. Berlin:Springer, 2011.
[3] WANG Hua, JU L K, CASTANEDA H, et al. Corrosion of Carbon Steel C1010 in the Presence of Iron Oxidizing Bacteria Acidithiobacillus Ferrooxidans[J]. Corrosion Science, 2014, 89: 250-257.
[4] SABEL C F, VICTOR D G. Governing Global Problems under Uncertainty: Making Bottom-up Climate Policy Work[J]. Climatic Change, 2017, 144(1): 15-27.
[5] JIA Ru, TAN Jie long, JIN Peng, et al. Effects of Biogenic H2S on the Microbiologically Influenced Corrosion of C1018 Carbon Steel by Sulfate Reducing Desulfovibrio Vulgaris Biofilm[J]. Corrosion Science, 2018, 130: 1-11.
[6] GU T, ZHAO K, NEŠIU S. A New Mechanistic Model for Mic Based on a Biocatalytic Cathodic Sulfate Reduction Theory[J]. Nace International Corrosion Conference, 2009, 51: 346.
[7] JIA Ru, UNSAL T, XU Da-ke, et al. Microbiologically Influenced Corrosion and Current Mitigation Strategies: A State of the Art Review[J]. International Biodeterioration & Biodegradation, 2019, 137: 42-58.
[8] GU Ting-yue, JIA Ru, UNSAL T, et al. Toward a Better Understanding of Microbiologically Influenced Corrosion Caused by Sulfate Reducing Bacteria[J]. Journal of Materials Science & Technology, 2019, 35(4): 631-636.
[9] GAINES R H. Bacterial Activity as a Corrosive Influence in the Soil[J]. Journal of Industrial & Engineering Chemistry, 1910, 2(4): 128-130.
[10] LI Ying-chao, XU Da-ke, CHEN Chang-feng, et al. Anaerobic Microbiologically Influenced Corrosion Mechanisms Interpreted Using Bioenergetics and Bioelectrochemistry: A Review[J]. Journal of Materials Science & Technology, 2018, 34(10): 1713-1718.
[11] KUEHR C, VLUGT L. The Graphitization of Cast Iron as an Electrobiochemical Process in Anaerobic Soils[J]. Water, 1964, 18: 53.
[12] KING R A, MILLER J D A, WAKERLEY D S. Corrosion of Mild Steel in Cultures of Sulphate-Reducing Bacteria: Effect of Changing the Soluble Iron Concentration during Growth[J]. British Corrosion Journal, 1973, 8(2): 89-93.
[13] IVERSON W P, OLSON G J. Anaerobic Corrosion by Sulfate-Reducing Bacteria Due to a Highly-Reactive Volatile Phosphorus Compound. Final Report[J]. Synthetic Fuels, 1983, 21: 78.
[14] XU D, JIA R, LI Y, et al. Advances in the Treatment of Problematic Industrial Biofilms[J]. World Journal of Microbiology & Biotechnology, 2017, 33(5): 97.
[15] KAKOOEI S, ISMAIL M, ARIWAHJOEDI B. Mechanisms of Microbiologically Influenced Corrosion: A Review[J]. World Applied Sciences Journal, 2012, 17(4): 524-531.
[16] ENNING D, GARRELFS J. Corrosion of Iron by Sulfate- Reducing Bacteria: New Views of an Old Problem[J]. Applied and Environmental Microbiology, 2014, 80(4): 1226- 1236.
[17] LV Mei-ying, DU Min. A Review: Microbiologically Influenced Corrosion and the Effect of Cathodic Polarization on Typical Bacteria[J]. Reviews in Environmental Science and Bio/Technology, 2018, 17(3): 431-446.
[18] DOU Wen-wen, JIA Ru, JIN Peng, et al. Investigation of the Mechanism and Characteristics of Copper Corrosion by Sulfate Reducing Bacteria[J]. Corrosion Science, 2018, 144: 237-248.
[19] 韩晓梅, 窦雯雯, 蒲亚男, 等. 脱硫弧菌引起的铝的微生物腐蚀机理研究[J]. 表面技术, 2020, 49(7): 255-262.
HAN Xiao-mei, DOU Wen-wen, PU Ya-nan, et al. Microbiologically Influenced Corrosion Mechanism of Aluminum by Desulfovibrio Vulgaris[J]. Surface Technology, 2020, 49(7): 255-262.
[20] 刘娜. 硫酸盐还原菌的分类鉴定及抑制规律研究[D]. 武汉: 华中科技大学, 2012.
LIU Na. Characterization and Identification of SRB and Its Control Method[D]. Wuhan: Huazhong University of Science and Technology, 2012.
[21] DANIEL R M, DANSON M J, EISENTHAL R, et al. The Effect of Temperature on Enzyme Activity: New Insights and Their Implications[J]. Extremophiles: Life Under Extreme Conditions, 2008, 12(1): 51-59.
[22] GEIGER R A, JUNGHARE M, MERGELSBERG M, et al. Enzymes Involved in Phthalate Degradation in Sulphate-Reducing Bacteria[J]. Environmental Microbiology, 2019, 21(10): 3601-3612.
[23] KELLER K L, WALL J D, CHHABRA S. Methods for Engineering Sulfate Reducing Bacteria of the Genus Desulfovibrio[J]. Methods in Enzymology, 2011, 497: 503-517.
[24] ULLRICH T C, BLAESSE M, HUBER R. Crystal Structure of ATP Sulfurylase from Saccharomyces Cerevisiae, a Key Enzyme in Sulfate Activation[J]. The EMBO Journal, 2001, 20(3): 316-329.
[25] [s. n.]. Standard Practice for Preparing, Cleaning, and Evaluating Corrosion Test Specimens[J]. Astm, 2003, 36: 94.
[26] CARROLL J J, MATHER A E. The Solubility of Hydrogen Sulphide in Water from 0 to 90 ℃ and Pressures to 1 MPa[J]. Geochimica et Cosmochimica Acta, 1989, 53(6): 1163-1170.
[27] ZHANG Pei-yu, XU Da-ke, LI Ying-chao, et al. Electron Mediators Accelerate the Microbiologically Influenced Corrosion of 304 Stainless Steel by the Desulfovibrio Vulgaris Biofilm[J]. Bioelectrochemistry, 2015, 101: 14-21.
[28] XU Da-ke, GU Ting-yue. Carbon Source Starvation Triggered more Aggressive Corrosion Against Carbon Steel by the Desulfovibrio Vulgaris Biofilm[J]. International Biodeterioration & Biodegradation, 2014, 91: 74-81.
[29] DOU Wen-wen, PU Ya-nan, HAN Xiao-mei, et al. Corrosion of Cu by a Sulfate Reducing Bacterium in Anaerobic Vials with Different Headspace Volumes[J]. Bioelectrochemistry, 2020, 133: 107478.
Effect of Temperature on Corrosion Behavior of Copper-nickel Alloys by Sulphate-reducing Bacteria in Anaerobic Environment
,
(School of Materials Science and Engineering, Ocean University of China, Qingdao 266100, China)
This paper aims to investigate the influence of environmental factors (temperature) in the process of microbiologically influenced corrosion (MIC), the optimum temperature conditions for bacteria and a preliminary exploration of the MIC mechanism of copper alloys to provide a basis for microbial corrosion and protection. The growth of sulphate-reducing bacteria (SRB) and the corrosion state of copper-nickel surfaces in the medium at different temperatures (25 ℃, 37 ℃ and 45 ℃) were investigated by means of biological analysis, surface analysis and electrochemical testing techniques. Results revealed that the number of SRB cells first increased rapidly during the incubation period and then decreased gradually. The highest number of SRB cells detected and the highest amount of H2S generated in the culture medium were found at 37 ℃. An undense biofilm was generated on the surface of the copper-nickel alloy and pitting pits were detected beneath the biofilm with a small pitting density. The area covered by the biofilm was greatest at 37 ℃ and the greatest average pitting pit depth, approximately 9.3 μm, was detected at this temperature. At all temperatures, the OCP of specimens immersed in biological media moved in a generally positive direction, with the linear polarization resistance (p) curve showing a tendency to rise and then fall. At 37 ℃,pvalues detected for specimens were the smallest. The conclusions are drawn from the analysis of the results. Temperature is able to influence the MIC behaviour of copper-nickel alloys caused by SRB. The best growth of SRB and the most severe corrosion of copper-nickel alloys occurs at 37 ℃. The corrosion mechanism of copper-nickel alloys caused by SRB may be both EET-MIC and M-MIC, which may be related to the difference in copper-nickel content.
copper-nickel alloys; temperature; SRB; H2S; MIC
2021-05-09;
2021-05-28
SONG Yi (1995—), Male, Postgraduate, Research focus: microbiologically influenced corrosion.
陈守刚(1974—),男,博士,教授,主要研究方向为腐蚀与防护。
CHEN Shou-gang (1974—), Male, Ph. D., Professor, Research focus: corrosion and protection.
宋翼, 陈守刚. 温度对厌氧环境中硫酸盐还原菌所致铜镍合金腐蚀行为的影响[J]. 表面技术, 2022, 51(3): 95-102.
Tg172
A
1001-3660(2022)03-0095-08
10.16490/j.cnki.issn.1001-3660.2022.03.009
2021-05-09;
2021-05-28
国家自然科学基金(42006042,51572249)
Fund:Supported by the National Natural Science Foundation of China (42006042, 51572249)
宋翼(1995—),男,硕士研究生,主要研究方向为微生物腐蚀。
SONG Yi, CHEN Shou-gang. Effect of Temperature on Corrosion Behavior of Copper-nickel Alloys by Sulphate-reducing Bacteria in Anaerobic Environment[J]. Surface Technology, 2022, 51(3): 95-102.
