经典名方桃核承气汤物质基准关键质量属性传递规律分析
2022-03-31刘雨涵关雅戈史玉莲翟传佳李雪娇高晓燕
刘雨涵,关雅戈,韩 晨,史玉莲,翟传佳,李雪娇,罗 赣,高晓燕
经典名方桃核承气汤物质基准关键质量属性传递规律分析
刘雨涵,关雅戈,韩 晨,史玉莲,翟传佳,李雪娇,罗 赣,高晓燕*
北京中医药大学中药学院,北京 102488
探究桃核承气汤物质基准关键质量属性的传递规律。制备15批桃核承气汤冻干粉作为物质基准,测定其特征图谱、指标成分含量及干膏率,并计算上述指标在药材-饮片-水煎液-物质基准传递过程中的转移率。15批桃核承气汤特征图谱选取的48个特征峰在传递过程中无丢失,多数特征峰相对峰面积的转移率在均值的70%~130%,饮片-物质基准中苦杏仁苷、甘草酸、肉桂酸、大黄总游离蒽醌的平均转移率分别为(21.03±6.83)%、(21.16±2.60)%、(35.96±14.04)%和(6.01±2.05)%,干膏率平均传递率为78.68%。桃核承气汤物质基准的关键质量属性均可在药材-饮片-水煎液-物质基准中稳定传递。初步构建桃核承气汤物质基准制备全过程质量控制体系,为后续复方制剂的开发提供了方法参考。
经典名方;桃核承气汤;物质基准;特征图谱;关键质量属性;量质传递;苦杏仁苷;甘草酸;肉桂酸;蒽醌
经典名方物质基准是指以古代医籍中记载的经典名方制备方法为依据制备而得的中药药用物质的标准[1]。按照《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》要求,经典名方物质基准的关键质量属性(CQAs)应包括特征图谱、指标成分含量及干膏率,明晰CQAs在药材-饮片-水煎液-物质基准过程中的量质传变规律为药材选择、炮制工艺筛选、制备工艺优化提供了数据支撑。
为推动经典名方开发研究,国家药品监督管理局发布《古代经典名方目录(第一批)》[2],桃核承气汤居首位。桃核承气汤(Taohe Chengqi Decoction,TCD)始载于汉代张仲景《伤寒论》[3],全方由桃仁、大黄、桂枝、甘草和芒硝组成,5药共奏泻热逐瘀之功。现代临床将其用于治疗急性盆腔炎[4-5]、肠梗阻[6]、子宫内膜异位症[7-9]等。医家根据具体病症在TCD基础上衍生出许多加减方[10-12],这表明TCD在临床应用广泛,具有很大的开发价值。本课题组前期初步探索了TCD物质基准特征图谱的分析方法和指标成分群的含量测定方法[13],为表征处方所有药味在物质基准中尽量多的化学信息和实现对指标成分群准确的含量测定,本实验在前期工作基础上,对色谱条件进行了优化,在此基础上,测定了15批TCD物质基准特征图谱、指标成分含量以及出膏率,探究了这些CQAs指标在药材-饮片-水煎液-物质基准的传递规律,初步建立TCD的全程质控体系,为保证其质量的稳定均一提供数据支撑,为后续复方制剂的开发提供了参考。
1 材料
Thermo Fisher Ultimate 3000高效液相色谱仪,DAD检测器,CM7.2色谱工作站、Sorvall ST 8R高速冷冻离心机,赛默飞世尔科技(中国)有限公司;DZF-6051型真空干燥器,北京利康达圣科技有限公司;FD-2A型真空冷冻干燥机,北京博医康实验仪器有限公司。
经前期研究确定TCD炮制方法后,由北京康仁堂药业有限公司提供各批次药材和饮片,方中各药材经北京中医药大学中药鉴定教研室杨瑶珺教授鉴定,桃仁为蔷薇科植物山桃(Carr.) Franch.的干燥成熟种子,大黄为蓼科植物唐古特大黄Maxim. ex Balf.的干燥根和根茎,甘草为豆科植物甘草Fisch.的干燥根和根茎,桂枝为樟科植物肉桂Presl的干燥嫩枝,芒硝为硫酸盐类矿物芒硝族芒硝,经加工精制而成的结晶体。
对照品苦杏仁苷(批号DST190829-004)、甘草酸铵(批号DST190702-008)购自成都德思特生物技术有限公司;桂皮醛(批号110710-201418)、大黄酸(批号110757-201607)、芦荟大黄素(批号110795-201710)、大黄素(批号110756-201913)、大黄酚(批号110796-201621)、大黄素甲醚(批号110758-201616)购自中国食品药品检定研究院,上述对照品均为HPLC含量测定用,质量分数均大于98%。
甲醇、乙腈,色谱级,Fisher公司;实验室自制超纯水;其他试剂均为分析纯。
2 物质基准特征图谱物质群量质传递规律研究
2.1 TCD物质基准制备
采用随机数表法对15批次各药味饮片进行随机组合及排序。称取处方剂量燀桃仁50枚、大黄55.2 g、炙甘草27.6 g、桂枝27.6 g、芒硝27.6 g,置3 L陶瓷锅中,加入1400 mL去离子水,武火(8档)煮沸后,转文火(5档)煎煮至约500 mL,滤过,加入芒硝27.6 g,文火煮至微沸,放冷后定容至500 mL,即得标准煎液。取上述标准煎液适量,4 ℃、9000 r/min离心20 min后,精密量取上清液50 mL,冷冻干燥,即得TCD物质基准对应实物。
2.2 TCD物质基准特征图谱建立
课题组前期针对TCD物质基准中高极性成分建立了特征图谱2[13]。本实验在此针对TCD物质基准中低极性成分建立特征图谱1。
2.2.1 色谱条件 Diamonsil钻石二代C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸水溶液,梯度洗脱:0~3 min,20%甲醇;3~30 min,20%~45%甲醇;30~35 min,45%甲醇;35~55 min,45%~70%甲醇;55~80 min,70%~80%甲醇;80~85 min,80%甲醇;85~90 min,80%~95%甲醇;90~95 min,95%~100%甲醇;95~100 min,100%甲醇;柱温30 ℃;体积流量1 mL/min;进样量10 μL;检测波长254 nm。
2.2.2 供试品溶液的制备
(1)TCD物质基准供试品溶液制备:取适量物质基准冻干粉,加去离子水定容至10 mL,4 ℃、13 000 r/min离心20 min,取上清液,即得。
(2)各单味药及阴性样品供试品溶液制备:取处方剂量各单味药饮片及分别缺桃仁、大黄、甘草、桂枝、芒硝的处方量饮片,按“2.1”项下方法制备后,按上述TCD物质基准供试品溶液制备方法制备,即得。
2.2.3 对照品溶液的制备 精密称取苦杏仁苷对照品适量,加甲醇制得质量浓度为1770 μg/mL的苦杏仁苷对照品溶液;精密称取甘草酸铵(甘草酸含量=甘草酸铵含量/1.020 7)对照品适量,加甲醇制得质量浓度为42.20 μg/mL的甘草酸铵对照品溶液;精密称取肉桂酸对照品适量,加甲醇制得质量浓度为441 μg/mL的肉桂酸对照品溶液;取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,加甲醇制得质量浓度分别为213、660、205、209、244 μg/mL的大黄总游离蒽醌混合对照品溶液。
2.2.4 方法学考察
(1)参照峰的选择:特征图谱1中,大黄酸含量较高,色谱峰较稳定,故选择大黄酸(31号共有峰)作为特征图谱1的参照峰,计算特征图谱1中各共有峰的相对保留时间和相对峰面积;特征图谱2中,43号共有峰含量较高,色谱峰较稳定,故选择43号共有峰作为特征图谱2的参照峰,计算特征图谱2中各共有峰的相对保留时间和相对峰面积。
(2)精密度试验:取第3批物质基准供试品溶液,按“2.2.1”项下色谱条件连续依次进样6次。特征图谱1的34个特征峰峰的相对保留时间RSD<0.11%、相对峰面积RSD<2.81%,说明仪器的精密度良好。
(3)重复性试验:取第3批物质基准供试品溶液6份,按“2.2.1”项下色谱条件进样。特征图谱1的34个特征峰峰的相对保留时间RSD<0.17%、相对峰面积RSD<2.91%,说明方法重复性良好。
(4)稳定性试验:取第3批物质基准供试品溶液,按“2.2.1”项下色谱条件于0、2、4、8、12、24 h进样,特征图谱1的34个特征峰的相对保留时间RSD<0.11%、相对峰面积RSD<2.90%,说明样品稳定性良好。
2.2.5 特征图谱1的建立 取15批物质基准、各单味药及阴性对照样品,按“2.2.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件检测,将数据导入中药色谱指纹图谱相似度评价系统(2012年版)软件,以第1批的HPLC图谱为参照,采用平均数法,进行多点校正和色谱峰匹配,自动匹配得到15批物质基准的特征图谱叠加图及共有模式,如图1所示,以生成的共有模式为参照,15批物质基准特征图谱与对照图谱的相似度均大于0.92。
根据特征图谱分析结果,将TCD物质基准与各单味药及其阴性样品HPLC谱图进行比对,确定出峰情况良好、无阴性干扰的色谱峰为各药味特征峰。特征图谱1共确定34个特征峰,特征峰1~10、12、14~18、20~26、28、31、33~34为大黄特征峰,特征峰11、19、27、29、30、32为甘草特征峰。特征13为桂枝特征峰。见图2。前文所建立特征图谱2中共确定14个特征峰,特征峰35~38、40~43、46~48为大黄特征峰,特征峰39为桂枝特征峰,特征峰44为甘草特征峰,特征峰45为桃仁特征峰[13]。
2.3 TCD处方各药味特征峰在药材、饮片、水煎液、物质基准中相对峰面积的测定结果
按照上文所建立特征图谱1方法和课题组前文特征图谱2方法[13]分别采集15批TCD处方中的药材、饮片、水煎液和物质基准的特征图谱1、2,以每个特征峰峰面积与该峰所属药味的特征峰面积总和的比值作为每个特征峰的相对峰面积,结果见表1。可见物质基准特征图谱1、2选取的48个特征峰在传递过程中无丢失。
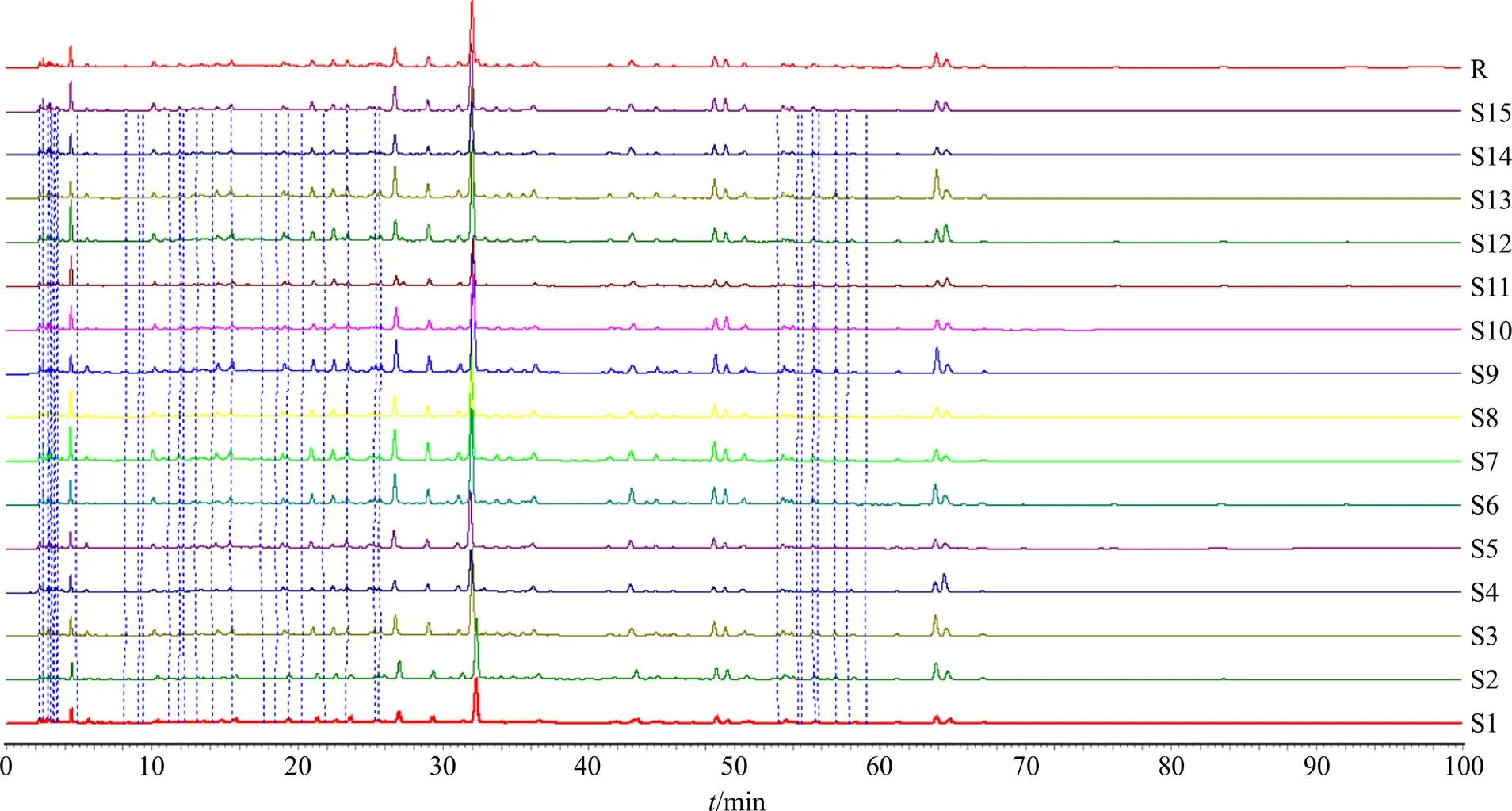
图1 15批TCD物质基准的HPLC特征图谱1 (S1~S15)、对照图谱1 (R)

图2 TCD物质基准特征图谱1中34个特征峰及其归属
2.4 TCD处方各药味特征峰相对峰面积在药材-饮片-水煎液-物质基准中的传递规律
以特征峰的相对峰面积计算其在药材-饮片-水煎液-物质基准的传递过程中的转移率,结果见表2。多数特征峰相对峰面积的转移率在均值的70%~130%范围内波动,表明特征图谱能够在药材-饮片-水煎液-物质基准过程中稳定传递。
3 TCD物质基准指标成分含量在药材-饮片-水煎液-物质基准传递规律
3.1 TCD处方中各指标成分的含量测定方法的建立
本课题组前期已确定TCD物质基准指标性成分为苦杏仁苷、甘草酸、肉桂酸、芦荟大黄素、大黄酸、大黄素、大黄酚。除桂枝以外,桃仁、大黄、甘草药材、饮片指标成分含量测定参照《中国药典》2020年版,水煎液和物质基准中苦杏仁苷的含量测定方法课题组前期已建立[13]。本实验建立了桂枝中的肉桂酸、水煎液和物质基准中的大黄总游离蒽醌及甘草酸的含量测定方法。
3.1.1 色谱条件
(1)大黄总游离蒽醌、甘草酸含量测定:Diamonsil钻石二代C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸水溶液,梯度洗脱:0~3 min,20%甲醇;3~30 min,20%~45%甲醇;30~35 min,45%甲醇;35~55 min,45%~65%甲醇;55~80 min,65%~75%甲醇;80~90 min,75%~95%甲醇;90~95 min,95%~100%甲醇;95~100 min,100%甲醇;柱温30 ℃;体积流量1 mL/min;进样量10 μL;检测波长254 nm。理论塔板数大于9900;分离度大于1.5。
(2)肉桂酸含量测定:Diamonsil钻石二代C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈- 0.1%磷酸水溶液,梯度洗脱:0~10 min,20%~29%乙腈;30~32 min,29%~32%乙腈;32~40 min,32%乙腈;柱温30 ℃;体积流量1 mL/min;进样量10 μL;检测波长275 nm;理论塔板数大于9900;分离度大于1.5。
3.1.2 供试品溶液的制备 同“2.2.2”项下供试品溶液的制备。
3.1.3 对照品溶液的制备 同“2.2.3”项下对照品溶液的制备。
3.1.4 方法学考察
(1)线性关系考察:精密吸取“2.2.3”项下各指标成分对照品储备液,分别用倍比稀释法配制成系列对照品溶液,按“3.1.1”项下各色谱条件分析,记录色谱图及峰面积。以峰面积为纵坐标(),质量浓度为横坐标(),分别绘制标准曲线,进行线性回归,得回归方程分别为甘草酸=0.133 5+0.757,=1.000 0,线性范围9.007 5~3 603 μg/mL;肉桂酸=1.348+6.247 3,=0.999 5,线性范围0.984~492.0 μg/mL;芦荟大黄素=0.770 1+0.123 2,=1.000 0,线性范围0.206~206.0 μg/mL;大黄酸=0.650 4+0.000 2,=1.000 0,线性范围0.283~283.0 μg/mL;大黄素=0.520 9+0.195 6,=1.000 0,线性范围0.125~125.0 μg/mL;大黄酚=0.798 4+0.367 9,=1.000 0,线性范围0.152~152.0 μg/mL;结果表明,甘草酸、肉桂酸、芦荟大黄素、大黄酸、大黄素、大黄酚在各自的线性范围内线性关系良好。
表1 TCD处方各药味特征峰在药材、饮片、水煎液及其物质基准中的相对峰面积
Table 1 Relative peak area of each characteristic peaks in TCD prescription in medicinal material, decoction piece, decoction and substance benchmarks
峰号相对峰面积所属药味峰号相对峰面积所属药味 药材饮片水煎液物质基准药材饮片水煎液物质基准 10.065 80.048 70.048 90.048 5大黄250.039 60.040 30.039 80.041 9大黄 20.016 80.012 90.014 20.013 1大黄260.020 90.023 80.030 70.031 4大黄 30.028 00.024 00.024 30.024 8大黄270.069 80.074 20.067 00.055 3甘草 40.006 20.009 50.007 90.007 9大黄280.006 80.007 90.009 70.014 1大黄 50.031 10.036 90.038 10.035 5大黄290.077 10.090 30.065 30.054 2甘草 60.024 10.019 50.025 30.027 1大黄300.548 30.495 20.597 80.638 3甘草 70.036 10.037 90.048 10.047 6大黄310.047 80.050 50.048 10.047 9大黄 80.036 80.042 50.039 70.036 7大黄320.089 10.089 30.065 90.054 9甘草 90.009 70.008 30.009 20.008 9大黄330.003 70.004 80.006 30.006 9大黄 100.035 40.028 90.036 80.035 4大黄340.004 40.006 50.004 50.004 2大黄 110.122 80.132 70.127 80.123 1甘草350.017 90.015 50.015 50.015 2大黄 120.089 70.091 30.083 00.085 8大黄360.015 90.013 20.013 50.015 8大黄 13/0.379 40.228 00.177 3桂枝370.170 00.161 00.233 20.254 0大黄 140.085 00.070 30.051 30.045 1大黄380.022 10.015 90.016 20.018 0大黄 150.676 60.686 20.574 30.552 2大黄39/0.620 60.772 00.822 7桂枝 160.119 40.129 70.244 60.298 7大黄400.009 80.012 50.020 20.017 9大黄 170.01390.01520.01970.020 4大黄410.081 70.077 80.068 80.065 1大黄 180.00410.003 60.002 50.002 2大黄420.002 00.001 60.001 20.001 2大黄 190.092 90.118 20.076 20.074 2甘草430.599 80.615 60.526 40.514 5大黄 200.032 30.034 70.027 60.026 4大黄440.006 00.007 70.011 50.010 0甘草 210.018 30.022 10.033 20.031 0大黄450.041 7 0.03 800.049 90.046 7桃仁 220.018 40.019 20.021 90.022 6大黄460.061 20.049 50.072 60.068 5大黄 230.005 70.006 60.011 80.014 3大黄470.010 40.018 50.012 50.011 3大黄 240.052 00.053 20.049 60.057 4大黄480.009 20.018 80.020 10.018 5大黄
桂枝自药厂购入时已炮制成饮片,故归属至桂枝的13、39号峰药材数据空缺,用“/”表示,表2同
Guizhi has been processed into decoction pieces when purchased from the pharmaceutical factory, so the data of No. 13 and No. 39 peaks belonging to Guizhi medicinal materials are vacant, expressed in “/”, same as table 2
(2)精密度试验:取适量混合对照品溶液,按“3.1.1”项下色谱条件进样检测,连续进样6次,甘草酸、肉桂酸、芦荟大黄素、大黄酸、大黄素、大黄酚质量分数的RSD分别为1.21%、0.13%、0.03%、0.08%、0.03%、2.82%,表明仪器精密度良好。
(3)重复性试验:取适量供试品溶液(S1)6份,按“3.1.1”项下色谱条件进样检测,测得甘草酸、肉桂酸、芦荟大黄素、大黄酸、大黄素、大黄酚质量分数的RSD分别为1.22%、0.70%、0.09%、0.76%、0.03%、0.09%,表明方法的重复性良好。
(4)稳定性试验:取适量供试品溶液(S1),按“3.1.1”项下色谱条件进样检测,分别将样品置于室温下,于0、2、4、8、12、24 h进样,甘草酸、肉桂酸、芦荟大黄素、大黄酸、大黄素、大黄酚质量分数的RSD分别为1.53%、2.54%、2.52%、2.72%、2.71%、2.90%,表明样品溶液在24 h内稳定。
表2 特征图谱特征峰相对峰面积在药材-饮片-水煎液-物质基准的传递转移率
Table 2 Transfer rates of relative peak area of characteristic chromatogram in the process of medicinal materials-decoction pieces-decoction-substance benchmarks
峰号转移率/%所属药味峰号转移率/%所属药味 药材-饮片饮片-水煎液水煎液-物质基准药材-饮片饮片-水煎液水煎液-物质基准 173.97100.3599.18大黄25101.89 98.67 105.19 大黄 276.87109.3992.59大黄26113.93 128.72 102.33 大黄 385.82101.34101.91大黄27106.32 90.23 82.52 甘草 4154.6482.42100.35大黄28115.93 123.00 144.60 大黄 5118.63103.3393.04大黄29117.17 72.28 83.06 甘草 680.91129.74107.12大黄3090.31 120.72 106.78 甘草 7104.84127.1598.90大黄31105.83 95.20 99.45 大黄 8115.5093.3692.33大黄32100.30 73.80 83.34 甘草 985.57110.0196.70大黄33130.75 130.93 109.33 大黄 1081.71127.2696.25大黄34148.58 69.29 93.92 大黄 11108.0696.3196.27甘草3586.81 99.56 98.45 大黄 12101.7290.96103.29大黄3682.88 101.87 117.59 大黄 13/82.6168.42桂枝3794.73 144.85 108.92 大黄 14131.75207.13108.98大黄3871.70 102.24 110.74 大黄 15107.9485.06115.18大黄39/170.93 93.80 桂枝 1698.5590.1894.48大黄40127.60 161.31 88.70 大黄 17109.76129.14103.57大黄4195.24 88.45 94.67 大黄 1887.5269.4987.39大黄4283.07 71.86 99.24 大黄 19127.2464.4497.39甘草43102.64 85.50 97.75 大黄 20107.3279.6795.62大黄44128.33 149.35 86.96 甘草 21120.78150.2893.33大黄4591.13 131.32 93.59 桃仁 22104.32114.08102.98大黄4680.92 146.52 94.42 大黄 23114.92179.57121.42大黄47178.21 67.24 90.36 大黄 24102.3093.34115.72大黄48203.09 107.08 91.95 大黄
(5)加样回收率试验:取TCD物质基准适量(S1),精密称定,分别以指标成分含量的50%、100%、150%分别加入各指标成分对照品储备液各3份,按“3.1.1”项下色谱条件进样,计算个指标成分含量及其回收率。测得甘草酸、肉桂酸、芦荟大黄素、大黄酸、大黄素、大黄酚的平均加样回收率分别为99.37%、100.82%、100.36%、100.76%、96.81%、96.55%,RSD分别为2.72%、3.71%、3.23%、2.24%、1.60%、1.72%,表明该方法的准确度较好。
3.2 TCD处方药味各指标成分在药材、饮片、水煎液和物质基准中的含量测定结果
以随行对照品溶液为对照,按“3.1”项下方法分别测定15批TCD药材、饮片、水煎液、冻干粉中6个指标成分的含量。苦杏仁苷的含量按照文献方法[13]测定。
3.3 TCD处方药味各指标成分含量在药材-饮片-水煎液-物质基准之间的传递规律
计算药材-饮片-水煎液-物质基准中指标成分含量的转移率,考察过程中的传递规律。
转移率=(××10)/(×)
表示物质基准中指标成分的质量分数,表示物质基准样品质量,表示饮片中有效成分的质量分数,表示处方中饮片质量
各药味指标成分含量测定结果及转移率结果如表3~6及图3所示。苦杏仁苷、甘草酸、肉桂酸、大黄总游离蒽醌的质量分数范围分别在0.265%~0.732%、0.365%~1.060%、0.015 4%~0.050 5%、0.074%~0.207%,饮片-物质基准平均转移率分别为21.03%、21.16%、35.96%、5.06%。
表3 桃仁药味药材-饮片-水煎液-物质基准苦杏仁苷含量及转移率
Table 3 Content and transfer rate of amygdalin in the process of medicinal materials-decoction pieces-decoction-substance benchmarks
物质基准批次苦杏仁苷含量苦杏仁苷转移率/% 药材/%饮片/%水煎液/(mg∙mL−1)物质基准/%药材-饮片饮片-水煎液水煎液-物质基准饮片-物质基准 13.012.230.3060.32776.3636.3739.1214.23 23.184.150.6960.40865.7130.6363.7419.52 32.993.970.4370.49198.9024.7167.0916.58 43.402.040.2710.41094.3015.1884.2612.79 53.022.170.3040.554103.9118.0297.9117.64 62.734.300.6530.497108.9525.6565.2916.75 73.402.270.2510.557100.8516.3499.3916.24 83.972.290.2430.55069.1221.2394.4020.04 92.954.320.5340.26554.6621.7275.6416.43 103.532.310.2470.51090.1823.5568.0316.02 112.032.130.2340.676117.9627.47102.6128.19 122.622.210.2180.71386.2223.85132.4431.59 133.964.110.6470.64259.8225.63105.5927.06 142.401.870.2860.59896.5628.1791.8625.87 152.292.460.2520.73287.6020.65176.8936.53 均值3.032.860.3720.52987.4123.9490.9521.03
表4 甘草药味药材-饮片-水煎液-物质基准甘草酸含量及转移率
Table 4 Content and transfer rate of glycyrrhizic acid in the process of medicinal materials-decoction pieces-decoction- substance benchmarks
物质基准批次甘草酸含量甘草酸转移率/% 药材/%饮片/%水煎液/(mg∙mL−1)物质基准/%药材-饮片饮片-水煎液水煎液-物质基准饮片-物质基准 12.832.280.3120.53678.9120.03120.0024.04 25.154.240.7101.06080.5627.3093.0325.40 36.984.050.4460.82856.9518.88110.4420.85 43.042.080.2770.44466.7722.4797.0321.80 53.962.210.3100.53254.8124.05102.0724.55 64.224.390.6670.973102.0525.2889.3722.59 73.222.320.2560.41470.5018.8197.0918.26 83.432.340.2480.43666.8118.45103.2319.05 95.254.410.5450.95082.4228.5976.8321.97 102.722.360.2520.46484.9522.8787.7020.06 112.662.170.2390.38279.9519.1793.6017.95 123.142.260.2230.39270.4717.58100.5917.68 135.474.200.6601.03075.2225.3998.4825.00 143.791.910.2920.36549.2520.9993.2019.57 153.522.510.2570.45969.8416.56112.4318.62 均值3.962.920.3800.61772.6321.7698.3421.16
表5 桂枝药味饮片-水煎液-物质基准肉桂酸含量及转移率
Table 5 Content and transfer rate of cinnamic acid in the process of medicinal materials-decoction pieces-decoction- substance benchmarks
物质基准批次肉桂酸含量肉桂酸转移率/% 饮片/%水煎液/(mg∙mL−1)物质基准/%饮片-水煎液水煎液-物质基准饮片-物质基准 10.0970.032 60.050 549.05106.0352.01 20.1250.018 90.026 724.6186.5621.31 30.1250.018 70.036 125.67112.4628.87 40.0440.016 00.023 861.5788.5054.49 50.0590.008 90.015 426.01100.5726.16 60.0320.017 90.023 092.5577.2171.46 70.1850.024 20.036 822.2389.2619.84 80.0760.013 20.024 830.10108.2432.59 90.1340.024 20.041 541.7673.9930.90 100.0620.013 90.025 848.0886.5441.61 110.1440.025 20.036 430.5582.8925.32 120.0740.011 40.024 827.78121.4233.73 130.0860.013 20.021 424.74100.0524.76 140.1430.031 40.032 930.2176.3523.06 150.0750.017 10.029 236.75105.5338.78 均值0.0970.019 10.029 938.1194.3735.96
表6 大黄药味药材-饮片-水煎液-物质基准大黄总游离蒽醌含量及转移率
Table 6 Content and transfer rate of rhubarb total free anthraquinone in the process of medicinal materials-decoction pieces-decoction-substance benchmarks
物质基准批次大黄总游离蒽醌含量大黄总游离蒽醌转移率/% 药材/%饮片/%水煎液/(mg∙mL−1)物质基准/%药材-饮片饮片-水煎液水煎液-物质基准饮片-物质基准 12.402.500.043 20.088104.172.53146.203.69 22.403.090.085 10.141128.754.49111.255.00 32.602.570.048 90.10798.853.26132.754.33 41.902.600.113 60.207136.847.36112.508.28 51.902.450.046 10.098128.953.23122.873.96 62.502.950.078 20.131118.004.42103.684.58 71.802.950.036 70.074163.892.12112.072.38 81.802.900.041 30.090161.112.47119.552.96 92.402.880.052 00.115120.004.1994.053.94 102.402.700.059 20.129112.504.71107.385.06 112.101.800.075 70.14985.717.32113.608.32 121.902.590.081 00.164136.325.58116.326.49 132.703.690.065 00.127136.672.85114.033.25 143.302.000.054 00.09360.613.70114.414.23 152.001.500.069 10.14375.007.46126.839.46 均值2.272.610.063 30.124117.824.38116.505.06

图3 TCD物质基准指标成分转移率
4 TCD物质基准制备过程中各药味干膏率传递规律研究
按“2.1”项下方法制备15批物质基准样品,测定其干膏率。计算公式为干膏率=/,式中表示物质基准样品的质量,表示饮片投料量。结果见表7。
为了解饮片-物质基准传递过程中干膏率的变化,根据单味药剂量在全方中的占比以及各单味药饮片的干膏率,计算全方中各单味药折算加和后的理论干膏率,计算公式为理论干膏率=∑单味药干膏率×(单味药生药量/全方生药量)。
由表7及图4所示,15批全方物质基准的理论干膏率范围为21.98%~29.41%,实际干膏率范围在14.02%~23.21%,干膏率的传递率均值为78.68%。
5 讨论
本研究从指标成分含量、特征图谱和干膏率3方面对药材-饮片-水煎液-物质基准开展质量相关性研究[14-17],由点到面地阐明经典名方关键质量属性从饮片炮制到水煎煮再到浓缩冻干的长流程制备过程中的传变规律,为构建全过程质量控制体系提供数据支撑,为TCD复方制剂的开发提供科学依据。
表7 15批TCD单味药饮片、物质基准的干膏率及传递率结果
Table 7 Results of dry extract rate and transfer rate of substance benchmarks of TCD and each decoction pieces
物质基准批号干膏率/%传递率/% 桃仁大黄甘草桂枝芒硝全方理论全方实际 S19.8419.8834.305.7247.2323.8022.1993.26 S29.5327.2539.524.1042.3126.3920.1876.49 S36.3720.8730.855.5844.7522.8819.1383.63 S48.4227.6126.583.5544.8424.4619.5279.80 S57.9918.8629.133.0948.1722.2219.2086.42 S68.2030.8432.694.5346.3126.6919.2972.29 S78.6918.3336.544.1845.7422.8118.8382.54 S87.7820.5127.804.1144.7921.9818.7785.38 S98.0422.8332.983.8944.6823.6614.0259.27 S108.1925.4331.284.1644.7324.5315.3062.38 S117.0720.7031.293.6455.9523.9518.1175.61 S127.9522.9227.333.2644.7822.6018.2480.74 S138.0824.6631.002.8447.4024.2520.1282.94 S145.2328.4633.967.2465.6729.4123.2178.92 S1510.8423.9428.044.3553.2025.2620.3380.50 均值8.1523.5431.554.2848.0424.3319.1078.68

图4 TCD物质基准出膏率及其传递率分析
在建立特征图谱和含量测定方法时,课题组前期已考察了不同色谱柱、体积流量、流动相、柱温对建立方法的耐用性;采用DAD检测器对供试品溶液在200~400 nm波长下进行扫描。针对小极性成分,检测波长在210~260 nm时,出峰信息较多,选择君药大黄的指标成分游离蒽醌类的药典检测波长254 nm为特征图谱1检测波长,该波长下色谱峰信息较多,基线较平稳,分离度良好;针对大极性成分,检测波长在210~230 nm时,出峰信息较多,选择君药桃仁的指标成分苦杏仁苷的药典检测波长210 nm为特征图谱2检测波长,该波长下各色谱峰信息较多,响应强度高,分离度良好。建立含量测定方法时,以最大响应强度及分离度为评价指标,选择各药味的检测波长。
特征图谱从整体的角度模糊辨识待测成分的特征性,不适合精确定量。因此,将15批TCD物质基准的特征图谱拟合出共有模式,以每个特征峰峰面积与该峰所属药材在该特征图谱中所有特征峰的总面积的比值作为此特征峰的相对峰面积进行后续计算,以期半量化地呈现各药味中化学成分在长流程制剂过程中的整体变化趋势。在指标性成分量质传递规律研究中,发现苦杏仁苷在药材-饮片的过程中含量有所降低,可能是由于桃仁在饮片炮制过程中为实现“杀酶保苷”而燀制,高温煎煮使苦杏仁苷含量降低[18]。大黄游离蒽醌类成分在药材-饮片传递过程中含量升高,原因可能在于大黄药材炮制成饮片的过程中经净制除去杂质,使得饮片中游离蒽醌类成分纯度提高。在煎煮过程中转移率较低,这可能由于蒽醌类成分极性偏小,在水中溶解度较低所致;在水煎液-物质基准的过程中含量升高,这很可能与含量测定时提取溶剂不同有关,蒽醌类成分在30%甲醇中的溶解度高于水,使得提取率升高。甘草酸在15批TCD物质基准中含量差异较大,调查文献发现,甘草酸在甘草的不同部位含量差异大,进而导致不同批次甘草中甘草酸含量差异较大[19]。建议在今后进行含有甘草方剂物质基准的制备时将甘草混批投料,并严格将饮片按部位及大小分等,以确保物质基准质量的稳定。
在分析15批TCD物质基准干膏率时,发现全方的实际干膏率低于理论值,且有4批物质基准干膏率在均值±10%范围以外。分析原因可能为第14批TCD中芒硝的干膏率远高于其他批次,导致第14批全方的干膏率偏高,对15批干膏率均值产生影响。此外,不同产地饮片的质量差异也会导致干膏率有所不同。与单味药相比,全方药味、药量更多,吸水量更大[20],故导致全方的实际干膏率低于理论值。
6 结论
本实验通过对各单味药材、饮片关键质量属性研究,以药材投入配方的处理过程为序逐级进行药材-饮片-水煎液-物质基准量质传递规律研究,证实TCD物质基准制备过程中特征峰相对峰面积、各指标性成分及干膏率均可稳定传递。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家药品监督管理局. 关于发布古代经典名方中药复方制剂简化注册审批管理的规定的公告[EB/OL]. [2018-05-29]. http:/www.nmpa.gov.cn/WS04/CL2093/ 228247.html.
[2] 国家中医药管理局. 关于发布《古代经典名方目录(第一批)》的通知[EB/OL]. (2018-04-16) [2018-04-16]. 2018. http://kjs.satcm.gov.cn/zhengcewenjian/2018-04- 16/7107.html.
[3] 汉·张仲景述. 晋·王叔和撰次. 钱超尘, 郝万山整理. 伤寒论 [M]. 北京: 人民卫生出版社, 2005: 95.
[4] 杨伟娜, 杨军娜, 姚伊. 桃核承气汤通过JAK2/STAT1信号通路干预急性盆腔炎模型大鼠的研究 [J]. 中国医院用药评价与分析, 2019, 19(9): 1075-1078, 1082.
[5] 李秀明. 桃核承气汤治疗热郁血瘀型盆腔炎大鼠的实验研究 [D]. 哈尔滨: 黑龙江中医药大学, 2008.
[6] 朱小刚. 桃核承气汤治疗黏连性肠梗阻患者的效果 [J]. 黑龙江医药科学, 2021, 44(1): 130-131.
[7] 张成玲, 谭艺, 魏庆骅, 等. 基于网络药理学的桃核承气汤治疗子宫内膜异位症的作用机制研究 [J]. 世界中医药, 2021, 16(23): 3472-3477.
[8] 王红宇, 冀成玉, 常娜. 桃核承气汤对子宫内膜异位症患者临床疗效及可能作用机制研究 [J]. 世界中医药, 2020, 15(11): 1598-1602.
[9] 郑秋霞, 应翩, 张洁, 等. 桃核承气汤加减治疗血瘀型子宫内膜异位症的疗效及对患者肿瘤标志物水平的影响 [J]. 中国妇幼保健, 2021, 36(6): 1257-1259.
[10] 潘泓. 桃核承气汤加减治疗异位妊娠3例 [J]. 中国乡村医药, 2020, 27(19): 16-17.
[11] 田同儒, 张福文, 李柏, 等. 加味桃核承气汤治疗非酒精性脂肪肝痰阻血瘀证临床观察 [J]. 中国中医药现代远程教育, 2021, 19(9): 112-113.
[12] 陈羽, 申建国, 张亮, 等. 加味桃核承气汤对脓毒症胃肠功能障碍患者肠胃动力、免疫指标及肝肾功能的影响 [J]. 湖南师范大学学报: 医学版, 2021, 18(2): 65-68.
[13] 关雅戈, 罗赣, 高晓燕, 等. 经典名方桃核承气汤物质基准关键质量属性研究 [J]. 中草药, 2021, 52(8): 2267-2275.
[14] 代云桃, 靳如娜, 吴治丽, 等. 基于标准汤剂(物质基准)的经典名方制备工艺和质量标准研究 [J]. 中国实验方剂学杂志, 2020, 26(2): 164-174.
[15] 王青云. 《按古代经典名方目录管理的中药复方制剂有关指导原则 (征求意见稿)》发布 [J]. 中医药管理杂志, 2021, 29(9): 121.
[16] 黄仕文, 颜媛媛, 嵇晶, 等. 经典名方质量研究及其量值传递关键技术 [J]. 南京中医药大学学报, 2021, 37(3): 446-449.
[17] 苗家燕, 罗赣, 高晓燕, 等. 经典名方当归四逆汤物质基准的关键质量属性研究 [J]. 分析测试学报, 2021, 40(5): 740-746.
[18] 汤庆发, 谢颖, 陈飞龙, 等. 苦杏仁中苦杏仁苷的存在形式及其影响因素 [J]. 中国实验方剂学杂志, 2013, 19(8): 107-109.
[19] 王汉卿, 雍婧姣, 肖东, 等. 宁夏产甘草不同组织部位成分差异比较 [J]. 中华中医药杂志, 2019, 34(6): 2672-2675.
[20] 齐琪, 赵玥瑛, 张晴, 等. 经典名方小承气汤的物质基准量值传递研究 [J]. 中草药, 2021, 52(10): 2927-2937.
Analysis on transmission law of critical quality attributes of classical prescription Taohe Chengqi Decoction substance benchmarks
LIU Yu-han, GUAN Ya-ge, HAN Chen, SHI Yu-lian, ZHAI Chuan-jia, LI Xue-jiao, LUO Gan, GAO Xiao-yan
School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
To explore the transfer law of critical quality attributes of Taohe Chengqi Decoction (TCD, 桃核承气汤) substance benchmarks.A total of 15 batches of TCD lyophilized powder samples were prepared as the substance benchmarks. Specific chromatograms, index component contents and dry extract rates were determined and the transfer rates of the above indexes in the process of medicinal material-decoction piece-decoction-substance benchmarks were calculated.The 48 characteristic peaks originated from the specific chromatogram did not lost across the whole process, and most of the transfer rates of relative areas of characteristic peaks were in the range of 70%—130% of the mean. The average transfer rates from decoction pieces to substance benchmarks of amygdalin, glycyrrhizic acid, cinnamic acid and rhubarb total free anthraquinone were (21.03 ± 6.83)%, (21.16 ± 2.60)%, (35.96 ± 14.04)%, (6.01 ± 2.05)%, respectively. The average transfer rate of dry extract rate of 15 batches of TCD was 78.68%.The critical quality attributes of TCD substance benchmarks can be stably transferred from medicinal material to decoction piece to decoction finally to substance benchmarks. This study preliminarily constructs the quality control system of the whole process of substance benchmarks preparation of TCD, which provides a method reference for the development of subsequent compound preparations.
classical prescription; Taohe Chengqi Decoction; substance benchmarks; characteristic spectrum; critical quality attributes; quality value transmitting; amygdalin; glycyrrhizic acid; cinnamic acid; anthraquinone
R283.6
A
0253 - 2670(2022)07 - 2011 - 11
10.7501/j.issn.0253-2670.2022.07.010
2021-10-22
中央高校基本科研业务费专项资金资助(2020-JYB-ZDGG-033)
刘雨涵(1998—),女,硕士研究生,研究方向为中药分析。Tel: 18811367715 E-mail: 670752348@qq.com
高晓燕(1967—),博士,教授,主要从事中药分析及药效物质研究。Tel: 13439727699 E-mail: gaoxiaoyan@bucm.edu.cn
[责任编辑 郑礼胜]
