苦地丁化学成分和体内代谢产物的LC-MS鉴定
2022-03-31艳2李木子2谢亚萍2曲晓洋2谭晓斌2崔国倩2朱粉霞2
项 艳2,李木子2,谢亚萍2,曲晓洋2,谭晓斌2,崔国倩2,朱粉霞2*
苦地丁化学成分和体内代谢产物的LC-MS鉴定
项 艳1,2,李木子1, 2,谢亚萍1, 2,曲晓洋1, 2,谭晓斌1, 2,崔国倩1, 2,朱粉霞1, 2*
1. 南京中医药大学附属中西医结合医院,江苏 南京 210028 2. 江苏省中医药研究院 国家中医药管理局中药口服释药系统重点实验室,江苏 南京 210028
研究苦地丁提取物中的化学成分和体内代谢产物,探究其代表性成分质谱裂解规律。采用高效液相色谱-电喷雾质谱联用技术(HPLC-Q-TOF/MS),正离子模式扫描,对苦地丁提取物和大鼠口服苦地丁提取物后不同时间段内的血浆、胆汁、尿液和粪便分别进行检测分析,通过与对照品和文献比对保留时间和质谱碎片信息,确定化学成分归属及其裂解方式,预测代谢产物的动态变化。在苦地丁提取物中共鉴定得31个化合物,其中共有21个化合物以原型进入体内;并以紫堇灵为研究对象,在大鼠血浆、胆汁、尿液和粪便中分别发现3、3、4、4个代谢产物。借助HPLC-Q-TOF/MS方法鉴定了苦地丁体外化学成分和体内以原型存在的化学成分,阐明了代表性成分紫堇灵的代谢产物及代谢规律,推测苦地丁在体内发生了I相和II相代谢,其中以II相代谢方式为主(硫酸化、糖基化、甲基化和去甲基化),为阐明苦地丁的药效物质基础提供依据。
苦地丁;HPLC-Q-TOF/MS;代谢产物;紫堇灵;原阿片碱
苦地丁为中医和蒙医常用药材,是罂粟科紫堇属植物地丁草Turcz.的干燥带跟全草,为《中国药典》和《卫生部药品标准·蒙药》收录品种,其产地分布于辽宁、河北、山东、山西等地。苦地丁性寒、味苦,具有清热解毒、散结消肿的功效[1]。现代药理研究表明,苦地丁对感冒发热、咽喉疼痛等多种炎症和肝胆病有较好的疗效[2],近年来受到国内外学者的广泛关注。苦地丁化学成分主要为生物碱和黄酮[3],目前,有关其化学成分的研究主要集中在提取分离、鉴定及药理活性等[4],对其化学成分的体内代谢研究未有报道。
液质联用技术具有高效、快速、灵敏的特点,对于中药复杂体系的分析有着显著优势,已被广泛应用于中药化学成分及体内代谢产物的高通量分析[5]。本实验采用超高效液相色谱与飞行时间质谱联用(HPLC-Q-TOF/MS)技术,分析苦地丁化学成分的质谱裂解规律,并应用于其在大鼠体内(血浆、尿液、粪便、胆汁)化学成分和代谢产物的鉴定,建立了苦地丁“体外化学成分群—大鼠体内化学成分群”的研究框架,为明确苦地丁体内药效物质及其质量控制的研究奠定基础,也为苦地丁的药理活性研究以及进一步开发利用提供依据。
1 仪器与材料
1.1 仪器
HH-4型数显恒温水浴锅(常州金坛区环宇科学仪器厂);KQ2200V型超声波清洗器(昆山市超声仪器有限公司);TGL-16G型高速台式离心机(上海安亭科学仪器厂);RE-5203型旋转蒸发器(上海亚荣生化仪器厂);Mettler Toledo分析电子天平(Mettler Toledo分析仪器有限公司);IKA VORTEX GENIUS 3涡旋混合器(德国IKA公司);SIL-20A型液相色谱仪(日本Shimadzu公司);Triple TOF TM 5600 System-MS/MS高分辨四极杆飞行时间质谱仪(美国AB Sciex公司);Milli-Q超纯水系统(美国Millipore公司)。
1.2 药品与试剂
苦地丁(江苏济川药业有限公司,批号20180331)经江苏省中医药研究院朱粉霞研究员鉴定为罂粟科紫堇属植物地丁草Turcz.的干燥带根全草;乙腈、甲醇(德国Merck公司);氨水(日本Tokyo Chemical Industry公司);生理盐水(安徽丰原药业股份有限公司);对照品右旋异紫堇定、血根碱、乙酰紫菫灵、二氢血根碱(宝鸡市辰光生物科技有限公司,质量分数均为98%)、延胡素乙素、原阿片碱(中国食品药品检定研究院,质量分数均为98%)、紫菫灵(实验室自制,质量分数98%);10%水合氯醛溶液(江苏省中医院)。
1.3 动物
SD雄性大鼠,体质量(220~250 g),由江苏省中医药研究院实验动物中心提供,许可证号:SYXK(苏)2016-0018。动物实验均按照《中国实验动物管理立法规定及一般建议》进行,并经江苏省中西医结合医院研究伦理委员会批准(AEWC-20180727-43)。
2 方法
2.1 溶液的配制
(1)对照品溶液的配制:分别精密称取紫堇灵、乙酰紫堇灵、原阿片碱、延胡索乙素、二氢血根碱、血根碱和右旋异紫堇定对照品适量,置于10 mL量瓶中,用甲醇溶解并稀释至刻度,配制成对照品储备液;精密吸取对照品储备液1.0 mL,置于10 mL量瓶中,用甲醇稀释至刻度,得到含紫堇灵 0.134 mg/mL,乙酰紫堇灵0.120 mg/mL,原阿片碱 0.057 mg/mL,二氢血根碱0.048 mg/mL、延胡索乙素0.038 mg/mL、血根碱0.042 mg/mL和0.055 mg/mL右旋异紫堇定的对照品溶液。
(2)动物给药药液的配制:取苦地丁药材,加10倍量的80%乙醇提取2次,每次1.5 h,减压浓缩提取液制得苦地丁浸膏。称取苦地丁浸膏适量,加入一定量的生理盐水,超声(250 W、33 kHz)溶解,制得0.1 g/mL的苦地丁提取物,用于动物ig给药。
(3)供试品溶液的配制:取苦地丁浸膏0.2 g,精密称定,置具塞锥形瓶中,精密加入80%甲醇50 mL,密塞,超声(250 W、33 kHz)处理30 min,滤过,取续滤液以0.22 μm微孔滤膜滤过,得到约3 mg/mL的液质供试品溶液。
2.2 动物实验及样本收集
2.2.1 动物实验 取18只SD雄性大鼠,实验前于SPF级动物房适应性饲养1周,室温(25±2)℃,湿度60%~70%,12 h昼夜更替。给药前12 h禁食,不禁水,实验组大鼠ig给以1 g/kg苦地丁提取物,空白组大鼠ig给予等剂量生理盐水。
2.2.2 生物样品采集及制备 于ig给药2、4、8、12 h后,眼底静脉丛取血(每个时间点取约0.2 mL)置于含肝素钠的EP管中,静置15 min后,3000 r/min离心10 min,分离得血浆;于血浆中加入3倍体积的甲醇涡旋1 min,以12 000 r/min离心10 min,取上清,在45 ℃水浴下氮气吹干,并储存在−80 ℃冰箱中。
收集0~4、4~8、8~12 h的尿液,取各时间段内的尿液样品2 mL,分别加入3倍体积的甲醇进行混合,涡旋震荡,以12 000 r/min离心10 min,取上清。收集0~12 h内的粪便样品,取1 g粪便溶于5倍量甲醇中,在25 ℃水浴中超声处理30 min后,以12 000 r/min离心10 min,取上清。将尿液和粪便上清液在45 ℃水浴下氮气吹干,并储存在−80 ℃冰箱中。
胆汁组按照0.5 mL/100 g ip 10%的水合氯醛溶液,待大鼠麻醉后,收集0~4、4~8、8~12 h胆汁样品。取胆汁样品2 mL加入到3倍体积的甲醇中进行混合后,涡旋震荡,以12 000 r/min离心10 min,取上清,在45 ℃水浴下氮气吹干,并储存在−80 ℃冰箱中。
在进样分析之前,向粪便、尿液和胆汁样品残渣分别加入1 mL甲醇,血浆样品残渣中加入200 μL甲醇复溶,涡旋震荡,并在12 000 r/min下离心10 min,取上清液注入HPLC-Q-TOF/MS系统进行分析,进样体积为10 µL。
2.3 色谱条件
色谱柱:Gemini C18柱(250 mm×4.6 mm,5 μm,美国Phenomenex公司);流动相:乙腈(A)-0.05%氨水(B),洗脱程序:0~35 min,15%~55% A;35~45 min,55%~60% A;45~60 min,60%~75% A;60~63 min,75%~100% A。体积流量1 mL/min,柱温为35 ℃,进样体积为10 μL,检测波长289 nm。
2.4 质谱条件
质谱仪采用电喷雾离子化源(ESI),正离子模式:喷雾电压(ISVF)5500 V;离子源温度(TEM):600 ℃;雾化气体为氮气,雾化气60 L/h;辅助加热气60 L/h;气帘气速率40 L/h;碰撞能量40 eV,碰撞能量扩展为20 eV。TOF Masses为50~1500;数据采集所用软件为 Analyst TF 1.6 software,数据处理软件为Peakview 1.2。
3 结果
3.1 苦地丁提取物中化学成分的鉴定及其质谱裂解规律解析
本实验基于HPLC-Q-TOF/MS技术,采用正离子模式对苦地丁的化学成分进行检测。结合文献报道、TCMSP数据库(https://old.tcmsp-e.com)中收载的苦地丁化学成分信息,对照品色谱保留时间,精确相对分子质量、同位素丰度比、分子碎片峰、二级质谱图等信息,共推断出31个化合物,其中30个为生物碱成分,1个为黄酮类成分,这与文献报道一致[6-8],即生物碱是苦地丁的主要化学成分。总离子流图如图1所示,化合物的鉴定信息见表1,化合物结构式见图2。
3.1.1 苦地丁异喹啉类生物碱质谱裂解规律 苦地丁中的化学成分大部分属于异喹啉类生物碱,LC-MS鉴定出的30个生物碱成分中,异喹啉类生物碱有28个,其他生物碱2个。而异喹啉类生物碱按整体结构可分为苄基异喹啉类和简单异喹啉类,其中苄基异喹啉类生物碱按骨架区分为苯菲啶型、普罗托品型、小檗碱型等7类,而LC-MS鉴定出的30个中有16个属于苯菲啶型生物碱,代表性化合物是药典规定的指标性成分紫堇灵,也是目前苦地丁中药理活性研究较多的化合物[9]。延胡索乙素和原阿片碱分别为原小檗碱型和普罗托品型异喹啉类生物碱代表性成分。故详细解析这3类代表性化合物的质谱裂解规律。
表1 苦地丁提取物化学成分鉴定信息
Table 1 Attribution of chemical components of extract from C. bungeana
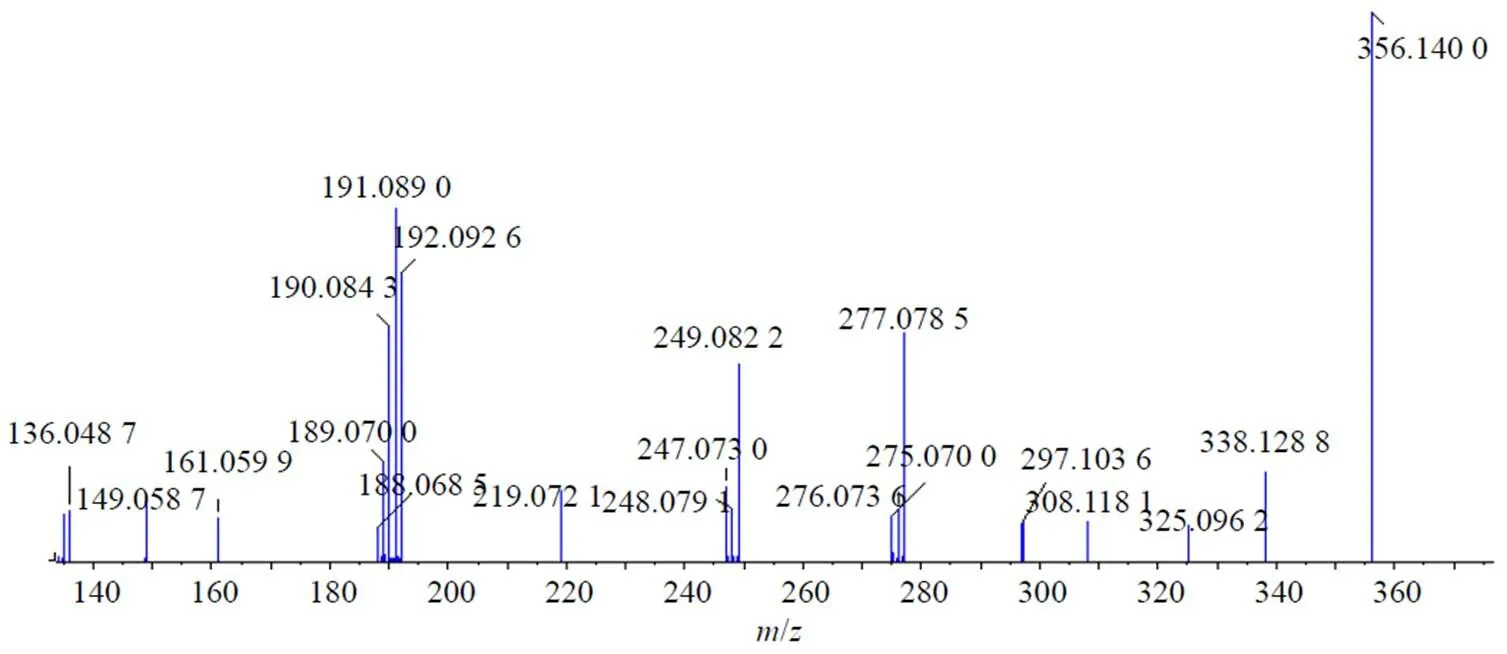
序号tR/min分子离子峰相对分子质量碎片离子分子式化合物名称误差(×10−6) 1 3.268327.15328.153 2178.077 4, 165.062 9, 152.061 6, 265.084 7C19H21NO4金黄紫堇碱0.4 2 3.312327.41328.154 2297.113 1, 265.085 2, 237.090 0C19H21NO4异波尔定−0.2 3 3.389327.40328.152 0297.111 9, 235.073 0, 191.084 3, 222.067 2, 235.073 0C19H21NO4紫堇块茎碱0.4 4 5.507339.40340.154 3309.136 9, 192.057 9C20H21NO4四氢小檗碱0.4 5 6.325313.38314.136 7177.053 2, 145.028 0, 121.064 9C18H19NO4N-反式-阿魏酰酪胺0.6 6 9.917391.38392.111 3332.090 5, 318.076 0C22H17NO6spallidamine0.9 719.819286.00286.142 7269.116 1, 107.049 0C15H10O6山柰酚−0.8 825.194299.40300.158 7191.086 5, 107.049 1, 177.079 4C18H21NO3衡州乌药碱0.8 925.517381.40382.128 0333.076 4, 275.070 5, 247.075 5, 189.069 2, 135.043 7C21H19NO68-氧紫堇灵0.7 1027.371395.40396.180 4209.093 4, 111.044 8, 286.143 7C23H25NO5白僵菌黄色素−0.9 1128.699383.43384.143 4353.054 4, 335.113 5, 277.092 8C21H21NO612-羟基紫堇灵0.2 1228.793325.30326.137 2311.114 9, 178.084 9, 151.075 2, 91.055 2C19H19NO4碎叶紫堇碱0.9 13*28.885341.41354.133 2324.123 5, 249.089 5, 247.076 4, 149.059 0C20H23NO4右旋异紫定碱0.1 1431.399367.36368.116 0249.190 0, 277.307 0, 177.017 9, 190.084 9C20H17NO6比枯枯灵碱−1.0 1534.448347.34348.153 2333.063 0, 305.067 3C20H13NO5氧化血根碱1.0 16*34.570355.43356.140 0191.089 0, 190.084 3, 161.059 9C21H25NO4延胡索乙素−6.5 17*35.789354.40355.367 9336.123 1, 320.091 5, 188.069 3, 189.075 4, 190.084 8,149.058 7, 91.055 2, 165.055 4, 275.069 0, 206.080 1C20H19NO5原阿片碱−0.3 1836.688365.38366.132 2317.079 1, 289.084 6, 206.080 2, 147.044 1C21H19NO5紫堇洛星碱−0.7 1936.873367.43368.136 2337.104 4, 190.084 8, 307.060 0, 277.051 0C21H21NO5紫堇文碱−0.9 20*37.585332.30333.288 0317.068 8, 274.085 6, 246.090 5, 218.090 4, 189.069 2C20H14NO4血根碱−9.4 2138.488367.43368.406 1319.094 7, 289.084 4, 177.053 3C21H21NO513-表紫堇灵−0.9 22*38.580367.43368.149 8319.095 9, 289.085 6, 261.090 3, 231.079 7, 177.053 7C21H21NO5紫堇灵−0.9 2338.881393.42394.127 1319.085 3, 290.081 3, 334.109 0C22H19NO6地丁紫堇碱0.7 2440.703323.34325.126 5174.054 6, 175.058 0, 149.059 5, 177.073 7C19H17NO4四氢黄连碱0.6 25*48.921409.15410.158 3350.136 9, 289.084 7, 261.089 2, 162.055 0C23H23NO6乙酰紫堇灵−0.5 2649.242368.40369.406 1289.083 9, 261.091 9, 177.054 4C21H21NO511-表紫堇灵−0.9 2749.358409.15410.160 6348.123 5, 321.112 2, 337.106 0, 190.085 9, 176.069 8C23H23NO6乙酰异紫堇灵−0.5 2849.569317.31318.075 3290.080 9, 261.079 5, 201.057 7, 174.046 4C19H11NO4去甲血根碱0.5 2952.629337.40338.137 6163.054 9, 176.070 0, 149.059 6, 135.044 4C20H19NO4紫堇萨明0.8 30*53.892333.10334.107 9319.082 8, 261.079 2C20H15NO413,14-二氢血根碱−0.4 3164.153339.16340.067 3192.102 9、149.077 3C20H21NO4四氢表小檗碱0.4
*表示与混合对照品比对的结果
*indicates the comparison of mixed reference materials
(1)苯菲啶型:从苦地丁中鉴定了30种生物碱,其中16个化合物以异喹啉环上的氮原子的邻位和间位与萘环稠而成的苯菲啶型生物碱母核,其母核形成了1个大π系统,故而很难发生裂解,且异喹啉环上的氮原子上常常连有甲基,这是苯菲啶类生物碱的特征性结构[10-11]。紫堇灵是苦地丁中苯菲啶类异喹啉型生物碱的代表性成分,也是药典规定的苦地丁质量标准指标,在保留时间38.58 min处检测出紫堇灵。其分子离子峰为368.149 8,化学组成为C21H21NO5,其二级质谱产生350 [M-H2O]+、319 [M-H2O-OHCH2]+、304 [M-H2O-OHCH2-CH2]+、289 [M-H2O-OHCH2-CH2-OHCH2]+、259 [M-H2O-OHCH2-CH2-OHCH2-CH2O]+、177 [M-H2O-OHCH2-(OCH2)2C6H14]+等碎片离子,其二级质谱图及详细裂解方式见图3。
图2 苦地丁提取物质谱鉴定出的31个化合物结构式
Fig. 2 Structures of 31 known chemical constituents
(2)原小檗碱型:原小檗碱类生物碱是苦地丁另一数量较多的一类化学成分,本实验鉴定出7个化合物,分别为1、4、12、16、24、29、31,它们的C环上易发生逆-狄尔斯-阿尔德(RDA)反应,也可通过电子转移和重排使B环开裂,形成互补的碎片离子[12-13]。本研究选取延胡索乙素为苦地丁原小檗碱型生物碱代表。在保留时间34.57 min处,检测到延胡索乙素。其分子离子峰为356.140 0,化学组成为C21H25NO4,在正离子模式下,延胡索乙素B环的5、8位和C环的11、12位发生断裂,再脱去1分子甲氧基形成275 [M+H-C4H4-OCH3]+碎片离子和190 [M+H-C4H4-C8H6-(OCH3)2]+,在此基础上C-N键断裂、脱去1分子水、1分子甲基形成165 [M+H-C4H4-OCH3-C6H6OH]+、149 [M+H-C4H4-OCH3-C6H6OH-H2O]+的碎片离子。其详细二级质谱图及裂解方式见图4。
(3)普罗托品型:普罗托品型生物碱的种类较少,在苦地丁中的数量不多,但在紫堇属植物中分布最广。普罗托品型生物碱的母核不存在大π共轭系统,很容易发生断裂,进行RDA裂解与α裂解反应形成小片段分子,小分子片段会继续失去1分子羟基或者1分子水从而形成[M-17]+或者[M-18]+的碎片峰[14-15]。本研究选取原阿片碱为苦地丁异喹啉普罗托品型生物碱代表。在保留时间35.789 min处,检测到了原阿片碱。其分子离子峰为354.133 3,化学组成为C20H19NO5。在正离子模式下,原阿片碱脱去1分子水形成336 [M-H2O]+碎片离子,进一步裂解生成306 [M-H2O-2H-CO]+等碎片离子。与此同时原阿片碱母核发生可发生α裂解形成190 [M]+、165 [M]+等碎片离子和RDA裂解形成206 [M]+等碎片离子。其详细二级质谱图及裂解方式见图5。
3.1.2 苦地丁黄酮类成分质谱裂解规律 黄酮是一类含有2个苯环通过3个碳原子自相连结构的含氮化合物。在保留时间为19.819 min鉴定出山柰酚,其分子离子峰为286.142 7,化学组成为C15H10O6,在正离子模式下,其母核脱去1分子羟基产生269 [M-OH]+的碎片离子继而B环开裂形成237 [M-OH-CH3OH]+的碎片离子,143 [M-C2H7O4-CH3OH]+等碎片离子。其二级质谱图及裂解方式见图6。


3.2 大鼠血浆、尿液、粪便及胆汁的原型成分的HPLC-Q-TOF/MS鉴定
任何药物都是通过与机体的相互作用而发挥疗效。中药入血移行成分,是了解其药效物质基础的基本依据。为了解苦地丁的体内药效物质基础,本研究运用HPLC-Q-TOF/MS技术分别对空白样本(血浆、尿液、粪便、胆汁)及给药后不同时间段样本的代谢物进行分析,通过对比空白与含药样品色谱峰的保留时间及质谱数据,并结合对照品及苦地丁化学成分的质谱裂解规律,对苦地丁体内代谢产物进行了鉴定。
在给药0~2 h后的大鼠血浆中,发现了17个以原型存在的化合物;给药2~4 h后的大鼠血浆中,发现了13个原型化合物;给药4~8 h后的大鼠血浆中,发现了11个原型化合物;给药8~12 h后的大鼠血浆中,发现了10个以原型存在的化合物,具体信息见表2。在0~12 h内大鼠血浆中共发现了21个原型成分,其中大部分为生物碱成分,这一发现与课题组前期研究结果一致[16],苦地丁中生物碱组分是苦地丁抗炎药效组分相印证。
为了解苦地丁提取物的主要代谢途径,本实验解析了给药后大鼠在不同时间段胆汁、尿液和粪便中化合物代谢情况。结果表明进入机体的苦地丁提取物主要经胆汁代谢,经尿液排出体外,少量化合物经粪便排泄。
3.3 苦地丁主要成分代谢产物及代谢途径分析
药物代谢是影响药物作用的最关键因素之一。通过对苦地丁在体内代谢产物和代谢机制的研究,可进一步了解其临床应用的安全性、有效性。依据上述质谱解析结果发现,苦地丁在大鼠血浆、胆汁、尿液、粪便中的原型成分大多属于生物碱成分,其中最为显著的是苯菲啶型生物碱,紫堇灵又为苦地丁中最为典型的苯菲啶型生物碱,也是药典规定的指标性成分,且在大鼠血浆、胆汁、尿液、粪便中的含量均较高,故而本实验以紫堇灵为例解析苦地丁中主要化学成分苯菲啶型生物碱的代谢途径。

表2 苦地丁提取物在不同时间段大鼠血液、胆汁、尿液、粪便中的分布情况
Table 2 Metabolic distribution of C. bungeana extract in blood, bile, urine and feces of rats at different time periods
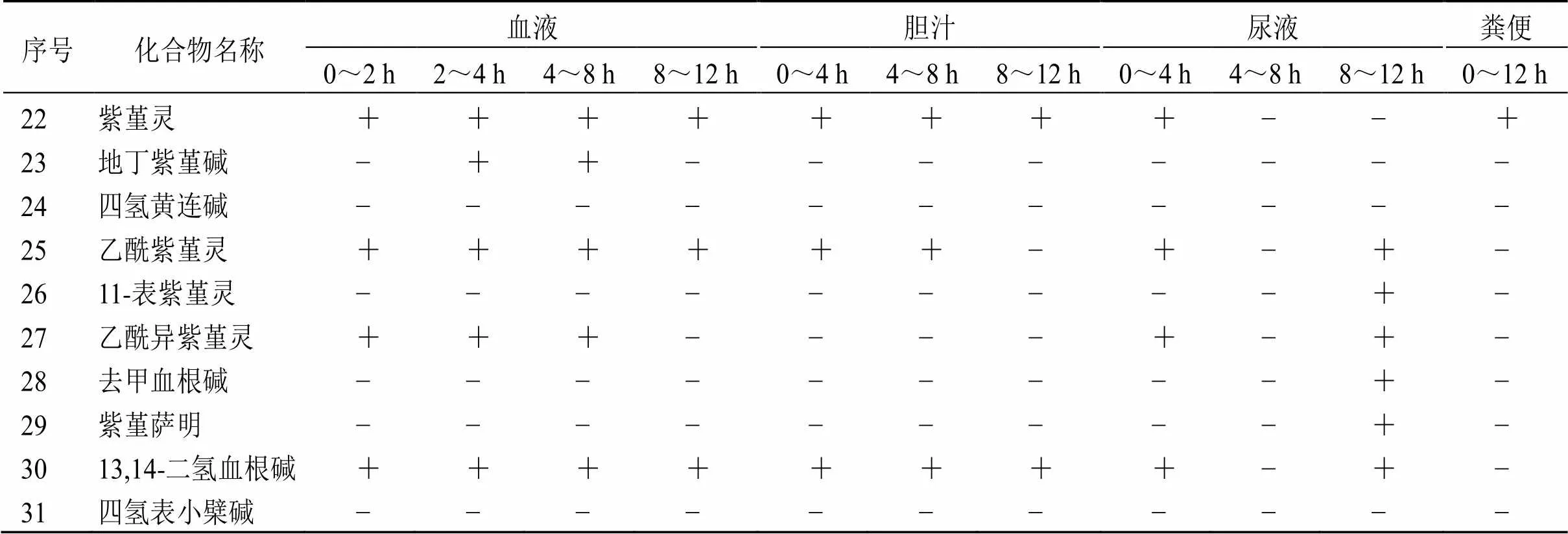
序号化合物名称血液胆汁尿液粪便 0~2 h2~4 h4~8 h8~12 h0~4 h4~8 h8~12 h0~4 h4~8 h8~12 h0~12 h 1金黄紫堇碱+++−−−−+−+− 2异波尔定++−−−+++−+− 3紫堇块茎碱+−+−−−−++−− 4四氢小檗碱−−−−−−−−−−− 5N-反式-阿魏酰酪胺+−−−−−−++−− 6spallidamine+−−−−−−−−+− 7山柰酚−−−−−−−−+−− 8衡州乌药碱−−−−−+−−−−+ 98-氧紫堇灵++−−−++++−− 10白僵菌色素−−−−−−−−−−− 1112-羟基紫堇灵++−−+−+++++ 12碎叶紫堇碱−−−++++−−+− 13右旋异紫堇灵−−−−−−−−−−− 14比枯枯灵碱−−−+++++++− 15氧化血根碱−−−++++−−+− 16延胡索乙素++−−−−−−−−− 17原阿片碱+++++++++++ 18紫堇洛星碱++++++++++− 19紫堇文碱+−+−+−−−−−− 20血根碱++−−+++−−−− 2113-表紫堇灵+−++−−−++−+
续表2
+表示检出;−表示未检出
+ indicates detected; − indicates not detected.
3.3.1 紫堇灵代谢产物的分析 紫堇灵符合苯菲啶型生物碱一般裂解规律,质谱分析发现,该类生物碱的质谱裂解主要可形成[M-H2O]+、[M-H2O-CH3]+、[M-H2O-NH2CH3]+等碎片离子。本研究运用HPLC-Q-TOF/MS技术,在大鼠血浆、胆汁、尿液、粪便中,均发现了紫堇灵原型(C0)的存在,同时在大鼠血浆中检测到3种紫堇灵代谢产物P1、P2、P3,胆汁中检测到3种紫堇灵代谢产物B1、B2、B3,尿液中检测到4种紫堇灵代谢产物U1、U2、U3、U4,粪便中检测到4种紫堇灵的代谢产物F1、F2、F3、F4。具体信息见表3。
表3 紫堇灵在大鼠血浆、胆汁、尿液、粪便中代谢产物分析
Table 3 Analysis of metabolites of corynoline in rat plasma, bile, urine and feces
序号tR/min分子式分子离子峰相对分子质量 (m/z)误差 (×10−6) C038.58C21H21NO5368.149 8367.395 1−2.3 P17.80C20H23NO5357.278 1357.400 3−3.4 P29.10C21H23NO9S466.317 3465.473 61.8 P39.50C25H29NO13S616.173 3615.646 68.6 C038.58C21H21NO5368.149 5367.395 10.7 B14.70C28H33NO10544.177 5543.562 31.1 B25.60C21H23NO9S466.313 8465.473 61.8 B37.80C27H31NO9514.279 2513.536 31.4 C038.58C21H21NO5368.149 5367.395 10.7 U15.50C20H19NO6370.126 3369.368 02.1 U27.30C23H23NO7426.153 2425.431 21.7 U37.70C28H33NO10544.178 5543.562 31.1 U418.60C21H19NO6382.129 0381.378 72.0 C038.58C21H21NO5368.148 7367.395 1−1.5 F111.20C24H25NO5408.311 3407.459 02.1 F213.80C27H33NO12563.261 6563.550 4−5.1 F318.50C23H27NO10477.269 6477.461 2−4.0 F421.90C18H19NO4S343.194 7343.396 9−5.9
3.3.2 紫堇灵代谢产物代谢途径分析
(1)紫堇灵在大鼠血浆中代谢途径分析:在保留时间7.8 min处,检测到了代谢产物P1。其分子离子峰为357.278 1,化学组成为C20H23NO5,比紫堇灵减少11,是20、25位C-O键断裂分别加上2个氢原子后,再脱去1分子甲基的相对分子质量。其二级质谱产生的碎片离子/339为该代谢产物脱去1分子水所产生的碎片。见图7。
在保留时间9.1 min处,检测到了代谢产物P2。其分子离子峰为466.317 3,化学组成为C21H23NO9S,比紫堇灵增加98,恰好是25位C-O键断裂被还原且23位C所连的甲基被硫化后的分子质量。其二级质谱产生的碎片离子/448、430和412为该代谢产物进一步脱水所产生的碎片。/337、319为该代谢产物去硫化后进一步脱甲基和水分子后所产生的碎片。
在保留时间9.5 min处,检测到了代谢产物P3。其分子离子峰为616.173 3,化学组成为C27H37NO13S,比紫堇灵增加248,恰好是25、26、20位C-O键断裂被还原,2位C被硫化后,8位C所连的羟基被乙酰基取代后加上1分子葡萄糖的分子质量。其二级质谱产生的碎片离子/557为14位C-N键断裂再脱去1分子甲基,18位C-O键断裂脱去1分子甲氧基后所产生的碎片。

(2)紫堇灵在大鼠胆汁中代谢途径分析:在保留时间4.7 min处,检测到了代谢产物B1。其分子离子峰为544.177 5,化学组成为C28H33NO10,比紫堇灵增加176,是27位羟基被1分子葡萄糖取代和16位C加上1分子甲基而得。其二级质谱产生的碎片离子/368为紫堇灵原型,/319、177皆为该代谢产物脱去1分子甲基和1分子葡萄糖后,紫堇灵的特征裂解碎片。见图8。
在保留时间5.6 min处,检测到了代谢产物B2。其分子离子峰为466.313 8,化学组成为C21H23NO9S,比紫堇灵增加98,是加上1个氧原子并硫化的分子质量。其二级质谱产生的碎片离子/430为该代谢产物脱去2分子羟基和1分子氢气产生的碎片,/412为该代谢产物脱去1分子水产生的碎片,/337为该代谢产物去硫化后脱去1分子羟基、1分子甲基和3分子氢气后产生的碎片,/319为该代谢产物进一步脱水产生。
在保留时间7.8 min处,检测到代谢产物B3。其分子离子峰为514.279 2,化学组成为C27H31NO9,比紫堇灵增加146,是加上1分子葡萄糖并脱去1个氧原子的相对分子质量。其二级质谱产生的碎片离子/496、478、460为该代谢产物脱水后产生的碎片。/335、307为该代谢产物脱去葡萄糖分子后进一步脱去1分子水和1分子甲氧基产生的碎片。

(3)紫堇灵在大鼠尿液中代谢途径分析:在保留时间5.5 min处,检测到了代谢产物U1。其分子离子峰为370.126 3,化学组成为C20H16NO6,比紫堇灵增加2,恰好是27位甲基被羟基取代后的分子质量。其二级质谱产生的碎片离子/352为该代谢产物脱去1分子水所产生的碎片,/303为该代谢产物进一步在7位碳原子脱1分子甲氧基后再失1分子水所产生的碎片,/291为该代谢产物进一步脱去1分子甲基所产生的碎片,/190为该代谢产物在/303的基础上4、12、14和15位C-C键断裂所产生的碎片。见图9。
在保留时间7.3 min处,检测到了代谢产物U2。其分子离子峰为426.153 2,化学组成为C23H23NO7,比紫堇灵增加58,恰好是16位C被1分子乙酸取代后的分子质量。其二级质谱产生的碎片离子/408为该代谢产物脱去1分子水所产生的碎片,/366为该代谢产物进一步脱1分子甲基和1分子-CO2所产生的碎片,/348、317为该代谢产物在/366的基础上进一步脱去1分子水和2分子甲基所产生的碎片。
在保留时间7.7 min处,检测到了代谢产物U3。其分子离子峰为544.178 5,化学组成为C28H33NO10,比紫堇灵增加176,恰好是加上1分子甲基和1分子葡萄糖的相对分子质量。其二级质谱产生的碎片离子/368为紫堇灵原型,/350、319、289、177和135皆为该代谢产物脱去1分子甲基和1分子葡萄糖后,紫堇灵的特征裂解碎片。
在保留时间18.6 min处,检测到了代谢产物U4。其分子离子峰为382.129 0,化学组成为C21H19NO6,比乙酰紫堇灵减少28,恰好是脱去2分子甲基后加上2个氢原子的分子质量。其二级质谱产生的碎片离子/333为母核C-O键断裂并失去4个氢原子所产生的碎片,/303为该代谢产物进一步脱去1分子甲氧基所产生的碎片。
(4)紫堇灵在大鼠粪便中代谢途径分析:在保留时间11.2 min处,检测到了代谢产物F1。其分子离子峰为408.311 3,化学组成为C24H25NO5,比紫堇灵增加40,恰好是10位C被1分子丙基取代后的分子质量。其二级质谱产生的碎片离子/368为紫堇灵原型,/355为紫堇灵脱1分子甲基后加上1分子氢被还原产生的碎片,/337、319为该代谢产物进一步脱水所产生的碎片。见图10。
在保留时间13.8 min处,检测到了代谢产物F2。其分子离子峰为563.261 6,化学组成为C27H33NO12,比紫堇灵增加195,恰好是8、13位C-O键断裂分别加上2个氢原子、26位上的碳原子被羟基取代后加上1分子葡萄糖醛酸的相对分子质量。其二级质谱产生的碎片离子/504为该代谢产物进一步脱去1分子甲氧基、1分子羟基和1分子甲基所产生的碎片,/489为其继续脱1分子甲基所产生的碎片。
在保留时间18.5 min处,检测到了代谢产物F3。其分子离子峰为477.269 6,化学组成为C23H27NO10,比紫堇灵增加109,恰好是25、27位分别失去1分子甲基、26位上的羟基上的氢被1分子葡萄糖醛酸取代产生的碎片。其二级质谱产生的碎片离子/459为该代谢产物脱去1分子水所产生的碎片。
在保留时间21.9 min处,检测到了代谢产物F4。其分子离子峰为343.194 7,化学组成为C18H19NO4S,比紫堇灵减少25,恰好是1、2、11、21位C-O键断裂,27位上的碳原子脱去1分子甲基后20位碳原子所连羟基被硫化后的分子质量。其二级质谱产生的碎片离子/165为该代谢产物17位氮原子发生C-N键断裂14位碳原子C-C键断裂所产生的碎片。
4 讨论
中药化学成分和体内代谢产物的分析和鉴定,是研究中药药效物质的基础,对明确中药化学成分发挥药效具有重要意义,是中药活性成分开发利用的重要环节。李木子等[9]采用UHPLC-ESI-MS/MS技术,对苦地丁70%乙醇提取物进行定性定量分析,对其14种生物碱进行鉴定。Dong等[17]建立了一种UHPLC-MS/MS方法,测定口服苦地丁提取物后比格犬血浆中生物碱成分的药代动力学。Yang等[18]采取UHPLC-ESI-MS/MS法,研究了大鼠口服苦地丁提取物后,紫堇灵和乙酰紫堇灵的药动学。本研究建立了一种快速有效的苦地丁化学成分体内代谢产物及其代谢途径的分析方法,为苦地丁的药效物质基础明确鉴定了基础。
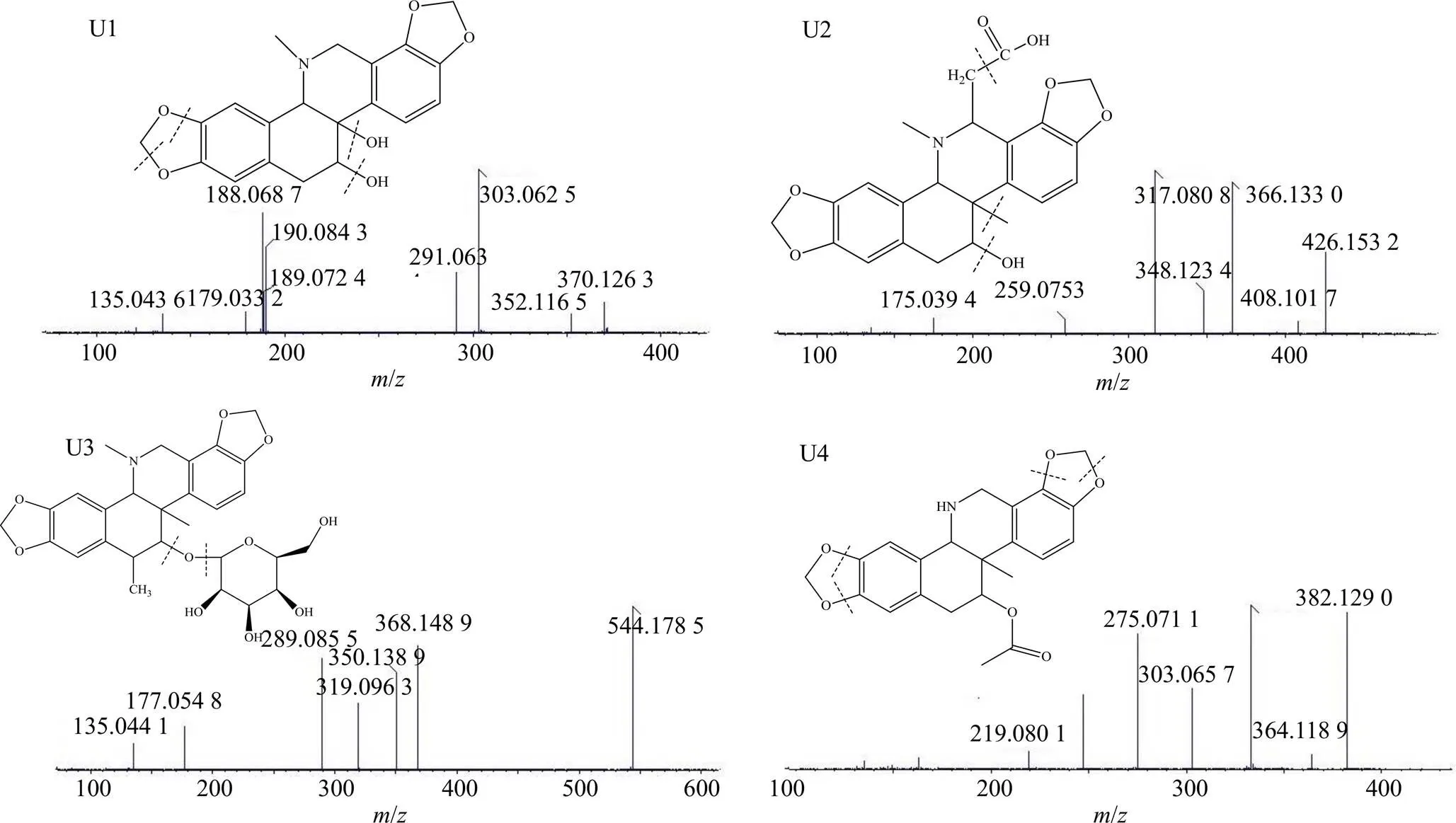
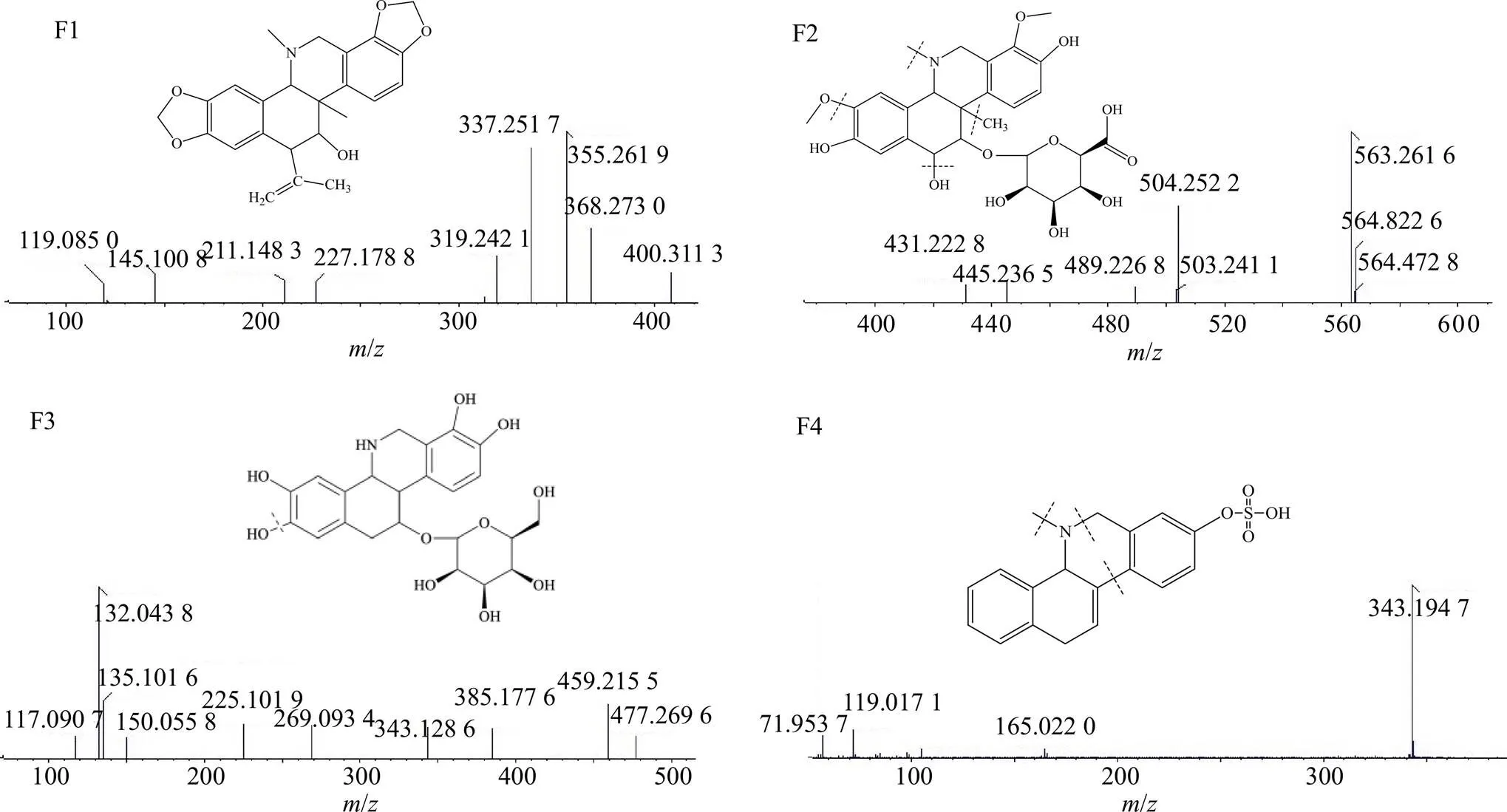
图10 大鼠粪便中紫堇灵代谢产物二级质谱图及其代谢途径
Fig. 10 Secondary mass spectrometry of metabolites of corynoline in rat feces and their metabolic pathways
本实验运用HPLC-Q-TOF/MS技术,通过对照品保留时间及质谱信息的比对,详细解析了大鼠口服苦地丁提取物后在不同时间段内的血浆、胆汁、尿液和粪便的原型成分和代谢产物变化,建立了苦地丁“体外化学成分群-大鼠体内化学成分群”的研究框架,进一步了解到苦地丁的体内物质代谢动态变化。在苦地丁提取物中,鉴定了31种化学物质(生物碱类化合物30个,黄酮类化合物1个),同时鉴定了不同时间段内的苦地丁提取物在血液、胆汁、尿液、粪便的原型成分。结果表明,原阿片碱、紫堇灵、乙酰紫堇灵、13,14-二氢血根碱等化合物在0~2 h内已经入血,并在12 h后仍可在血浆中检测到,这与苦地丁药理活性研究结果相匹配。但是在大鼠0~12 h粪便中,仅发现了衡州乌药碱、12-羟基紫堇灵、原阿片碱、13-表紫堇灵、紫堇灵这5个化合物,由此说明,苦地丁提取物主要经胆汁代谢,尿液排泄。此项研究进一步明确了苦地丁的体内药效物质基础,揭示其体内化学成分群的组成。
本研究中的21个入血成分大部分属于苯菲啶型生物碱,故而选取紫堇灵为代表,进一步阐明苯菲啶型生物碱在血浆、胆汁,尿液和粪便中的代谢产物及其代谢途径。从中分别鉴定出3、3、4、4种代谢产物,其代谢反应涉及了Ⅰ相代谢(氧化、还原、开环)和Ⅱ相代谢(甲基化、脱羟基、脱羧、葡萄糖醛酸化、硫酸酯化),其中以Ⅱ相代谢反应为主,这与文献报道基本一致[19]。这一发现为进一步明确苦地丁中苯菲啶型生物碱的代谢途径提供实验依据,为进一步解释紫堇灵的药理和活性机理研究提供了实验依据,也为阐明苦地丁药效物质基础及活性研究提供了实验依据,为苦地丁的进一步开发和临床合理应用奠定了理论基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 210.
[2] Zhai X T, Chen J Q, Jiang C H,.Turcz. attenuates LPS-induced inflammatory responses via the suppression of NF-κB signaling pathwayand[J]., 2016, 194: 153-161.
[3] 肖扬, 杨春娟, 钟明亮, 等. 苦地丁化学成分研究(英文) [J]. 天然产物研究与开发, 2013, 25(12): 1665-1668.
[4] Wang X, Dong H J, Shu X K,. Large-scale separation of alkaloids fromTurcz. by pH-zone-refining counter-current chromatography [J]., 2012, 17(12): 14968-14974.
[5] 杨悦, 刘颖, 刘晓谦, 等. 基于超高效液相色谱串联质谱技术的山楂核抗菌、抗氧化药效物质基础研究[J]. 世界中医药, 2021, 16(17): 2527-2532.
[6] 郑建芳, 秦民坚, 郑昱, 等. 苦地丁生物碱的化学成分 [J]. 中国药科大学学报, 2007, 38(2): 112-114.
[7] Tian M, Yang C J, Yang J,. Ultrahigh performance liquid chromatography–electrospray ionization tandem mass spectrometry method for qualitative and quantitative analyses of constituents ofTurcz extract [J]., 2019, 24(19): 3463.
[8] Niu L L, Xie Z S, Cai T X,. Preparative isolation of alkaloids fromTurcz. by high-speed counter-current chromatography using stepwise elution [J]., 2011, 34(9): 987-994.
[9] 李木子, 张浩, 朱粉霞. 苦地丁的化学成分研究 [J]. 华西药学杂志, 2019, 34(3): 120-126.
[10] Gathungu R M, Oldham J T, Bird S S,. Application of an integrated LC-UV-MS-NMR platform to the identification of secondary metabolites from cell cultures: Benzophenanthridine alkaloids from elicited(California poppy) cell cultures [J]., 2012, 4(5): 1315-1325.
[11] Chen Y Z, Liu G Z, Shen Y,. Analysis of alkaloids in(Willd.) R. Br. using high-performance liquid chromatography with diode array detection and electrospray ionization mass spectrometry [J]., 2009, 1216(11): 2104-2110.
[12] Hu Y M, Wang Y T, Sze S C W,. Identification of the major chemical constituents and their metabolites in rat plasma and various organs after oral administration of effective Erxian Decoction (EXD) fraction by liquid chromatography-mass spectrometry [J]., 2010, 24(5): 479-489.
[13] Zhu S L, Dou S S, Liu X R,. Qualitative and Quantitative Analysis of Alkaloids in Cortex Phellodendri by HPLC-ESI-MS/MS and HPLC-DAD [J]., 2011, 27(1): 38-44.
[14] Liu Q X, Zhou B B, Wang X L,. Establishment of a search library about benzylisoquinoline alkaloids based on selective separation on the binaphthyl column and standard analysis on C18column [J]., 2012, 35(23): 3317-3325.
[15] Hu Y M, Su G H, Sze S C W,. Quality assessment of Cortex Phellodendri by high-performance liquid chromatography coupled with electrospray ionization mass spectrometry [J]., 2010, 24(4): 438-453.
[16] 李木子, 张浩, 崔国倩, 等. 苦地丁的抗炎药效物质基础组分及作用机制研究 [J]. 中国中药杂志, 2020, 45(11): 2586-2594.
[17] Dong H R, Yan G Y, Wang Z B,. Liquid chromatography-tandem mass spectrometry simultaneous determination and pharmacokinetic study of fourteen alkaloid components in dog plasma after oral administration ofTurcz extract [J]., 2018, 23(8): 1927.
[18] Yang C J, Xiao Y, Wang Z B,. UHPLC-ESI-MS/MS determination and pharmacokinetic study of two alkaloid components in rat plasma after oral administration of the extract ofTurcz [J]., 2014, 960: 59-66.
[19] Liu Z H, Chang S, Guan X Y,. The metabolites of ambinine, a benzo[c]phenanthridine alkaloid, in rats identified by ultra-performance liquid chromatography- quadrupoletime-of-flight mass spectrometry (UPLC/Q- TOF-MS/MS) [J]., 2016, 1033-1034: 226-233.
LC-MS identification of chemical constituents and metabolites of
XIANG Yan1, 2, LI Mu-zi1, 2, XIANG Yan1, 2, LI Mu-zi1, 2, XIE Ya-ping1, 2, QU Xiao-yang1, 2, Tan Xiao-bin1, 2, CUI Guo-qian1, 2, ZHU Fen-xia1, 2
1. The Affiliated Hospital of Integrated Traditional Chinese and Western Medicine, Nanjing University of Traditional Chinese Medicine, Nanjing 210028, China 2. Key Laboratory of Oral Drug Delivery System of Traditional Chinese Medicine, Jiangsu Academy of Traditional Chinese Medicine, State Administration of Traditional Chinese Medicine, Nanjing 210028, China
To investigate the chemical components and metabolites in the extract of, and to explore the mass spectrometry cleavage law of its representative components.High-performance liquid chromatography- electrospray ionization mass spectrometry (HPLC-Q-TOF/MS) was used to adopt the positive ion mode scanning the extract and rat substance in different period. The plasma, bile, urine and faeces were separately detected and compared, with the standard and pieces of literature than retention time and mass spectrum information, the attribution of chemical constituents and their cracking mode. The dynamic change of metabolites was detected.A total of 31 compounds were identified in the extract, among which 21 compounds entered the body as the prototype. Besides, 3, 3, 4, and 4 metabolites were found in plasma, bile, urine and faeces of rats.HPLC-Q-TOF/MS was used to identify the chemical constituentsand, and the metabolites and metabolic rules of corydalis were elucidated. It was speculated that the metabolism of Corydalisoccurred in phase I and phase II, and phase II was the main mode (sulfation, glycosylation, methylation, and demethylation). This study provides a basis for elucidating the pharmacodynamic material basis of.
Turcz.; HPLC-Q-TOF/MS; metabolites; corydalis; protopine
R284.1
A
0253 - 2670(2022)07 - 1949 - 15
10.7501/j.issn.0253-2670.2022.07.004
2021-09-23
国家自然科学基金项目(81473430);江苏省医学创新团队项目(CXTDB2017003)
项 艳,女,汉族,江苏淮安人,硕士研究生,研究方向为中药药效物质基础。E-mail: yanxiang202010@126.com
朱粉霞,女,汉族,陕西人,博士,研究员,主要从事中药药效物质基础研究。E-mail: zfxcjq@126.com
[责任编辑 王文倩]
