CRISPR/Cas技术在抗除草剂作物育种中的研究与应用进展
2022-03-30费云燕杨军景德道林添资李闯钱华飞曾生元韩华新龚红兵
费云燕,杨军,景德道,林添资,李闯,钱华飞,曾生元,韩华新,龚红兵
江苏丘陵地区镇江农业科学研究所,江苏 句容212400
联合国在《2019 世界人口展望》的报告中指出,2050 年全球人口将增长至97 亿,粮食短缺将成为威胁人类生存最严重的问题之一[1]。在自然界中,影响粮食产量的因素主要有生物胁迫和非生物胁迫,其中生物胁迫主要包括病害、虫害和草害等,而杂草危害被认为是影响全球作物产量、品质以及粮食安全最主要的因素之一[2]。
杂草具有繁殖和传播方式多样、结实量大、生活周期短、生长迅速、光合作用效率高、适应性广、再生能力和抗逆性均较强等生物学特性[3],因而可与作物竞争生存空间、水分、养料和阳光等,进而影响作物的产量和品质;同时,杂草常作为病虫害的中间宿主,可引发作物发生病虫害。此外,杂草会降低土壤“源”的输入,导致肥沃土地流失,增加耕作成本[4]。据统计,我国每年杂草发生面积高达9 700 万hm2,约为作物种植面积的80%,每年造成的经济损失高达900亿美元[5-6]。
杂草防治一直是作物生产中的关键环节,人工除草是传统的杂草防治方法,随着科学技术的发展与更新,已研制出了机械、物理、生物、化学等除草方法。截至目前,化学除草剂除草是最省时、省力、高效且经济的方式,已成为现代农业体系中保证作物丰产的重要举措[7]。目前,全球除草剂种类繁多,均可通过干扰杂草正常的生理生化过程,如破坏脂肪酸、氨基酸和ATP 的合成,抑制光合作用,阻碍呼吸作用等,使杂草生长受到抑制并最终死亡,从而实现除草的目的[8]。然而,化学除草剂在除草过程中,会伤害农作物,施用不当会导致作物减产甚至绝产,造成巨大的经济损失。同时,由化学除草剂带来的环境污染问题也是农业生产中亟需解决的问题。因此,培育抗除草剂作物是解决以上问题最有效的手段,也是育种工作的重要方向。
本文在概述抗除草剂作物育种方法的基础上,详细综述了CRISPR/Cas 系统的结构、作用机理、育种应用存在的问题和发展方向,旨在为今后利用CRISPR/Cas 技术进行抗除草剂作物育种提供理论依据。
1 抗除草剂作物育种方法
获得抗除草剂作物的途径主要包括种质资源的收集与鉴定、诱变育种、转基因育种、基因编辑育种等。种质资源的收集与鉴定主要是对作物及其野生材料、近源种等进行收集,经过除草剂抗性筛选后获得自然抗性材料,并通过传统育种手段将抗性基因导入栽培作物中,但该方法存在材料收集困难、工作量大、野生材料或近源种与栽培品种存在生殖隔离等问题[9]。诱变育种是传统育种中获得抗除草剂作物最有效的方法之一,国际上商业化的抗除草剂Clearfield、Provisia 系列水稻品种均为人工诱变材料[10],但该方法存在目标突变率低、诱变种质其他性状较劣质、筛选和纯化耗时耗力等缺点。转基因育种是将外源抗性基因、靶标基因(超表达)导入作物中以获得抗除草剂作物的方法,孟山都公司与拜耳公司分别推出的Roundup Ready 和Liberty Link 系列作物均是转基因材料[11]。应用转基因技术培育的农作物中,抗除草剂类作物在市场上的占比最高(图1),但公众对转基因技术安全性的忧虑及排斥已成为制约其发展最主要的因素。
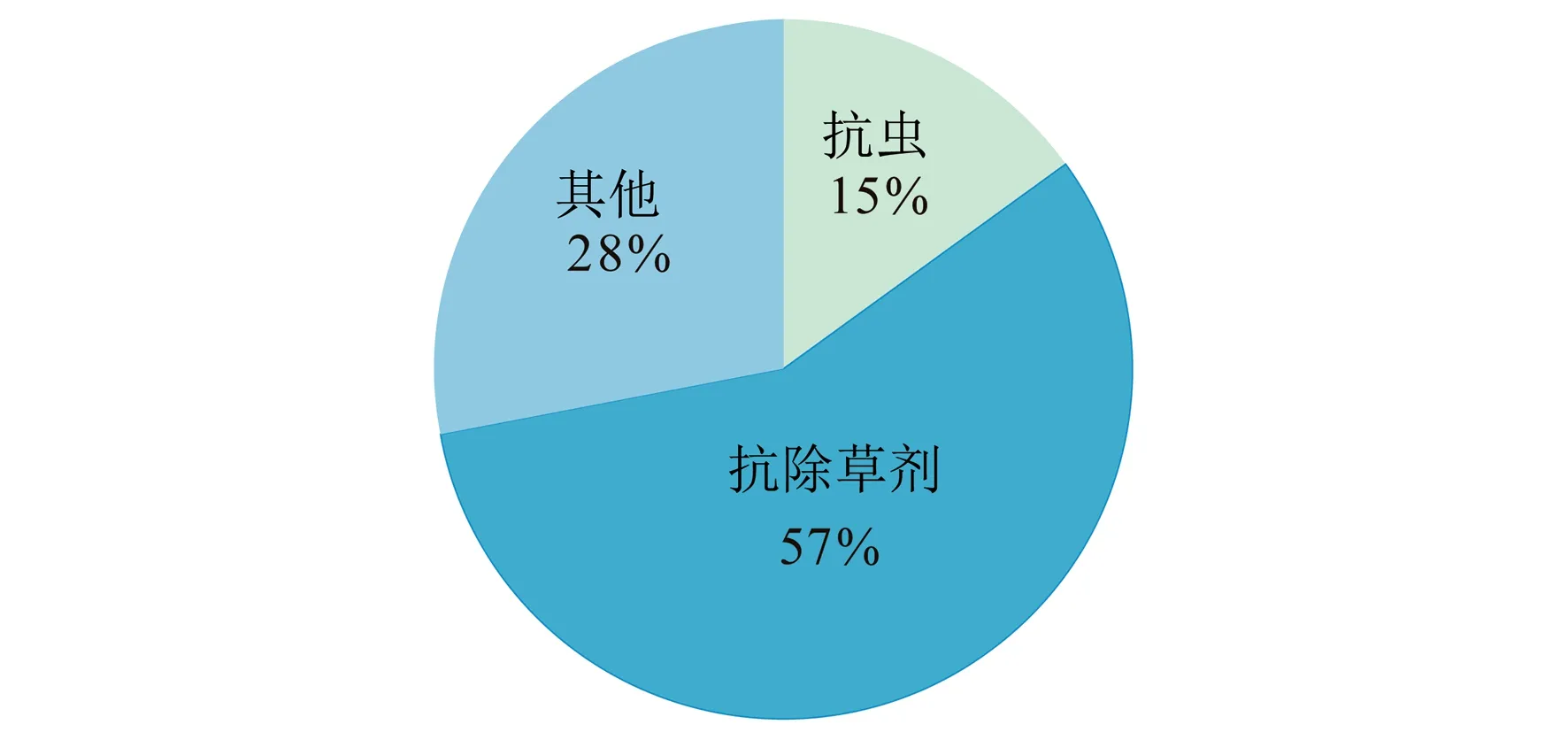
图1 不同转基因性状占转基因作物种植面积百分比[12]Fig.1 Percentage of different transgenic traits in the planting area of transgenic crops[12]
基因编辑技术是利用序列特异核酸酶(sequence-specific nucleases,SSNs)对生物体内特定位点进行靶向修饰的技术,主要包括锌指核酸酶(Zinc finger nuclease,ZFN)技术、类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,TALEN)技术、成簇规律间隔短回文重复序列与相关蛋白(clustered regularly interspaced short palindromic repeats/CRISPR-associated protein,CRISPR/Cas)技术(图2)。ZFN 是利用锌指核酸酶的DNA 结合域与Ⅱ型核酸内切酶FokⅠ的切割结合域整合而成,TALEN 的构成与ZFN 相似,是由TALE蛋白(DNA 结合域)与FokⅠ融合而成,这两类技术均是利用FokⅠ的酶切特性,使特定位点的DNA 双链断裂(double DNA stranded breaks,DSB),从而诱导细胞的非同源末端连接(non-homologous end joining,NHEJ)修复或者同源重组(homologous recombination,HR)修复。由于FokⅠ需要在二聚化状态下才具有内切酶活性,因此,ZFN 和TALEN 均需要在靶位点两侧各设计1个DNA 结合蛋白,表达载体组装较为繁琐。此外,锌指核酸酶的DNA 结合特异性不高,使得ZFN 技术表现出较为明显的脱靶效应。虽然TALEN 具有位点结合特异性高、脱靶效应低的优点,但TALEN 蛋白组装工作量较大,并且编辑效率较低[13-15]。
经典的CRISPR/Cas 技术是由人工设计的单链引导RNA(single guide RNA,sgRNA)与Cas9 核酸酶组成。sgRNA 特异性引导Cas9 核酸酶对靶位点进行切割,造成DNA 双链断裂,诱发DNA 的修复机制(图2)[15]。该技术无需设计和构建DNA识别蛋白,仅需设计sgRNA 即可构建CRISPR/Cas表达单元,随后通过遗传转化手段直接实现作物目标基因的突变,获得定点突变材料[16]。CRISPR/Cas 技术与其他技术相比,其操作更简单、效率更高、稳定性和通用性更强、成本更低;同时,载体元件(抗生素标记序列、Cas 序列等)可通过自交、杂交等手段进行剔除,最终获得目的基因精准编辑的非转基因植株,该材料与自然突变或人工诱变材料具有实质等同性[14,17]。CRISPR/Cas系统根据Cas蛋白的不同可分为2个大类(1类和2类)5 个型(Ⅰ~Ⅴ型)。在干扰靶基因时,1 类CRISPR/Cas(包含Ⅰ、Ⅲ、Ⅳ型)需要多个Cas 蛋白构成的多效应复合物协同完成;2类CRISPR/Cas(包含Ⅱ、Ⅴ型)则仅需1 个Cas 蛋白即可发挥其核酸内切酶功能,结构较简单,在植物中应用最广泛的CRISPR/Cas9 和CRISPR/Cpf1 均为2 类系统[18-19]。2015 年,第1 个利用基因编辑技术培育的抗除草剂油菜已被美国监管部门认定为非转基因作物,并在该国进行推广种植[20]。2023 年CRISPR/Cas技术的市场价值预计将达到145.5 亿美元[14]。CRISPR/Cas 已成为分子生物学领域最重要的技术之一[9]。
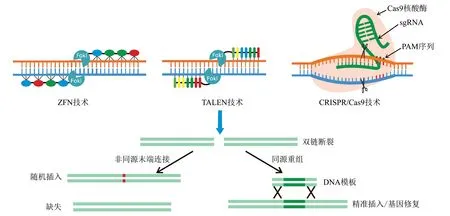
图2 不同基因编辑系统构成及其介导的非同源末端连接与同源重组修复[15]Fig.2 Composition of different gene editing systems and their mediated non-homologous end connection and homologous recombination repair[15]
2 CRISPR/Cas 技术在抗除草剂作物育种中的应用
自2012 年CRISPR/Cas 系统被发现具有基因编辑潜力以来,CRISPR/Cas 技术已成为全球研究的热点领域。经典的CRISPR/Cas 系统是基于靶位点的双链断裂,2016 年出现了无需引入双链断裂的碱基编辑(base editing)技术,该技术能够实现单碱基替换[21]。2019 年引导编辑技术(prime editing)的出现开创了基因精准编辑的新局面,该技术可以实现任意类型的碱基转换、44 bp以内的片段插入、80 bp以内的片段缺失以及复杂的混合突变等[22]。
2.1 基于双链断裂的CRISPR/Cas技术及其应用
目前广泛使用的CRISPR/Cas9 和CRISPR/Cpf1 系统均是基于双链断裂引起的DNA 修复机制,主要为NHEJ 与HDR。NHEJ 是一种快捷、高效但精准度不高的修复方式,往往会造成切割位点处序列的插入和(或)缺失,引起基因的突变,最终导致靶标基因功能的丧失;HDR 是当双链断裂处存在同源片段作为模板时,发生的一种较为精准的修复方式。由于NHEJ 可发生于几乎所有的细胞中,因而其在生物体修复时发生频率极高,占绝对主导地位;而HDR 仅在特定的细胞周期发生,其发生频率极低。因此,CRISPR/Cas 系统产生的主要突变方式是NHEJ 的随机插入/缺失突变[23-24]。
利用CRISPR/Cas9 和CRISPR/Cpf1 技术已在多种作物上实现了抗除草剂种质资源的创制。Guo 等[25]敲除了水稻中与生长素信号传导相关的AFB4(Auxin Signaling F-Box Protein 4)基因,获得了具有毒莠定(一种内吸型除草剂)抗性的植株。乙酰乳酸合成酶(acetolactate synthase,ALS)是磺酰脲类、咪唑啉酮类、嘧啶羟苯甲酸类等50 多种商业除草剂的靶标酶,也是目前抗除草剂植物育种的主要靶位点[26]。Wang 等[27]利 用CRISPR/Cas9系统,通过HR途径实现了ALS的第628位甘氨酸(glycine,G)突变为苏氨酸(threonine,T),即G628W,获得的突变株具有咪草烟抗性。Butt等[28]利用CRISPR/Cas9 体系,在水稻SF3B1(spliceosomal protein)基因的CDS区设计了119个sgRNAs,进行愈伤组织的转化后施加Herboxidiene(一种具有除草活性的植物毒性聚酮类化合物),获得一些点突变抗性株,其可有效减弱药物对其靶标SF3B1的结合。
为提高HR 效率,研究者在转化CRISPR/Cas的同时引入1 条用于与断裂处序列进行同源重组的供体DNA 片段。利用此方法已在水稻、烟草、西红柿、玉米以及大豆中实现ALS基因的定点突变,并获得相应的抗除草剂植株[29-32]。已有研究采用类似方法对5-烯醇式丙酮酰莽草酸-3-磷酸合 酶(5-enolpyruvylshikimate-3-phosphate synthase,EPSPS)进行定点突变,获得具有草甘膦抗性的突变作物[33-35]。Svitashev 等[36]使用基因枪法将体外预先组装好的Cas9/sgRNA 核酸蛋白复合体以及同源供体片段进行转化,可获得无外源基因元件的抗除草剂玉米新种质。为提高HR 概率,Endo 等[37]利用两步转化法进行基因编辑。首先采用CRISPR/Cas9 技术敲除水稻中NHEJ 修复所必需的蛋白DNA Ligase 4(Lig4),随后引入含ALS突变位点的同源序列,对首次敲除后筛选得到的lig4突变细胞进行2次打靶,获得了ALS基因W548L和S627I的突变体。
2.2 碱基编辑技术及其应用
碱基编辑技术是CRISPR/Cas 系统的衍生体系,能够在无需形成DSB、无需提供同源模板以及不依赖宿主的NHEJ和HDR途径就能够实现特定位点的精确碱基替换[4]。该技术分为腺嘌呤碱基编辑器(adenine base editor,ABE)和胞嘧啶碱基编辑器(cytosine base editor,CBE)2 种,主要由sgRNA、失去核酸内切酶活性但保留DNA 结合能力的Cas9 突变体(即dCas9)及与dCas9 融合的腺苷脱氨酶或胞苷脱氨酶组成(图3)。碱基编辑系统中的sgRNA 能够引导dCas9 结合到靶位点,使得非互补链(即非靶标链)暴露为单链结构,脱氨酶在该区域中使腺嘌呤(A)、胞嘧啶(C)脱氨基分别变成肌苷(I)、尿嘧啶(U),在DNA 修复过程中,I 被当做鸟嘌呤(G),U 变为胸腺嘧啶(T),从而形成A 到G 或C 到T 的碱基替换[38]。碱基编辑技术能够高效、精准地实现定点突变,在抗除草剂作物育种上的应用潜力巨大,目前已通过该技术获得大量的抗性植株。
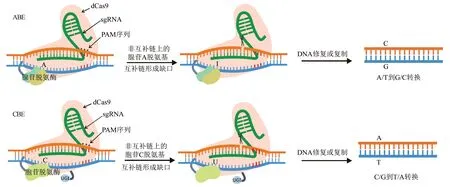
图3 单碱基编辑系统构成与作用机理Fig.3 The components and the action mechanisms of base editing system
Kuang 等[26]在水稻ALS基因的完整开放阅读框(open reading frame,ORF)内共设计了63 个sgRNA,最终获得P171F、R190H、P171F、P171F、R172C、P171L、P171S 等一系列突变材料,并指出P171F 对双草醚具有极高的抗性,是一种新的抗性位点;Shimatani 等[39-40]和Endo 等[41]利用CBE 技术对ALS已知的抗性位点进行打靶,获得了具有咪草烟除草剂抗性的水稻突变种质;此外,在油菜、小麦、玉米、大豆、西瓜等作物中,通过碱基编辑技术得到了以ALS 为靶标的除草剂抗性株系[24,42-49];乙酰辅酶A 羧化酶(acetyl-CoA carboxylase,ACCase)与脂肪酸的合成相关,是芳氧苯氧丙酸类、环己二酮类以及苯基吡唑啉类除草剂的靶位点。Liu 等[50]利用覆盖ACCaseORF 区的141 个sgRNAs对水稻进行编辑,获得一系列盖草能抗性材料,并认为I1879V 是培育耐盖草能水稻的最佳突变。Li 等[51]对水稻中的ACCase进行定点突变,将ACCase 编码区的第2 186 位C 突变为R,获得了抗芳氧基苯氧丙酸酯和环己二酮类除草剂的水稻突变体。Zhang 等[48]利用碱基编辑技术将玉米ACCase 进行定点修饰,并发现ACCase突变株(A1992V)具有除草剂抗性;EPSPS 是草甘膦除草剂的靶位点,Endo 等[41]对EPSPS 进行定向修饰(T102I),获得了抗草甘膦的水稻。TubA2为植物微管蛋白合成相关基因,是二硝基苯胺类除草剂的靶位点,Liu等[52]利用ABE技术使TubA2发生了M268T 的替换,获得的水稻同时具有氟乐灵和二甲戊灵抗性。
2.3 引导编辑技术及其应用
引导编辑技术由向导RNA(prime editing guide RNA,pegRNA)、Cas9 核酸切口酶(nCas9)和逆转录酶组成。pegRNA 是一种经过修饰的sgRNA,在其3'端引入一段引物结合位点(primer binding site,PBS)和人工设计的逆转录模板序列(包含编辑位点)。pegRNA 既能够引导nCas9 结合到靶位点,也可以作为逆转录模板。引导编辑系统中的nCas9 在靶位点切割DNA 序列后,形成1 个单链DNA 缺口,单链DNA 缺口与PBS 序列互补配对形成双链DNA,在逆转录酶的作用下合成含有突变的序列(图4)[53]。引导编辑技术能够实现任意形式的点突变、插入、缺失及复杂的混合突变,克服了碱基编辑技术仅能够进行A 到G、C 到T 转换的缺陷[22]。引导编辑技术在植物中的使用尚处于起步阶段,用于抗除草剂作物的创制还需要更深入的研究。
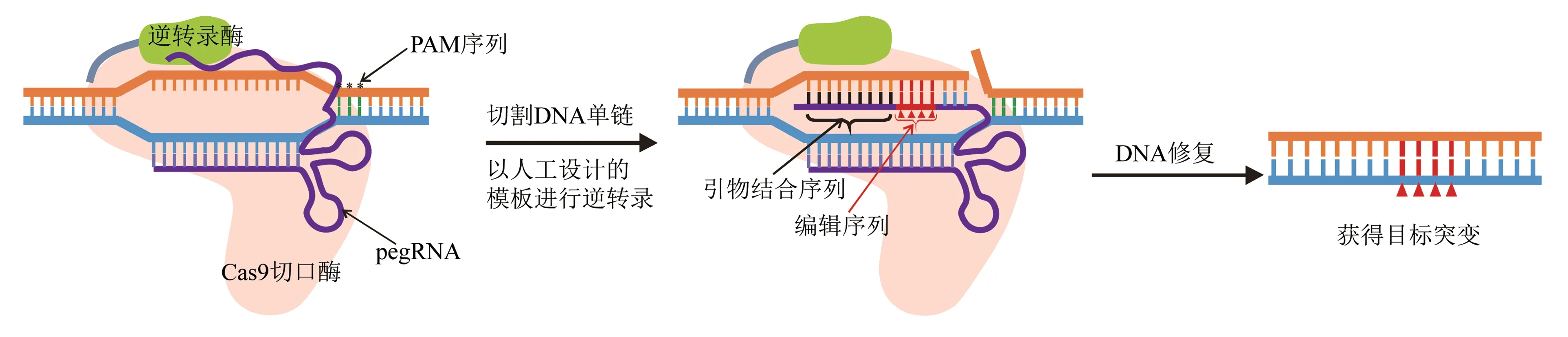
图4 引导编辑系统构成与作用机理Fig.4 The components and action mechanism of prime editing system
研究发现,利用引导编辑技术对水稻EPSPS基因进行编辑,能够实现6种不同碱基的替换,包括C 到T、G 到C、T 到G、A 到C、T 到C、A 到G[54]。Li 等[55]完成了水稻EPSPST169I、A170V、P173S的突变,创制了对草甘膦具有高抗性的水稻。Xu等[56]利用引导编辑技术在水稻ACCase上实现了D2176G 的突变。目前,ALS在水稻、玉米、西红柿上均获得了各种类型的抗性突变[54,56-60]。引导编辑技术为抗除草剂作物育种提供了更为便利的手段。
目前,各种作物应用CRISPR/Cas 系统不同编辑工具进行抗除草剂育种的相关研究汇总于表1,说明CRISPR/Cas 系统在作物抗除草剂育种中应用广泛。
3 CRISPR/Cas 技术在抗除草剂植物育种中存在的主要问题
3.1 同源重组效率低
由于植物除草剂的靶位点多数为新陈代谢中的关键基因,其功能缺失可能直接导致作物死亡。目前,基因编辑技术已在多种作物的除草剂抗性育种中成功应用。如表1 所示,除草剂抗性多数是由一个或多个单核苷酸多态性(single nucleotide polymorphism,SNP)造成的,而通过CRISPR/Cas 技术获得单碱基突变的效率通常较低。虽然引入同源供体DNA 可在一定程度上提高同源重组的概率,但供体DNA 导入植物细胞的效率较低[17]。碱基编辑和引导编辑受PAM 识别位点的限制,并不能够覆盖所有感兴趣的位点,因此,利用这两种技术不能确保作物除草剂抗性的产生。在这种情况下,基于CRISPR/Cas 技术的同源重组是解决该问题的重要手段。由于引入包含除草剂抗性SNP 的DNA 片段效率较低,在一定程度上限制了CRISPR/Cas 技术在抗除草剂作物育种中的应用。

表1 CRISPR/Cas系统在抗除草剂作物育种中的应用Table 1 Application of CRISPR/Cas system in herbicide-resistant crops breeding
3.2 脱靶现象
CRISPR/Cas 技术存在脱靶问题,研究表明,sgRNA 有5 个碱基的错配时,CRISPR/Cas 系统仍能切割DNA[61],因而该技术可能会对非靶位点进行编辑,造成未知基因的突变,产生非预期的表型。目前脱靶位点主要通过软件进行预测,但有些脱靶位点可能无法准确评估。
3.3 抗性杂草的产生
现代农业生产中,种植抗除草剂作物将会使某种除草剂被长期单一的使用,最终导致抗性杂草的出现,使杂草防除措施失效。目前CRISPR/Cas 技术针对的抗除草剂基因主要为ALS(表1),这可能与ALS基因突变类型较多,研究较为深入有关。但ALS抑制类除草剂是发生抗性最为严重的一类除草剂,据统计,大约有167 种杂草产生了抗性(http://weedscience.org/summary/SOASummary.aspx)。
4 利用CRISPR/Cas技术创制抗除草剂作物的发展方向
抗性杂草的产生是当前化学防治杂草面临的最严重问题,利用抗性杂草少的除草剂、避免长期单一地使用作用机制相同的除草剂是解决该问题的有效途径。因此,利用CRISPR/Cas 技术寻找新的抗性靶点、培育复合抗性品种是预防和解决该问题的重要方法。
4.1 除草剂新靶标育种
目前已利用的靶标主要包括ALS、ACCase以及EPSPS,通过对这些靶标进行修饰而创制的抗除草剂作物,会随着抗性杂草的增多而导致其应用价值降低。对于一些无抗性或较少有抗性杂草的除草剂,根据其靶标而定向创制的抗性作物应用前景广泛。目前仍有一些除草剂的靶标待利用,如已在模式植物拟南芥中证实的CESA3,该基因与纤维素的合成相关。CESA3的突变能够产生C17(一种纤维素合成抑制类化合物)抗性,可以作为抗除草剂作物育种的新靶点[62];同时,原卟啉原氧化酶(protoporphyrinogen oxidase,PPO)、α-微管蛋白(α-tubulin)发生变异时,会分别产生氟丙嘧草酯和二硝基苯胺的抗性[63];磷酸核糖基苯胺异构酶(phosphoribosylaniline isomerase,PAI)和5-氧脯氨酸酶(5-oxoprolinase,OXP)的缺失突变会使植物分别产生6-邻氨基苯甲酸甲酯和磺胺甲噁唑抗性[1];羟基苯丙酮酸双加氧酶(hydroxyphenyl pyruvate dioxygenase,HPPD)抑制类除草剂的抗性杂草较少,是由于HPPD基因的抗性进化缓慢。因而,采用基因编辑技术创制的抗HPPD 抑制剂作物,将具有巨大的商业应用潜力[64]。
4.2 除草剂复合抗性育种
国际抗除草剂杂草数据库统计,多数抗性杂草是对单一类型的除草剂有抗性,对多种类型除草剂有抗性的杂草(如部分稗属、苋属和假蓬属植物)相对较少。CRISPR/Cas 技术可以实现多个靶标基因的定向修饰,利用该技术开发出对多种除草剂具有抗性的作物品种,能够实现不同除草剂的轮换使用,因而既可以有效防治具有单一除草剂抗性的杂草,同时,也能延缓或抵御杂草抗性的产生。因而合理利用CRISPR/Cas 技术可有效防控杂草。
5 展望
CRISPR/Cas 作为生命科学领域一项新兴技术,能够快速、简单、高效、精确地实现作物的定向改造,创制各种无外源片段的抗除草剂新种质,为杂草防治提供更多的可能。由于该技术的特殊性,各国政府对其监管态度不同。目前,我国各官方机构对基因编辑作物仍采取保守态度,尚无明确的监管标准[65]。尽管基因编辑作物的监管问题可能会长期存在争议,但我国仍需要形成CRISPR/Cas 技术的自主知识产权,争取在该领域具有主动权和话语权。随着CRISPR/Cas 技术的完善,未来该技术可能会逐渐被人们所接受。
