高通量测序检测米线中的食源性致病菌
2022-03-30刘露露吴永民代诗琼曹建新
吴 怡,刘露露,吴永民,代诗琼,商 颖,曹建新,韩 鹏
(昆明理工大学食品科学与工程学院,云南 昆明 650500)
米线是中国西南部最具代表性的特色小吃,广受消费者的喜爱,但是其较高的水分活度,为微生物的生长繁殖提供了良好环境。若消费者误食含食源性致病菌的米线食品,就可能引起身体不适等不良反应。近年来,从米线制品中检出食源性致病菌的报道时有出现,如食用含蜡样芽孢杆菌的米粉引起腹泻腹痛[1]。某地疾控中心从米粉米线中检出4 种食源性致病菌[2]。在米线及配料食品中发现变形杆菌污染[3]。因此控制米线中的微生物污染不可忽视,在以往的研究中,用于筛选鉴别米面制品中的食源性致病菌方法包括传统的平板筛选法、生理生化实验鉴定和高通量测序技术等。徐梅琼等[4]利用传统培养法结合生理生化实验从米线样品中检出蜡样芽孢杆菌、金黄色葡萄球菌等致病菌。钟晓等[5]从凉拌米线中检出阪崎肠杆菌、蜡样芽孢杆菌、沙门菌等致病菌。从以往的研究结论来看,传统培养法和生理生化鉴定具有一定的局限性,对含量较低的非优势菌群和不可培养微生物[6]可能有所遗漏。目前Yi Cuiping等[7]利用16S rDNA高通量测序技术分析米粉发酵液中的菌群组成,发现主要细菌包括不动杆菌、醋酸杆菌、伯克霍尔德氏菌、乳酸菌和乳球菌等。由此报道可以看出利用高通量测序技术可获得较详尽的微生物信息,以便研究样品中细菌的多样性、相对丰度及其变化趋势。
虽然高通量测序技术在食源性致病菌检测领域中已有较成熟的应用,如应用高通量测序技术检测即食沙拉中的细菌多样性和食源性致病菌[8],利用高通量测序技术从黄油中检出蜡样杆菌、单核细胞性李斯特菌、肺炎克雷伯菌、大肠杆菌等条件致病菌[9]。但是至今高通量测序技术在分析米线中食源性致病菌污染情况的应用鲜见报道。因此,本研究选择高通量测序作为研究方法,分析米线从原材料、生产加工、存储运输到销售食用的各个环节中,可能存在的食源性致病菌污染情况。并结合传统培养法进行进一步的检测,以期为降低米线食用风险,控制微生物污染提供充分可靠的理论依据。
1 材料与方法
1.1 材料与试剂
米线样品采自某米线工厂。细菌基因组提取试剂盒(Cat#DP1301)、聚合酶链式反应(polymerase chain reaction,PCR)试剂 北京百泰克生物技术有限公司;exTaqDNA聚合酶 宝生物工程(大连)有限公司;DL2000/10000 DNA Marker 美国Life Science公司;实验所用引物均由生工生物工程(上海)股份有限公司合成;所有显色培养基 法国科玛嘉公司;其他试剂均为国产分析纯。
1.2 仪器与设备
AL204电子天平 美国Mettler Toledo公司;T100 PCR仪 美国Bio-Rad公司;Invitrogen Qubit 4.0荧光定量仪、NanoDrop 2000超微量分光光度计 美国赛默飞世尔科技公司;超净工作台 苏州净化设备有限公司;高速冷冻离心机 德国Sigma公司;高压灭菌锅 厦门(致微)仪器有限公司。
1.3 方法
1.3.1 样品处理及DNA提取
采集原料、生产、销售、消费环节的米线样品共11 份,其中原料样品2 份(大米和黏米粉),来自某米线工厂内,大米标记为mx-1,黏米粉标记为mx-2;生产环节样品4 份,与原料采自同一个工厂,分别标记为mx-3、mx-4、mx-5、mx-6;销售环节样品共3 份,采自由同一工厂供货的农贸市场,分别标记为mx-7、mx-8、mx-9;消费环节样品2 份,采自该农贸市场内的凉米线餐馆,分别标记为mx-10和mx-11。采样过程严格按照国家食品污染和有害因素风险监测工作手册要求进行。
采样结束后返回实验室立即提取样品中微生物总DNA。参照Lee等[10]的样品预处理方法,在超净工作台中取适量样品,用无菌生理盐水适当涡旋漂洗样品,得到样品漂洗液备用。使用细菌基因组提取试剂盒从各样品漂洗液中提取细菌菌落宏基因组DNA。使用超微量分光光度计检测DNA浓度及纯度。
1.3.2 16S rDNA基因扩增及Illumina NovaSeq高通量测序
选取16S rDNA全基因序列为扩增及测序对象。以提取的总细菌基因组DNA为模板,利用引物1492-R(5’-CTACGGCTACCTTGTTACGA-3’)和27-F(5’-AGATTTGATCCTGGCTCAG-3’)扩增16S rDNA序列全长[11]。PCR体系:模板DNA 1 μL,dNTP Mixture 2 μL,10×buffer 2.5 μL,Taq酶0.2 μL,正反引物各1 μL,ddH2O补足至25 μL。反应条件参考杜静芳等[12]的基础上进行改动,具体条件如下: 95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸90 s,30 个循环;72 ℃补延伸10 min;4 ℃保存。
扩增结束后,参照Temmerman等[13]的方法,以1%琼脂糖凝胶电泳进行检测。达到测序要求后将各组样品DNA 送至逻捷(济南)生物医药有限公司进行高通量测序,使用高保真酶对DNA样本进行扩增,并使用荧光定量仪进行浓度定量。使用KAPA Hyper Prep Kit进行文库构建,通过Illumina NovaSeq进行测序。
1.3.3 食源性致病菌传统培养法检测与鉴定
根据各样品高通量测序结果配制对应的食源性致病菌显色培养基若干,利用显色培养基检测金黄色葡萄球菌、沙门菌、蜡样芽孢杆菌等致病菌。吸取100 μL样品漂洗液进行涂布,按照各显色培养基说明进行培养。部分常见食源性致病菌显色培养基信息见表1。

表1 食源性致病菌显色培养基Table 1 Chromogenic media for identification of foodborne pathogenic bacteria used in this study
检出的菌株通过16S rDNA序列扩增,测序,再利用NCBI(美国国家生物技术信息中心)数据库进行比对分析。测序工作由生工生物工程(上海)股份有限公司完成。
1.4 数据处理及分析
通过Illumina NovaSeq测序平台得到下机数据,截去Barcode序列并拆分成单个样本数据,使用Trimmomatic 0.38对拆分后的数据进行质量控制。使用Usearch 11.2.64对过滤后的序列数据进行拼接并切除扩增引物序列,得到高质量的Tags数据(有效数据)。
使用Usearch fastq_filter 去除Tags数据中的低质量序列,使用Usearch fastx_uniques 获得按照丰度排序的非冗余序列。通过Usearch unoise3算法(minsize=8)进行去噪,获得Zero-radius可操作分类单元(Zeroradius operational taxonomic units,zOTU)序列,最后将所有的Tags数据比对到代表序列获得zOTU在每个样本中的相对丰度。使用SINTAX算法(Usearch 11.2.64)与RDP 16S Training set v16数据库进行物种注释,并选取算法可信度大于0.8的作为注释结果,去除注释为叶绿体或线粒体相关的可操作分类单元(operational taxonomic units,OTU)后使用 Useaerch otutab_rare对于zOTU表进行标准化。
基于zOTU使用KRONA对单个样本的物种注释结果进行可视化。使用R软件(版本3.2.3)对物种注释结果进行统计和可视化展示,并使用hclust对OTU级别和不同分类级别的部分物种信息绘制热图并进行聚类分析。使用Usearch alpha_div子命令(版本11.2.64)进行多样性指数(richness、Chao1、Shannon等)的计算。
2 结果与分析
2.1 Shannon指数稀释曲线及物种累积曲线
从样品中随机抽取一定测序量的数据,统计其所对应的多样性指数,以数据量与物种多样性构建的曲线称为稀释曲线。通常用来说明样品的测序数据量的合理性,并间接反映样品中物种的丰富度。

图1 10个样本中细菌的Shannon指数曲线Fig. 1 Shannon curves of bacteria in ten samples
如图1所示,10 个米线样本的曲线趋势先直线上升然后再趋向平坦,说明测序量足够大,能覆盖样品中绝大多数微生物信息。10 个米线样品中细菌群落的多样性都比较丰富,数据真实可靠。
物种累积曲线常用于描述样本量与物种丰富度之间的关系,是调查样本物种组成和预测样本中物种丰度的有效方式,被广泛用于判断样本量是否充分以及估计物种丰富度。

图2 10个样本的物种积累曲线Fig. 2 Species accumulation curves for ten samples
由图2可知,随着样品数量增加,物种数目也逐渐增加,显现出抛物线走势,且斜率逐渐减小,未出现直线上升,表明米线中的物种并不会随着样品量的增加而加多,表明对10 个米线样品抽样调查充分。
2.2 热图分析
选取丰度排名较高的30 个菌属及其在每个样品中的丰度信息绘制热图,并从分类信息和样品间差异两个层面进行聚类。如图3所示,湿鲜米线样品mx-5和mx-6,消费样品mx-10和mx-11中微生物分布在属水平上差异相对较小,可以聚类到一个系统分支。而不同的原料间及销售阶段的各样品间的微生物分布差异则较大。在属分类水平上,10 个样品中微生物主要包括不动杆菌属、气单胞菌属、乳酸球菌属等。另外沙门菌属和芽孢杆菌属普遍存在于各米线样品中。
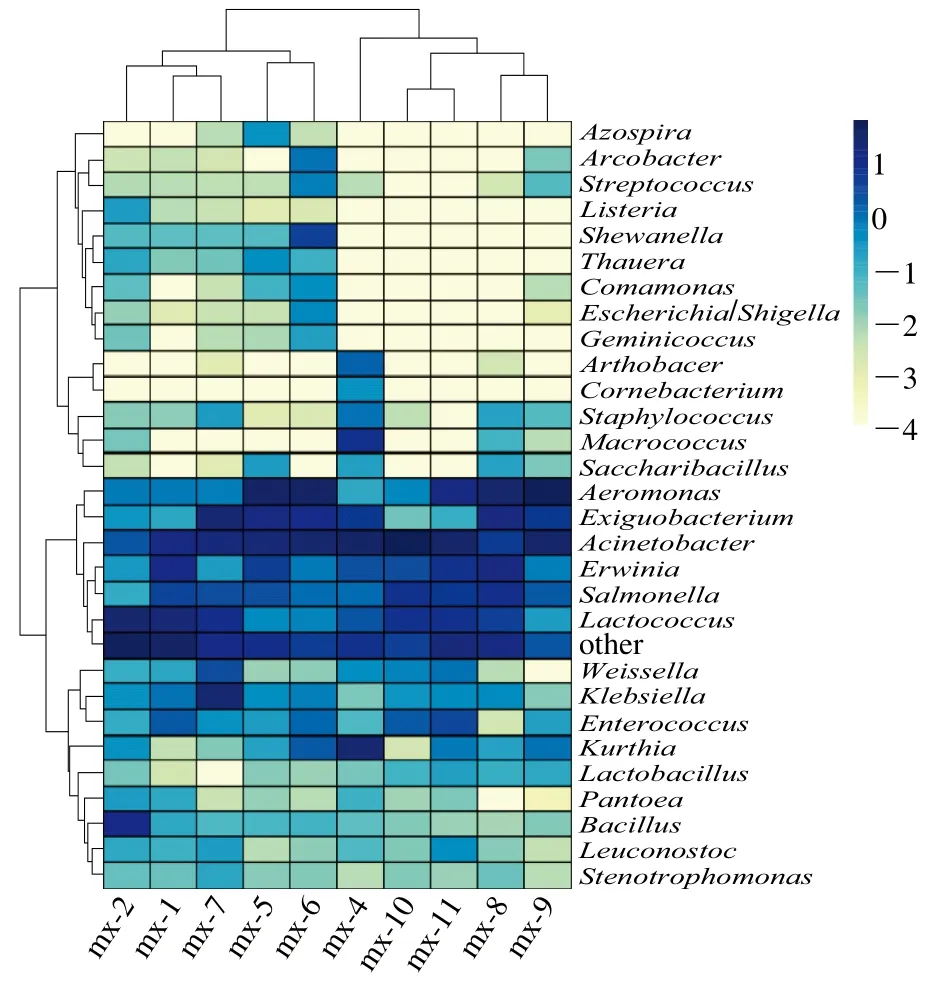
图3 基于属水平的样品物种丰度聚类热图Fig. 3 Heatmap of bacterial community abundance at the genus level
2.3 样品中细菌多样性及其丰度
11 个样品中,除mx-3号样品外,其余10 个样品均成功从漂洗液中提取到DNA。取mx-3号样品漂洗液进行涂板,培养48 h后无菌落生长。分析其原因是由于mx-3号样品取于米线压条机出口,糊化成型过程中的高温处理对原料中微生物具有一定的杀菌作用,但后续加工过程中又带来微生物污染[14]。
基于OTU的分类结果表明,10 个米线样品中细菌分属于5 个门、11 个纲、19 个目、24 个科和29 个属;16S rDNA高通量测序共注释出了放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflex)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)5 个门。在10 个样品中,变形菌门细菌为优势菌,在10 个样品中相对丰度分别占73.86%、53.52%、52.55%、83.79%、82.25%、61.19%、76.42%、91.71%、88.17%、85.28%。在属分类水平(图4),高通量测序共检测出29 个属的细菌,包括芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)、李斯特菌属(Listeria)、沙门菌属(Salmonella)、埃希氏菌属(Escherichia)、志贺菌属(Shigella)等食源性致病菌相关菌属。结果表明在两个原料样品mx-1和mx-2中主要存在乳酸球菌属(Lactococcus)和肠杆菌科未确定属(Enterobacteriaceae unassigned)。而在生产加工过程的3 个样品mx-4、mx-5、mx-6中,优势菌属主要为不动杆菌属(Acinetobacter)和气单胞菌属(Aeromonas),与原料相比米线成品在细菌菌属分布上存在较明显的差异,可能由于在米线生产过程中,高温高压处理使原料中大部分的微生物失活。而生产出的米线成品在贮运环节中,由于工厂规模小,自动化程度低,再加之与食品直接接触的容器或设备不定期清洗,又受到不同种类的细菌交叉污染,从而使细菌菌属分布发生改变[15]。
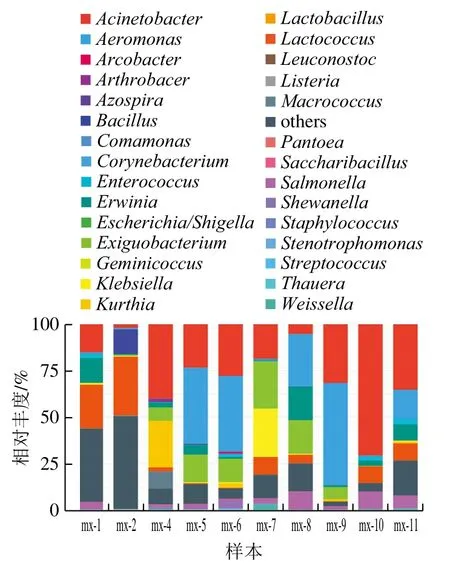
图4 米线样品中细菌在属分类水平的相对丰度Fig. 4 Relative abundance of bacteria in rice noodle samples at the genus level
基于米线生产过程中的加工工艺,本研究认为成品贮藏环节是米线成品的微生物污染的关键控制点,不同于石文松等[16]研究发现预包装湿米粉,生产环节为质量控制关键。由于原料中的微生物在生产环节能够被控制,所以对鲜湿米线成品,一方面要避免生产出的鲜湿米线因长时间存放导致菌落总数超标[17];而另一方面可使用含有0.6%乳酸的浸泡液处理鲜湿米线2 min,真空包装后95 ℃热杀菌25 min以延长鲜湿米线的货架期[18]。对于干米线产品来说,可采取适当的干燥处理,在保证成品率的前提下延长货架期,干燥后的米线应及时进行包装以防吸湿返潮[19]。
销售过程中的mx-7、mx-8、mx-9样品中,细菌种属无明显一致性,可能由于各销售摊位的空气流通性不同,熟食与生食摆放不规范以及不同的销售方式使销售环节的米线细菌菌属存在一定差异[20]。在销售环节中,应要求销售商规范经营方式,改善营业环境,避免不同的食品发生交叉污染。消费环节的两份凉米线样品mx-10和mx-11在菌属分布上具有较高的一致性,推测是因为在凉米线制作过程中,相同的焯水温度及时间,使不耐热菌属如李斯特菌属或埃希氏菌属等非芽孢杆菌属细菌失活,而耐热菌属如芽孢杆菌属、微杆菌属(Exiguobacterium)得以存活。对于米线的销售消费阶段,分析认为关键控制点在于凉米线的售卖环节,大部分商贩只经过简单的焯水,再添加辅料就完成制作供消费者食用。根据高通量测序对菌群种属的聚类分析,凉米线中的细菌物种多样性并没有因为辅料的加入而出现明显的上升。所以食用前的焯水环节显得尤为重要,由于大部分商贩在焯水时仅将米线在热水中短暂漂烫,使米线的口感温度上升,而忽略了高温处理对微生物的杀灭作用。根据以往的研究,凉米线制作过程中热烫30 s后再添加辅料即可大幅增加食用安全性[21]。应避免开水热烫食用或直接食用,充分的加热能杀灭大部分微生物,从而防止出现卫生安全问题。在凉米线的销售过程中,要求摊贩餐馆应规范餐点制作流程,尽可能采用带温控装置的设备,并定时清洁与食品直接或间接接触的平面,对于凉米线等即食类食品做到加工后即时食用,缩短从制作至食用的时间间隔[22]。
2.4 传统培养法检测结果
根据高通量测序结果中注释到的埃希氏菌属、葡萄球菌属、李斯特菌属、芽孢杆菌属、沙门菌属、志贺菌属等食源性致病菌相关菌属信息,选择大肠杆菌O157:H7、金黄色葡萄球菌、单核细胞性李斯特菌、蜡样芽孢杆菌、沙门菌、志贺菌为检测对象。分别配制各显色培养基若干,进行涂布培养,结果见表2。

表2 样品中食源性致病菌检测结果Table 2 Results of detection of foodborne pathogenic bacteria in samples
挑取不同的目标菌株进行16S rDNA测序比对,比对结果与相应特异性筛选培养基筛选结果一致,显示出较高的可信度。如表2所示。在米线生产、贮运、销售、消费等环节中的食源性致病菌污染主要以蜡样芽孢杆菌和沙门菌为主,与高通量测序结果相吻合。郭海艳等[2]研究260 份食品样品后发现米粉米线中主要的污染病原菌为沙门菌和蜡样芽孢杆菌。罗素梅等[23]通过分析150 份即食米粉中污染状况,发现在各种食源性致病菌中蜡样芽孢杆菌和沙门菌的检出率最高,与本研究结果一致。对于米面制品来说,由于其本身的特性而且在贮运过程中长时间暴露于空气中,易受到蜡样芽孢杆菌的污染[24]。由于芽孢状态下该致病菌对不良环境有着较强的抵抗力不易被彻底杀灭,所以对于抑制蜡样芽孢杆菌生长的研究较多。以温度为例,有研究表明蜡样芽孢杆菌在5 ℃条件下生长极为缓慢,该条件下蜡样芽孢杆菌的安全风险降至最低[25]。但是在较低贮藏温度下,淀粉老化使米粉等米面制品质地变硬,弹性下降,断条率也随之升高[26],这对于米粉的加工贮运来说都是不能接受的。而过高的贮藏温度下,微生物的生长繁殖又会使成品的货架期缩短,所以选择合适的贮运温度很重要。杨金平等[27]研究发现,湿米粉在16 ℃条件下贮藏期能达到24 h,且具有较理想的感官评价得分。
以往的研究发现沙门菌污染主要表现在生鲜肉如鲜猪肉、鲜牛肉、鸡肉中[28]。也有报道在豆沙面包和肉松面包等糕点食品中检出沙门菌污染[29]。有分析认为是由于在糕点制作过程中使用含沙门菌污染的蛋类作为食品原料而引入了沙门菌污染[30]。而对于米粉、米线、凉皮等米面制品中沙门菌检测分析的报道还较少,通过分析现有的论文研究结果,推测米面制品中的沙门菌污染主要是由于贮运销售环节中发生了交叉污染所致[31]。除蜡样芽孢杆菌和沙门菌外,本研究在原料、米线成品和销售环节中也的确发现金黄色葡萄球菌污染,在原料和产品中还检出志贺菌、单核细胞性李斯特菌等食源性致病菌。
3 结 论
本研究利用高通量测序结合传统培养法分析不同阶段米线样品中食源性致病菌的污染情况,16S rDNA高通量测序结果一共注释到5 个门、11 个纲、19 个目、24 个科和29 个属的样品微生物信息,包括食源性致病菌相关菌属如芽孢杆菌属、葡萄球菌属、李斯特菌属、沙门菌属等。米线各样品中也检出如上几种常见食源性致病菌,此外部分样品中还检出志贺菌、大肠杆菌O157:H7。两种检测方法的结果加深了对米线中食源性致病菌群落组成和多样性的认识。
由结果分析可知,最应加强管控的环节为在末端的消费环节,大部分商贩在焯水时仅将米线在热水中短暂漂烫,使米线的口感温度上升,而忽略了高温处理对微生物的杀灭作用。建议在制作过程中米线应在沸水中加热至少30 s再食用[21],避免开水热烫食用或直接食用,因为充分的加热可以杀灭大部分微生物,从而防止出现卫生安全问题,增加食用安全性。
