海栖热袍菌木聚糖酶B的分子改造、高效表达及其在啤酒中的应用
2022-03-30刘学强江正强马俊文闫巧娟
刘学强,江正强,余 静,马俊文,杨 行,闫巧娟,*
(1.中国农业大学工学院,中国轻工业食品生物工程重点实验室,北京 100083;2.中国农业大学食品科学与营养工程学院,北京 100083)
麦芽糖化是啤酒酿造过程中一个重要操作单元。大麦麦芽作为主要原料,其胚乳细胞中含有少量阿拉伯木聚糖,阿拉伯木聚糖对麦芽糖化的过滤速度以及啤酒的品质有着较大的负面影响[1]。在此过程中添加木聚糖酶降解其中阿拉伯木聚糖,可明显提高过滤速度,降低糖化液黏度,改善啤酒的品质[2]。Wang Xiaoyu等[3]将密粘褶菌(Gloeophyllum trabeum)木聚糖酶添加于麦芽糖化过程中,糖化液过滤速度提高了31.3%,黏度降低了12.8%。Yu Jing等[4]将毛壳菌(Chaetomiumsp.)CQ31木聚糖酶添加至麦芽糖化过程中,加酶量为200 U/g麦芽,过滤时间和黏度分别降低42.3%和8.6%。尽管已有许多微生物木聚糖酶的报道,但在麦芽糖化中应用效果好的木聚糖酶不多,这与麦芽糖化的条件相关。麦芽糖化过程中糖化液的pH值在5.0~5.6之间,处于弱酸环境,糖化温度在45~70 ℃之间,并且需要在70 ℃保持1 h[2,5]。因此,在弱酸环境中具有较高阿拉伯木聚糖催化活力的耐热木聚糖酶更加适用于麦芽糖化。
通过已有木聚糖酶的分子改造,提高木聚糖酶在pH 5.0~5.6和70 ℃条件下的催化活力,是解决其在麦芽糖化中应用限制的有效手段[6]。木聚糖酶的分子改造已有相关报道,大多集中于提高耐热性,Adsul等[7]利用定向进化分子改造烟曲霉(Aspergillus fumigatus)木聚糖酶,突变体比野生型在70 ℃的半衰期提高了3 倍,达到了42 min。Li Guangqi等[8]对链霉菌(Streptomycessp.)S9木聚糖酶进行理性设计,突变体在75~85 ℃的热稳定性明显提高。而同时改善木聚糖酶耐酸性和催化活力的分子改造报道较少。Andre-Leroux等[9]将灰黄青霉(Penicillium griseofulvum)木聚糖酶的44 位Ser突变为Asp,改变了该酶催化残基的pKa值,突变体Ser44Asp的最适pH值下降了0.5。Azouz等[10]通过定向进化改造Geobacillus stearothermophilusGH10家族木聚糖酶催化活力,2 个突变体Val161Leu和Pro209Leu的kcat/Km由野生型酶的1 178 mL/(s·mg)分别提高至1 799 mL/(s·mg)和2 680 mL/(s·mg)。此外,利用基因工程手段可大幅提高木聚糖酶的产量,毕赤酵母是一个优异的蛋白质异源表达系统,具有高效表达、分泌等许多优点,已用于表达多种木聚糖酶,但仅有少数木聚糖酶表达水平达到工业化需求[11-12]。
海栖热袍菌GH10家族木聚糖酶B(TmXynB)是本实验室报道的一种具有阿拉伯木聚糖活力的极端耐热木聚糖酶,该酶在木二糖生产和面制品中具有一定的应用潜力,但其在麦芽糖化条件下催化效率较低[13-14]。本实验利用定向进化技术分子改造TmXynB,以期获得在pH 5.0~5.6和70 ℃条件下具有较高催化活力的突变体,并将突变体在毕赤酵母中高效表达,进一步评价突变体在麦芽糖化中的应用潜力。
1 材料与方法
1.1 菌株与载体
菌株与质粒:海栖热袍菌(Thermotoga maritima)由本实验室保存。
大肠杆菌E. coliDH5α 北京博迈德科技发展有限公司;毕赤酵母P. pastorisGS115 (His4)、载体pET-28a(+)和载体pPIC9K 美国Invitrogen公司。
1.2 试剂与仪器
低分子质量标准蛋白质,限制性内切酶NdeI、XhoI、EcoR I和NotI、T4 DNA连接酶 大连TaKaRa公司;木糖、木二糖至木六糖、榉木木聚糖 爱尔兰Mezayme公司;桦木木聚糖、燕麦木聚糖和小麦阿拉伯木聚糖 美国Sigma公司;其他试剂如无特殊说明均为分析纯。
突变体文库初筛培养基:5 g/L酵母浸粉、10 g/L胰蛋白胨、10 g/L NaCl、0.05 g/L卡那霉素、1 mmol/L IPTG、1 g/L AZCL-Birchwood xylan、5 g/L还原胶、15 g/L琼脂粉,配制时用50 mmol/L pH 5.0的柠檬酸-柠檬酸钠缓冲液。其他培养基的配制和仪器与余静等[15]报道相同。
1.3 方法
1.3.1 易错聚合酶链式反应(polymerase chain reaction,PCR)和DNA改组
易错PCR:以TmXynBF和TmXynBR为引物(表1),对TmXynB基因序列易错PCR扩增,在引物中分别插入NdeI和XhoI酶切位点。易错PCR 50 μL体系组成如下:7 mmol/L Mg2+、0.1 mmol/L Mn2+、0.2 mmol/L dATP、0.2 mmol/L dGTP、1 mmol/L dCTP、1 mmol/L dTTP、0.2 μmol/LTmXynBF和TmXynBR,2.5 UTaqDNA polymerase,5 ng重组质粒(pET28a-TmXynB)。扩增完成后,利用10 mg/mL琼脂糖凝胶纯化回收易错PCR产物,得到扩增产物TmXynB-m。
DNA改组:利用DNase I酶切上述易错PCR产物TmXynB-m,实现DNA的随机片段化。利用20 mg/mL的琼脂糖凝胶电泳验证酶切产物,利用酚-氯仿-异戊醇(25∶24∶1,V/V)纯化并用乙醇沉淀得到DNA片段TmXynB-m/DNase I。以DNA片段TmXynB-m/DNase I作为模板进行重叠延伸PCR。最后以重叠延伸PCR产物为模板扩增全长基因。

表1 本研究所用PCR引物总结Table 1 Oligonucleotide primers used in this study
1.3.2 大肠杆菌随机突变文库的构建与筛选
使用限制性内切酶NdeI和XhoI双酶切上述全长PCR扩增产物和表达载体pET28(+),对酶切产物回收后连接构成重组载体pET28(+)-全长PCR扩增产物。利用酚-氯仿-异戊醇(25∶24∶1,V/V)纯化并用乙醇沉淀得到重组载体,导入大肠杆菌E. coliBL21,收集所有含有转化子的菌落。突变体文库的初筛利用AZCL-Xylan平板法,根据TmXynB水解平板中的桦木木聚糖产生透明圈的原理进行阳性克隆的高通量筛选。
选取初筛为阳性的克隆接种于LB液体培养基中,37 ℃培养至菌体湿质量OD600达0.6~0.8,加入1 mmol/L的IPTG进行重组酶的诱导表达。分别测定不同菌株粗酶液的最适pH值与最适温度。以最适pH值向酸性方向偏移且最适温度下降的突变体为正向突变体。TmXynB正向突变体mTmXynB的纯化参照余静等[15]的方法。
1.3.3 木聚糖酶活力和蛋白含量的测定
木聚糖酶酶活力测定采用DNS法[16],将酶液用柠檬酸-柠檬酸钠(50 mmol/L,pH 5.5)缓冲液适当稀释,吸取稀释后的酶液100 μL加入到900 μL榉木木聚糖底物(1 g/100 mL 50 mmol/L pH 5.5柠檬酸-柠檬酸钠缓冲液)。在90 ℃反应10 min,加入1 mL DNS溶液(1 g/100 mL)终止反应,沸水浴15 min,加入1 mL酒石酸钾钠(40 g/100 mL)溶液后在OD540条件下测定吸光度,以木糖为标准。木聚糖酶的活力单位定义:在此反应条件下,每分钟生成1 μmol木糖所需要的酶量。
蛋白含量的测定参照Lowry等[17]的方法,以牛血清白蛋白作为标准蛋白。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)根据Laemmli法[18]进行。
1.3.4 突变体mTmXynB的酶学性质
在70 ℃,50 mmol/L不同pH值的缓冲溶液中测定mTmXynB纯酶的酶活力,确定最适pH值。pH值稳定性的测定是将酶液用上述不同体系不同pH值的缓冲液分别稀释,于70 ℃水浴中保温30 min,然后迅速置于冰水浴冷却30 min,测定残余酶活力。最适温度的测定是将纯酶用50 mmol/L pH 5.5的柠檬酸-柠檬酸钠缓冲溶液适当稀释,分别在35~100 ℃测定木聚糖酶酶活力确定最适温度。温度稳定性的测定是将纯酶用50 mmol/L pH 5.5的柠檬酸-柠檬酸钠缓冲溶液适当稀释,在不同温度下孵育30 min,然后于冰水浴中冷却30 min后,在最适温度下测定残余酶活力。
用50 mmol/L pH 5.5的柠檬酸-柠檬酸钠缓冲液配制不同种类的木聚糖底物(10 mg/mL),在70 ℃按照标准方法测定酶活力。其中木聚糖底物包括:榉木木聚糖、桦木木聚糖、燕麦木聚糖和小麦阿拉伯木聚糖。用50 mmol/L pH 5.5的柠檬酸-柠檬酸钠缓冲液配制不同质量浓度的木聚糖,在90 ℃、pH 5.5下测定TmXynB的酶活力,反应时间为5 min,并通过“Grafit”软件计算最大反应速度Vmax和Km。
用50 mmol/L pH 5.5的柠檬酸-柠檬酸钠缓冲液配制10 mg/mL的燕麦木聚糖及木四糖,60 ℃水浴反应,定时取样并用沸水灭活,冷却后离心取上清液进行薄层层析分析。
1.3.5 TmXynB突变体的定点突变与结构分析
正向突变体基因(mTmXynB)经测序后,根据其与TmXynB基因序列差异分析具体变化氨基酸,确定mTmXynB的突变位点。以野生型TmXynB基因为出发点,向正向突变体的方向逐一进行定点突变,具体引物见表1。获得定点突变后的全长基因并测序验证无误后,使用NdeI和XhoI对PCR产物和表达载体pET28a双酶切,再将酶切后产物和表达载体连接并转化至E. coliBL21。
TmXynB突变体的晶体结构已公开,登录http://www.rcsb.org/网址根据(PDB∶1VBU)下载其晶体结构解析数据。mTmXynB中相关氨基酸突变构象变化、表面电荷分布和分子间作用力变化通过Pymol软件观察与分析。
1.3.6 突变体mTmXynB基因在毕赤酵母的重组表达与高密度发酵
用限制性内切酶EcoR I和NotI对木聚糖酶突变体基因(mTmXynB)和载体pPIC9K双酶切,凝胶回收后连接获得重组质粒pPIC9K-mTmXynB。重组质粒pPIC9K-mTmXynB用限制性内切酶SalI线性化后电转化至巴斯德毕赤酵母(P. pastoris)GS115中。取100~200 μL电转化产物涂布于MD平板培养基,30 ℃条件下培养2~3 d后用无菌蒸馏水将MD平板上生长的毕赤酵母转化子洗脱和重悬。分别涂布于含有不同质量浓度的YPD-G418平板培养基上,30 ℃培养2~5 d。挑取不同质量浓度G418平板培养基上的单菌落摇瓶发酵3 d,吸取上清液检测木聚糖酶活力。
选取摇瓶发酵木聚糖酶活力最高的重组菌株进行高密度发酵。发酵方法及培养基的配制参照毕赤酵母发酵手册(Version B,053002,Invitrogen)操作。
1.3.7 TmXynB和突变体mTmXynB在麦芽糖化中的应用
参照QB/T 1686—2008《啤酒麦芽》。称取50.0 g麦芽细粉放入糖化杯中,倒入已预热至45 ℃的水200 mL,于45 ℃糖化仪中保温30 min(加入一定量酶液,对照不加酶),不断搅拌。然后使醪液以每分钟1 ℃的速率在25 min内升温至70 ℃,再往糖化杯中加入已预热好70 ℃的水100 mL,在70 ℃保温1 h,糖化过程不断搅拌。糖化结束后,测定其过滤时间和麦芽汁黏度。
1.4 数据分析
采用OriginPro 9.2软件对相关数据进行统计分析和绘图。
2 结果与分析
2.1 TmXynB随机突变文库的筛选和突变体mTmXynB的纯化
随机突变文库中每个基因中含2~7 个碱基替换,约1~4 个氨基酸突变,即氨基酸突变率约为0.55%。在pH 5.0酸性固体培养基初筛12 000 个突变体,大约有35%的突变体呈现透明圈,与野生型透明圈对比,将较大透明圈的菌株进行培养、诱导,纯化和酶学性质测定,此过程共纯化950 个突变体。最终,发现一株在酸性、70 ℃具有较高催化活力的突变株,命名为mTmXynB。
突变体mTmXynB经Ni-IDA亲和层析一步纯化,mTmXynB的比活力为2 010 U/mg,纯化倍数为3.87,回收率为81%。该酶分子质量约为40 kDa(图1),与野生型GH10家族TmXynB的分子质量一致。
与野生型TmXynB最适条件下比活力(2 540 U/mg)相比,突变体mTmXynB的比活力(2 010 U/mg)下降约25%,但高于已报道的嗜盐嗜碱菌(Alkalibacteriumsp. SL3,180 U/mg)[19]、巴伦葛兹类芽孢杆菌(P. barengoltzii,293 U/mg)[20]和Geobacillussp.WSUCF1(461 U/mg)[21]等大多数细菌GH10家族木聚糖酶。

图1 突变体mTmXynB纯化图Fig. 1 The purification steps of mTmXynB
2.2 突变体mTmXynB的酶学性质
与TmXynB相比,mTmXynB的最适pH值向酸性方向偏移0.5 个单位,降低至pH 5.5,在pH 3.5~5.5时,突变体相对酶活力上升了10%~30%(图2a)。mTmXynB在pH 3.5~10.0之间保持稳定,相比于野生型TmXynB,在pH 3.5下,相对酶活力上升约20%。mTmXynB的最适温度为90 ℃,相比于野生型TmXynB的最适温度(100 ℃)下降了10 ℃,在50~90 ℃条件下,相对酶活力出现较大幅度的提升(图2b)。
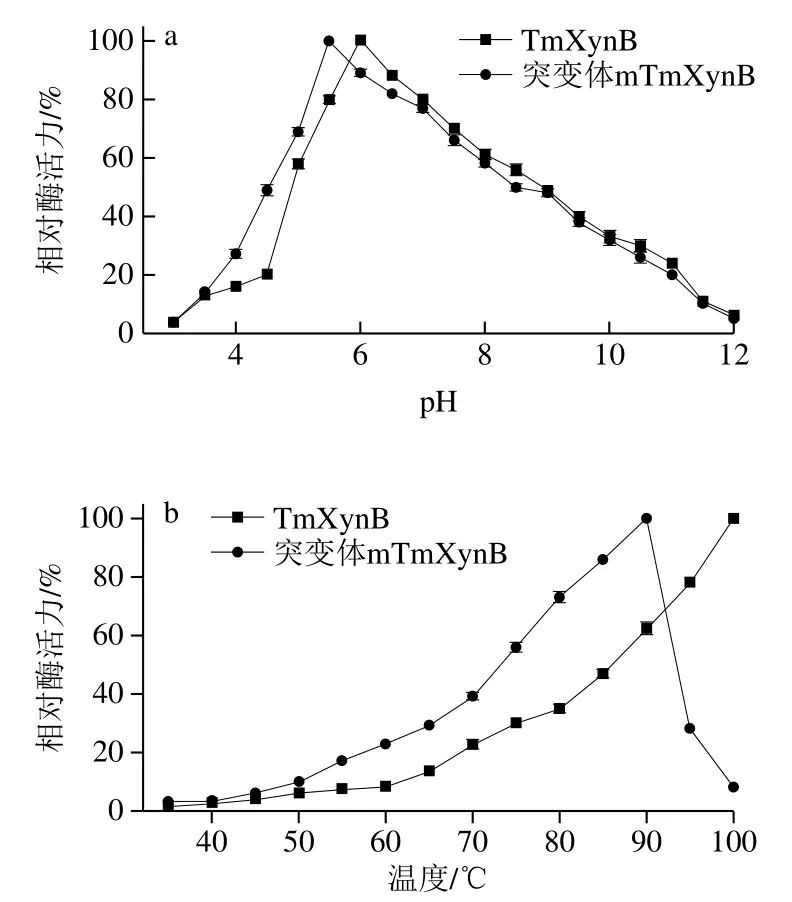
图2 TmXynB和mTmXynB的最适pH值(a)和最适温度(b)Fig. 2 Optimal pH (a) and temperature (b) of TmXynB and mTmXynB
如表2所示,mTmXynB对燕麦木聚糖具有最大的比活力,为2 205 U/mg,其次为桦木木聚糖(2 039 U/mg)和榉木木聚糖(2 010 U/mg),最后是小麦阿拉伯木聚糖(1 565 U/mg)。在pH 5.5和90 ℃条件下,mTmXynB的比活力约是野生型TmXynB比活力的3 倍。

表2 TmXynB和突变体mTmXynB的底物特异性Table 2 Substrate specificity of TmXynB and mTmXynB from T. maritima
在pH 5.5和90 ℃条件下,mTmXynB对榉木木聚糖的最大催化速率(Vmax)为1 903 μmol/(min·mg),是相同条件下TmXynB对榉木木聚糖的2.8 倍。mTmXynB对燕麦木聚糖的最大催化速率(Vmax)为2 013 μmol/(min·mg),是相同条件下TmXynB对燕麦木聚糖的2.9 倍。这表明mTmXynB在酸性高温条件下催化效率显著提高。mTmXynB相比于TmXynB的Km值稍微下降,这表明突变体稍微提高了酶与底物的亲和性。mTmXynB可以迅速降解燕麦木聚糖产生木二糖和少量的木三糖,同样水解木四糖主要产生木二糖。mTmXynB保留了野生型TmXynB优良的水解特性[13],产物以木二糖为主,仅有微量木糖存在,在低聚木糖生产的应用上具有较大的潜力。
通常来说,细菌来源木聚糖酶的最适pH值大多在pH 6.0~7.5之间。进化后的海栖热袍菌GH10木聚糖酶的最适pH值为5.5,低于枯草芽孢杆菌(B. subtilis,pH 6.5)[22]、C. algeriensis(pH 6.5)[23]、Geobacillussp. WSUCF1(pH 6.5)[21]、Marinimicrobiumsp. LS-A18(pH 8.0)[24]和嗜盐嗜碱菌(Alkalibacteriumsp. SL3 pH 9.0)[19]等细菌来源的木聚糖酶。绝大多数细菌木聚糖酶的最适温度处于50~60 ℃[2],例如嗜盐嗜碱菌(Alkalibacteriumsp.)SL3[19]、巴伦葛兹类芽孢杆菌(P. barengoltzii)[20]和枯草芽孢杆菌(B. subtilis)[22]木聚糖酶的最适温度分别为55、55 ℃和60 ℃。此外,少数细菌木聚糖酶为耐热木聚糖酶,例如C. algeriensisGH10家族木聚糖酶的最适温度为80 ℃,可以在75 ℃以下保持稳定[23]。TmXynB为目前报道的最耐热木聚糖酶[14],进化后突变体最适温度稍有下降,但仍旧保持了该酶的耐热性。
2.3 突变体mTmXynB的突变位点与性质改变关系
根据序列比对,相对于野生型TmXynB,突变体mTmXynB总共发生3 处氨基酸突变,分别为Asn91Ser、Trp129Arg和Arg143Glu。将野生型TmXynB与其他序列同源性较高的GH10家族木聚糖酶进行序列比对发现Asn91和Trp129为保守氨基酸,而Arg129为非保守氨基酸。为进一步明确各突变氨基酸对野生型木聚糖酶TmXynB酶学性质改变造成的影响,设计3 个单一突变体和一个组合突变体。3 个单一突变体为Asn91Ser、Trp129Arg和Arg143Glu,组合突变体为Asn91Ser/Arg143Glu。4 个突变体的最适pH值、最适温度和比活力如表3所示。与野生型TmXynB相比,突变体Asn91Ser的最适pH值和温度没有明显改变,但比活力提高至3 551 U/mg;突变体Trp129Arg的最适pH值没有明显变化,最适温度下降了10 ℃,比活力出现大幅度下降(1 565 U/mg);突变体Arg143Glu的最适pH值下降了0.5,最适温度没有明显变化,比活力稍微下降(2 286 U/mg)。相比于野生型TmXynB,组合突变体Asn91Ser/Arg143Glu的最适pH值下降了0.5,最适温度没有明显变化,比活力提高(3 180 U/mg);相比于突变体Asn91Ser,最适pH值下降了0.5,温度没有明显变化,比活力稍微下降。结果表明,Trp129Arg是突变体mTmXynB最适温度改变的关键突变位点,Arg143Glu是突变体mTmXynB最适pH值改变的关键突变位点,但Trp129Arg和Arg143Glu两个突变位点均造成了比活力的下降,尤其是Trp129Arg,而Asn91Ser则是一个可以提高比活力的关键突变位点。

表3 TmXynB与5 个突变体的基本酶学性质Table 3 Enzymatic characteristics of TmXynB and five mutants from T. maritima
与其他的GH10家族木聚糖酶整体结构相似,TmXynB的整体结构呈现经典的(β/α)8-TIM桶结构,如图3所示。其中,mTmXynB中2 个突变氨基酸(Asn91Ser和Arg143Glu)位于酶分子的表面,而Trp129Arg位于酶分子的内部。通常来说,蛋白质的刚性越强,酶的耐热性越好[6]。TmXynB是迄今报道的极端耐热酶,其脯氨酸含量为3.7%且多位于loop区或α-螺旋处,它存在几个强疏水网络,在C端有一些可形成盐桥的氨基酸,这些都会增加该酶的刚性[14]。Trp129位于β-折叠上,与它距离4 Å以内的氨基酸基本上都为疏水氨基酸,分别为Met51、Leu87、Val118、Val119、Val126、Ile128、Val131、Ile171、Leu172和Ile173,这些疏水氨基酸与Trp129共同形成一个强疏水网络,Trp129突变为Arg129打破了强疏水网络,酶的稳定性受到破坏,因此突变体mTmXynB相比于野生型TmXynB温度稳定性和比活力均有一定下降(图3c、d)。一般来说,这种强疏水稳定性网络距离催化凹槽越近,对酶的催化活性影响越为关键[14],而Trp129存在的强疏水网络距离催化凹槽较远,因此并没有使该酶失去催化活力。
通过预测TmXynB和mTmXynB表面的电荷分布,发现当Arg143突变为Glu143后,局部表面电荷由强正电变为强负电,此位置距离催化凹槽较近,这可能是Arg143Glu提高该酶耐酸性的主要原因[25-26](图3e、f)。此外,当Arg143突变为Glu143时,由于侧链变短,该位置处与Tyr177的氢键消失了,而Tyr177可与催化氨基酸Glu153形成疏水作用力,这可能是Arg143Glu突变体造成酶活力稍微下降的原因[27](图3g、h)。突变体Asn91Ser可提高野生型TmXynB约25%的比活力。经结构分析,发现位于89位的Trp与底物结合具有疏水作用力,是关键氨基酸,而其作为芳香氨基酸拥有共轭π体系,π电子(负电子)多集中于芳香环的中心位置,可与91位的氨基酸相互作用[14];此外,Ser91氨基酸侧链(CH2—OH)上的氧原子具有较强的电负性,可吸引与之相连碳原子的电子,导致侧链上电荷分布不均匀,形成类似于中等强度氢键的偶极矩作用力,当Asn91突变为Ser91后,氧原子正好位于Trp89位置的正上方,2 个负电子形成互斥,可能改变Trp89的构象,使之与糖环间的疏水作用力增强,从而影响该酶的比活力[28-29](图3a、b)。

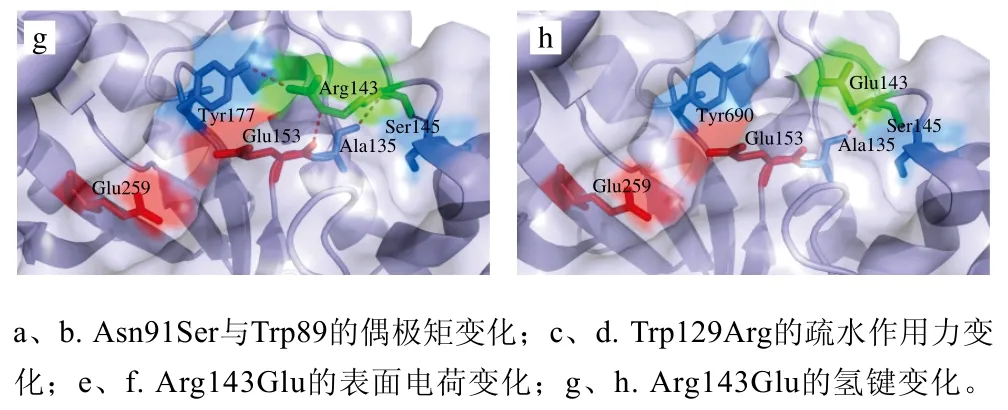
图3 TmXynB和mTmXynB的结构、改变位点、作用力和表面电荷分布示意图Fig. 3 Structure, mutation sites, molecular force changes and surface charge distribution
2.4 TmXynB突变体mTmXynB的高效表达
将重组质粒pPIC9K-mTmXynB电转化至P. pastorisGS115中成功表达,根据转化子对G418遗传抗性差异筛选出高拷贝菌株中酶活力最高为4 mg/mL G418质量浓度下的4-3,木聚糖酶活力为170 U/mL。选取4-3菌株在5 L发酵罐中高密度发酵,经过甲醇诱导180 h后,发酵上清液木聚糖酶活力为18 000 U/mL,蛋白质量浓度为12 mg/mL,菌体湿质量为510 g/L(图4a)。SDS-PAGE分析发现,目的蛋白在42 kDa中处存在一些弥散的条带,这与TmXynB现象类似,是因为糖基化现象造成的。目的蛋白约占总蛋白含量的90%以上,仅有少量杂蛋白分泌至培养基中(图4b)。

图4 重组毕赤酵母高密度发酵产mTmXynB历程Fig. 4 Time course of mTmXynB production by P. pastoris in a 5 L fermentor, and SDS-PAGE pattern of the supernatant
迄今,已有多种木聚糖酶在毕赤酵母中成功表达。mTmXynB的表达水平高于大多数木聚糖酶在毕赤酵母中表达水平,例如来源于构巢曲霉(A. nidulans,80.5 U/mL)[30]、里氏木霉(T. reesei,780 U/mL)[31]、链霉菌属(Streptomycessp. FA1,1374 U/mL)[32]、黑曲霉(A. niger,1827 U/mL)[33]和枝链霉菌(S. rameus,13626 U/mL)[34]的木聚糖酶,但mTmXynB的表达水平低于嗜热拟青霉(P. thermophila,52 490 U/mL)[35]。mTmXynB的高效表达使其在工业生产中具有良好的应用潜力。
2.5 突变体mTmXynB在麦芽糖化中的应用
如表4所示,在模拟糖化条件下,野生型木聚糖酶TmXynB的添加量为600 U/g麦芽时,过滤时间达到最低,相比于对照,下降了39%,同时黏度下降了8.1%,继续提高加酶量过滤时间和黏度变化不大。而突变体mTmXynB在150 U/g麦芽加酶量时,过滤时间达到最低,相比对照下降了45%,黏度下降了8.7%,继续提高加酶量过滤时间和黏度变化不大。

表4 TmXynB与突变体mTmXynB对麦芽糖化的影响Table 4 Effect of TmXynB and mTmXynB on malt mashing
相比于TmXynB,突变体mTmXynB在麦芽糖化中的应用效果更好,且加酶量下降了75%倍,这与mTmXynB的酶学性质与麦芽糖化条件更加接近有关。目前,已有一些木聚糖酶在麦芽糖化应用的研究报道。例如,来源于毛壳霉(Achaetomiumsp.)Xz-8[36]、密黏褶菌(G. trabeum)[3]、特异腐质霉(H. insolens)[37]和嗜松青霉(P. pinophilum)[38]的木聚糖酶分别可降低过滤时间14.3%、17.2%、30.2%和35.6%,同时可降低麦芽汁黏度6.3%、7.1%、6.4%和9.6%。可见,突变体mTmXynB在麦芽糖化中的作用效果处于已报道的很好水平,表明该酶在啤酒工业中具有较好的应用前景。
3 结 论
定向进化海栖热袍菌GH10家族TmXynB,获得在酸性高温下比活力更高的突变体mTmXynB。相比野生型TmXynB,mTmXynB耐酸性提高,耐热性下降,在pH 5.5和90 ℃反应条件下对木聚糖的催化酶活力提高了3 倍左右。突变体mTmXynB在毕赤酵母实现了高效表达,经5 L发酵罐高密度发酵酶活力可达18 000 U/mL。在协定糖化条件下,mTmXynB于150 U/g添加量时效果最佳,过滤时间下降45%,料液黏度下降8.7%。因此,突变体mTmXynB在啤酒工业中具有很大的应用前景。
