蒜皮水溶性多糖的制备及结构表征
2022-03-30蒋茂婷冉艳红黄雪松
蒋茂婷,冉艳红,刘 娜,黄雪松,*
(1.暨南大学理工学院,广东 广州 510632;2.暨南大学生命科学技术学院,广东 广州 510632)
我国是世界最大的大蒜(Allium sativumL.)生产与消费国,已占其国际贸易量的85%~90%。脱水蒜片是重要的国际贸易蒜加工品之一,其在加工过程中,产生了大量的蒜皮、蒜梗等副产品;根据脱水蒜片厂的统计,蒜皮的量一般为鲜蒜干质量的5%。其实,蒜皮含有多种营养成分及功能活性[1-2],刚收获鲜蒜的蒜皮可食性好,只是随着采收时间延长而干燥后,口感欠佳,以为“不可食”而已,故其常被丢弃或焚烧掉,仅有少量制成饲料或有机肥,造成了不必要的资源浪费和环境污染。因此,为充分利用蒜皮资源,迫切需要研究其性能及化学组成、开发其加工利用技术。
刘湾等[3]的研究表明蒜皮中水溶性粗多糖含量为(5.55±0.01)%,含量较高;但未见对其化学性质、结构特性等方面的研究报道。多糖的化学结构是其生物活性的基础,其结构分析是糖化学研究的核心所在。因此本实验拟由蒜皮制备得蒜皮水溶性多糖(water-soluble polysaccharide from garlic skin,GSWSP),并研究其结构特征,以期为GSWSP的进一步研究提供基础,为蒜皮的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
蒜皮由山东金乡县大蒜研究所提供。
DEAE-52纤维素 美国GE公司;Sephadex G-100凝胶 上海源叶生物科技有限公司;浓硫酸、氢氧化钠、氯化钠(均为分析纯) 天津市津东天正精细化学试剂厂;无水乙醇、苯酚、氯仿(均为分析纯)广州化学试剂厂;3,5-二硝基水杨酸(化学纯) 上海化学试剂公司;2,5-二羟基苯甲酸(2,5-dihydroxybenzoic acid,DHB)、1-苯基-3-甲基-5-吡啶啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP) 美国Sigma公司;三氟乙酸(trifluoroacetic acid,TFA)(分析纯) 天津市科密欧化学试剂开发中心;葡聚糖T-5、T-20、T-40、T-200,葡萄糖、葡萄糖醛酸、半乳糖醛酸、阿拉伯糖、半乳糖、鼠李糖、甘露糖、木糖、果糖、蔗果三糖、蔗果四糖、蔗糖 德国Augsburg公司;乙腈、甲醇(均为色谱纯) 美国迪马公司。
1.2 仪器与设备
SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;UV-9600紫外-可见分光光度计 北京瑞利分析仪器公司;CD-308粉碎机 顺德市肯德利电器;SS-300三足式离心机 张家港市苏南化工机械厂;LC-20A高效液相色谱仪、TM3030Plus型扫描电子显微镜日本岛津公司;T18分散机 艾卡(广州)仪器设备有限公司;REFLEXTMIII基质辅助激光解吸/电离飞行时间质谱(matrix-assisted-laser-desorption-ionizer time of flight mass spectrometry,MALDI-TOF-MS)仪、Equinox 55红外光谱(infrared spectroscopy,IR)仪、500 ultrashield核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)仪、Multimode 8原子力显微镜、D8 ADVANCE X射线衍射仪 德国Bruker公司。
1.3 方法
1.3.1 GSWSP的制备
干燥蒜皮,粉碎后过60 目筛,加20 倍蒸馏水,用分散机组织破碎8 min,300 W、30 ℃超声处理30 min,90 ℃恒温水浴锅浸泡40 min后,放置过夜。3 500 r/min离心20 min,取上清液于旋转蒸发仪中60 ℃浓缩至可溶性固形物质量分数为30%,向浓缩后的蒜皮液中加入无水乙醇至乙醇体积分数50%~80%后放置,沉淀过夜。取冷冻干燥后沉淀用蒸馏水溶解,过DEAE-52柱(2.5 cm×50 cm),分别用蒸馏水,0.3、0.6、0.9 mol/L NaCl溶液梯度洗脱。合并蒸馏水洗脱液中含多糖部分的流出液,过Sephadex G-100柱(1.2 cm×50 cm),蒸馏水洗脱。合并含多糖部分的流出液,冷冻干燥,即得GSWSP。提取分离过程中,采用苯酚-硫酸法[4]进行跟踪测试。
1.3.2 GSWSP纯度鉴定
采用高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)鉴定GSWSP纯度[5]。色谱条件:PolySep-GPC-P4000色谱柱(7.8 mm×300 mm),流动相蒸馏水,进样量10 μL,流速0.5 mL/min,柱温30 ℃,检测器为蒸发光散射器(evaporative light-scattering detector,ELSD),ELSD撞击器为关闭状态,漂移管温度110 ℃,载气流速2.5 L/min。
1.3.3 GSWSP分子质量测定
采用MALDI-TOF-MS[6]和HPGPC两种方法测定。
MALDI-TOF-MS法:将GSWSP与适量DHB溶液混合,取0.5 μL混合液滴于样品靶上,待溶剂挥发,样品结晶后,进行质谱测定。
HPGPC法:测定条件同1.3.2节。以葡聚糖T-5、T-20、T-40、T-200和葡萄糖为分子质量标准品测定获得分子质量-保留时间标准曲线(lgmw=-0.331 3t+9.076 7,n=5,r=-0.920 7)。
1.3.4 单糖组成与比例测定
1.3.4.1 制备GSWSP水解样品
称取10 mg GSWSP,加入1 mL 2 mol/L TFA,封管后于110 ℃油浴水解4 h,减压蒸馏除去TFA,并多次少量加入甲醇继续蒸馏以除净TFA。最后加入1 mL纯水溶解,得水解样品溶液。
1.3.4.2 水解样品的测定
采用PMP柱前衍生化法测定GSWSP的醛糖和糖醛酸;使用糖柱无需衍生化直接测定GSWSP的果糖;综合2 种方法测定结果获得其单糖的组成与比例。
1)衍生化样品:取GSWSP水解样品溶液100 μL,加入100 μL 0.3 mol/L NaOH溶液和100 μL 0.5 mol/L PMP溶液,置于70 ℃烘箱反应60 min,取出冷却至室温后,加入100 μL 0.3 mol/L HCl溶液中和,并用1 mL氯仿重复萃取3 次去除PMP等杂质。取上层水相加水1 mL,经0.22 μm微孔滤膜滤过后高效液相色谱测定分析。以各单糖标准样品(甘露糖、鼠李糖、葡萄糖醛酸、半乳糖、葡萄糖、半乳糖醛酸、阿拉伯糖)为对照。
高效液相色谱条件:Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm);流动相:A为0.05 mol/L磷酸盐缓冲液(pH 6.8),B为乙腈;A-B(17∶83,V/V)等度洗脱;进样量10 μL;流速1.0 mL/min;柱温30 ℃;检测波长254 nm[7-8]。
2)未衍生化样品:将GSWSP水解样品溶液稀释至约1 mg/mL,经0.22 μm微孔滤膜滤过后高效液相色谱测定分析。以各单糖标准样品(果糖、葡萄糖、蔗糖、蔗果三糖、蔗果四糖)为对照。
高效液相色谱条件:Prevail Carbohydrate ES柱(250 mm×4.6 mm,5 μm);流动相:A为水, B为乙腈;采用梯度洗脱方式,梯度条件:0~5 min,25%~50% A,75%~50% B;5~12 min,50%~25% A,50%~75% B;12~15 min,25% A,75% B。进样量10 μL,流速1.0 mL/min,柱温40 ℃,检测器为ELSD,ELSD撞击器为关闭状态,漂移管温度90 ℃,载气流速2.5 L/min[9]。
1.3.5 构型与连接方式测定
NMR测定:GSWSP溶解在D2O中,质量浓度为40 mg/mL。使用500 MHz NMR仪,在30 ℃记录1H、13C、1H-1H COSY和1H-13C HSQC NMR光谱。
IR测定:GSWSP和KBr按质量比1∶100混合研磨均匀,压片,在4 000~400 cm-1范围内进行扫描。
1.3.6 三股螺旋结构测定
1.3.6.1 刚果红实验
取1.0 mL 2 mg/mL GSWSP溶液,分别加入3 mL不同浓度(0~1.0 mol/L)的NaOH溶液,1.5 mL 0.2 mmol/L刚果红溶液及0.5 mL蒸馏水,涡旋混匀后,静置1 h,运用紫外分光光度计在200~800 nm波长范围内扫描[10],记录样品在不同终浓度NaOH溶液体系中的最大吸收波长。并以此为纵坐标,NaOH溶液的终浓度为横坐标作图。以蒸馏水为空白对照。
1.3.6.2 圆二色谱扫描
GSWSP用蒸馏水配制成1 mg/mL的溶液,然后用圆二色谱仪检测其圆二色性,扫描波长范围为190~300 nm。
1.3.7 结晶度测定
采用X射线衍射仪测定GSWSP的结晶度[11]。测定条件:Cu-Kα辐射,扫描速率2 °/min,采样步宽0.05°,扫描范围2θ为4°~50°。
1.3.8 GSWSP介观(微米或亚微米[12])结构表征
1.3.8.1 分子形貌测定
GSWSP用超纯水配制成10 μg/mL的溶液,过0.22 μm微孔滤膜后,用微量移液枪吸取5 μL多糖溶液,滴在洁净的云母片上,置于室温下风干后进行原子力显微镜观察。
1.3.8.2 表观形貌测定
取适量冻干GSWSP均匀的粘在样品盘上,吹去浮沫,喷金后在扫描电子显微镜下观察。
1.4 数据处理
2 结果与分析
2.1 分离纯化分析结果
蒜皮经水提醇沉后得水溶性粗多糖,得率为(6.92±0.07)%,略高于刘湾等[3]测得的(5.55±0.01)%,可能与蒜皮品种、新鲜程度等原料不同有关,也与浸泡时间、提取温度等提取条件不同有关。
蒜皮水溶性粗多糖溶液上样于DEAE-52柱,经蒸馏水、0.3、0.6、0.9 mol/L NaCl溶液洗脱后,得到2 个吸收峰,其中蒸馏水洗脱部分(图1a峰1)为多糖含量最高组分,收集该部分通过Sephadex G-100柱进一步纯化后得GSWSP,其洗脱峰为单峰(图1b),表明GSWSP为均一组分,其得率为(2.83±0.02)%,呈粉末状。

图1 GSWSP分离纯化图Fig. 1 Separation and purification of GSWSP on DEAE-52 and Sephadex G-100
2.2 GSWSP的纯度
GSWSP在HPGPC上的保留时间为16.913 min(图2),且为单一、对称的尖峰,其结果与大蒜多糖纯度测定结果[6]类似。由面积归一化法得GSWSP纯度为95.57%,表明其纯度较高,可满足其结构表征的要求。
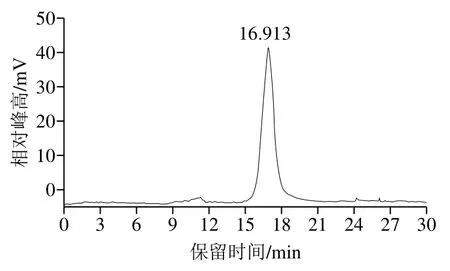
图2 GSWSP的HPGPC图Fig. 2 HPGPC profile of GSWSP
2.3 GSWSP的一级结构特征
2.3.1 分子质量
2.3.1.1 MAIDI-TOF-MS测定结果
由图3可以看出,GSWSP能被有效离子化,得到系列阳离子峰。其中强度高的系列阳离子峰,实际是GSWSP系列分子离子峰[M+Na]+,这是因为GSWSP是由不同分子质量聚糖组成;根据系列阳离子峰,可以推断GSWSP的分子质量范围在731~2 615 Da之间;这与其他多糖情况一致[13-14],也基本符合Sephadex G-100柱分离纯化1~100 kDa分子质量范围内大分子化合物的特性。至于[M+Na]+附近较小的阳离子峰,则是多糖分子失去质子、羟甲基、甲氧基、水等所形成的离子峰。
除由图3可以看出GSWSP的分子质量范围信息外,还可以分析出其他信息:
1)高强度的相邻两峰间的质荷比差值(Δm/z),大多是162,推测为失去一分子水的己糖相对分子质量(162=180-18),即表明GSWSP主要由己糖构成。2)个别高强度的两相邻峰间Δm/z为158,推测可能为失去两分子水的糖醛酸相对分子质量(158=194-18×2)。3)个别高强度的两相邻峰间Δm/z为131,推测可能为失去一分子水和一个甲基的鼠李糖或岩藻糖相对分子质量(131=164-18-15),但考虑到岩藻糖主要存在于海藻及树胶中[15],因此其更可能为鼠李糖残基。4)个别高强度的相邻两峰间Δm/z为136,推测可能为失去一分子水的戊糖相对分子质量,但戊糖失去一分子水的相对分子质量应为132(132=150-18),引起这种差异的原因可能是在低质量范围内(<800 Da)DHB产生背景干扰造成[16],但其具体原因还需进一步验证。5)当高强度峰m/z为731时,推断[17]其符合通式(176×3+162)+18+23,即分子式为A3H1,以此类推得GSWSP可能具有A4H10PRha型分子式(各符号含义见表1注)。6)从表1推测的可能分子式可以看出:所有可能的分子式均含有至少3 个A(糖醛酸),说明糖醛酸稳定地存在于GSWSP中;根据可能的分子式中4 种糖的出现次数,可判断GSWSP中各糖含量为H>A>P>Rha。
综上所述:GSWSP为由己糖、糖醛酸、戊糖、鼠李糖等组成的杂多糖,其分子质量范围在731~2 615 Da,应当具有A4H10PRha型分子式(表1)。

图3GSWSP的MALDI-TOF-MS图Fig. 3 MALDI-TOF-MS spectrum of GSWSP

表1 各离子峰的归属Table 1 Assignment of all ion peaks shown
2.3.1.2 HPGPC测定的分子质量
由图2可知,GSWSP的保留时间为16.913 min,结合分子质量-保留时间标准曲线计算得GSWSP的分子质量为2 969 Da,高于MALDI-TOF-MS测定的结果(731~2 615 Da)。
MALDI-TOF-MS与HPGPC所测分子质量差异的原因可能是HPGPC法是依据对照品的分子体积获得测定结果,其准确性取决于样品与对照品结构的相似性。MALDI-TOF-MS法是采用脉冲激光使样品分子离子化获得测定结果,无需对照品,测定分子质量的确定值;但激光照射多糖分子发生电离时,能量容易向低分子质量样品转移[18],所以一般样品分子质量越大,越不易发生离子化作用,电荷强度则相对降低,即越是分子质量大的分子,其峰强度越低,以至于无法获取。因此,MALDI-TOF-MS法的分子质量测定值低于HPGPC法。
综合上述分析,GSWSP的分子质量应确定约为2 969 Da。
2.3.2 单糖组成与比例
如图4A所示,GSWSP由甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖(图4A(b)中的2、3、5、6、7和8)6 种单糖组成;进一步证实了据MAODITOF-MS所分析的GSWSP中含有鼠李糖、半乳糖醛酸(即糖醛酸)的结果;其中己糖(即包括甘露糖、葡萄糖、半乳糖)含量最高;至于MAODI-TOF-MS所分析的戊糖,为图4A所测定的阿拉伯糖。图4B显示,GSWSP由果糖和葡萄糖(图4B(b)9和10)2 种单糖组成。
由各单糖标准曲线分别计算GSWSP中各单糖含量,以葡萄糖含量为换算系数,得GSWSP的单糖组成及物质的量比为果糖∶葡萄糖∶半乳糖醛酸∶半乳糖∶甘露糖∶阿拉伯糖∶鼠李糖=81.8∶17.6∶15.6∶14.5∶6.5∶4.2∶1,其中果糖含量最高,且具有较高的半乳糖醛酸含量,说明GSWSP具有较好的水溶性、吸湿性和保湿性等理化特性,可用于食品、食品配料或添加剂、化妆品等领域。此结果与MALDI-TOF-MS得到的可能分子式A4H10PRha(表1)及各糖含量H>A>P>Rha较为一致,如上所述:其中H包括果糖、葡萄糖、半乳糖和甘露糖,A、P和Rha则分别为半乳糖醛酸、阿拉伯糖和鼠李糖。

图4 GSWSP的单糖组成与比例色谱图Fig. 4 Chromatograms showing the monosaccharide composition of GSWSP
2.3.3 构型与连接方式
2.3.3.1 NMR的结果与分析
将GSWSP的1H、13C NMR谱(图5a和图5b)结合1H-1H COSY、1H-13C HSQC NMR谱(图5c和图5d)分析,其结果如下:
1)糖残基种类[19]与GSWSP中单糖组成测定结果一致。
在1H NMR谱(图5a)δ4.3~5.9区域有5 个异头氢信号,分别为δ4.40、4.42、5.13、5.14和5.26,峰面积比为2.00∶1.87∶1.25∶1.00∶4.12,结合GSWSP单糖组成与比例分析结果及数据库对比推测得δ4.40、4.42、5.13、5.14和5.26分别对应于半乳糖醛酸、半乳糖、甘露糖、阿拉伯糖和葡萄糖的H1;在13C NMR谱(图5b)δ90~112区域有6 个异头碳信号,分析结果如表2所示,即除了上述5 种糖残基外,还含有果糖,此外,δ174.59和δ19.53分别为半乳糖醛酸和鼠李糖的C6特征信号[20],而对于无法得出鼠李糖的异头氢和异头碳信号,可能是因为其峰与其他糖残基峰发生了信号重叠或峰信号强度过低所致。即NMR糖残基种类分析结果与GSWSP中单糖组成测定结果一致。
2)糖残基的端基差向异构[21]:在1H NMR谱异头氢信号区域(δ4.3~5.9)中有3 个H1信号高于δ5.0,分别为δ5.13、5.14和5.26,表明甘露糖、阿拉伯糖和葡萄糖为α构型糖基;而果糖、半乳糖醛酸和半乳糖H1信号低于δ5.0,为β构型糖基,即GSWSP中同时存在α和β两种端基差向异构构型。
3)连接位置[20]:根据表2 NMR信号归属,对照标准单糖碳谱,果糖C1信号(δ59.74、59.94)、C2信号(δ102.65、103.13、103.28、103.44),C6信号(δ62.02、62.67)的化学位移向低场移动,因此,推测果糖残基的连接位置分别为→1)-β-D-Fruf-(2→、→1,6)-β-D-Fruf-(2→、→6)-β-D-Fruf-(2→、β-DFruf-(2→;葡萄糖C1信号(δ95.48)的化学位移向低场移动,因此推测葡萄糖残基的连接位置为α-D-Glc-(1→;半乳糖C1信号(δ102.65)的化学位移向低场移动,因此半乳糖残基的连接位置可能为β-D-Gal-(1→;对于其他糖残基,由于不能明确判断其相关峰信号,所以也无法得出具体连接位置。
GSWSP中的果糖和葡萄糖的连接位置与1-蔗果三糖型果聚糖[6]中糖残基的连接位置相似;但由于组成GSWSP的单糖种类较多,糖残基连接方式复杂,二维核磁图谱重叠严重,无法直接由二维核磁图谱推断出各糖残基间的连接位置。因此无法确定其具体糖残基连接方式,这是由杂多糖特点决定,这为选择多种糖苷酶进行水解提供依据。
4)糖环构型[20]:一般来说,呋喃糖的C3或C5在δ80~84间有信号。由图5b可以看出,仅果糖的C5信号(δ80.47、80.52、80.65)在δ80~84间,即GSWSP中的果糖为呋喃糖,这与大多数自然界中的果糖一样;而其余单糖为吡喃糖,表明GSWSP中同时存在吡喃环和呋喃环2 种糖环构型。
综上所述:GSWSP中存在→1)-β-D-Fruf-(2→、→1,6)-β-D-Fruf-(2→、→6)-β-D-Fruf-(2→、β-DFruf-(2→、α-D-Glc-(1→和β-D-Gal-(1→六种糖残基及β-DGalA、α-D-Man和α-D-Ara三种基团,且同时存在呋喃糖与吡喃糖。其中果糖残基的含量最高,与GSWSP的单糖组成与比例结果一致,表明GSWSP为典型的杂果聚糖。

图5 GSWSP的NMR图Fig. 5 NMR spectra of GSWSP

表2 GSWSP的NMR信号归属Table 2 Assignment of NMR signals of GSWSP
2.3.3.2 IR测定结果
由图6可知,3 384 cm-1为多糖羟基(O—H)特征伸缩振动峰;2 931 cm-1和1 410 cm-1分别为亚甲基(C—H)伸缩振动和剪切振动的相关峰;1 609 cm-1为羧酸根—COO-羰基(C=O)伸缩振动峰,证实了GSWSP中存在半乳糖醛酸,且可能主要是以—COO-形式存在;1 129 cm-1和1 025 cm-1是多糖中的(C—O—C,C—O—H)伸缩振动引起的;存在吡喃环醚键(—C—O—C—)非对称伸缩振动峰(934 cm-1)、呋喃环(C1—H)变角振动峰(822 cm-1)[22-25],其进一步证实了GSWSP的单糖组成有吡喃环和呋喃环2 种糖环构型,支持了13C NMR结果。

图6 GSWSP红外吸收光谱图Fig. 6 Infrared absorption spectrum of GSWSP
2.4 GSWSP的高级结构特征
2.4.1 三股螺旋结构
2.4.1.1 刚果红实验结果分析
在一定浓度的NaOH范围内,刚果红可与具有三股螺旋结构的多糖形成络合物,其最大吸收波长较刚果红发生红移现象[27]。如图7所示,当NaOH浓度为0 mol/L时,刚果红溶液的最大吸收波长为488 nm,而GSWSP刚果红溶液的最大吸收波长则红移到了495 nm,这说明GSWSP与刚果红形成了络合物,显示GSWSP具有三股螺旋结构。

图7 不同NaOH浓度下GSWSP与刚果红复合物最大吸收波长Fig. 7 Maximum absorption wavelength of GSWSP and Congo red complex under different NaOH concentrations
当NaOH浓度为0.05~0.20 mol/L时,GSWSP刚果红络合物与刚果红溶液相比最大吸收波长出现无规则变化,可能原因是GSWSP处于亚稳定区所致,即GSWSP的三股螺旋结构正经历螺旋-单链构象的转变;当NaOH浓度大于0.20 mol/L时,随着NaOH浓度的增加,GSWSP刚果红络合物溶液的最大吸收波长开始下降,与刚果红溶液变化趋势一致,说明GSWSP的三股螺旋结构在高浓度NaOH的作用下已经解体,不再与刚果红形成络合物。
2.4.1.2 圆二色谱分析
研究表明,具有三股螺旋结构多糖的圆二色谱图中会显示负科顿效应[28]。如图8所示,GSWSP在波长200 nm处具有负峰,显示了负科顿效应,说明GSWSP具有三股螺旋结构,这与刚果红实验结果一致;在波长215 nm处具有正峰,显示了正科顿效应,可能与GSWSP生色羧基基团中的C—O和O—H有关。
GSWSP的三股螺旋结构,使其可能具有一定的生物活性[29];另外,也具备了用于药物递送和控释领域的潜能[30]。

图8 GSWSP的圆二色谱图Fig. 8 Circular dichroism spectrum of GSWSP
2.4.2 结晶度
由图9可以看出,GSWSP衍射角在29.51°有明显尖峰,说明其含有粒度较大的微晶;在11.52°和19.31°时分别有一个弥散宽峰,说明其不仅存在微晶体系,还存在微晶与非晶共存、亚微晶与非晶共存的多晶体系[31],即GSWSP具有一定的结晶结构或结晶度。此结果与菊粉类果聚糖[24]的X衍射结果相似。

图9GSWSP的X-射线衍射图Fig. 9 X-ray diffraction pattern of GSWSP
2.5 GSWSP的介观结构特征
2.5.1 分子形貌
由图10可知,GSWSP的原子力显微结构呈现球形,直径约为25~111 nm,远大于单个糖链宽度(0.1~1 nm)[32],因此可说明GSWSP的原子力显微结构为糖链的聚集体,即GSWSP在水溶液中通过分子间氢键及范德华力发生了相互缠绕。

图10 GSWSP的原子力显微镜图Fig. 10 Atomic force microscopic images of GSWSP
2.5.2 表观形貌
在低倍镜下(图11a)可以看出,GSWSP由不规则和破碎的块状组成,表面有碎片;在高倍镜下(图11b)可以看出,其具有结构紧密及相对平整的表面,可能是由于GSWSP中存在的半乳糖醛酸,使分子间相互作用力增大所致。

图11 GSWSP的扫描电镜图Fig. 11 Scanning electron micrographs of GSWSP
GSWSP在介观尺度上的表观形貌与其分子形貌显示结果存在较大差异,原因如下:仪器分辨率不同:GSWSP的表观形貌为微米级,而分子形貌为纳米级;GSWSP的状态不同:表观形貌是直接观测GSWSP的粉末状构象,而分子形貌是GSWSP在水溶液中的构象。
3 结 论
本实验从蒜皮中获得GSWSP,测得其分子质量为2 969 Da,组成单糖为果糖、葡萄糖、半乳糖醛酸、半乳糖、甘露糖、阿拉伯糖和鼠李糖,其物质的量比为81.8∶17.6∶15.6∶14.5∶6.5∶4.2∶1,存在→1)-β-DFruf-(2→、→1,6)-β-D-Fruf-(2→、→6)-β-D-Fruf-(2→、β-D-Fruf-(2→、α-D-Glc-(1→和β-D-Gal-(1→六种糖残基与β-D-GalA、α-D-Man和α-D-Ara三种基团;其在溶液中具有三股螺旋高级结构,固体粉末有一定的结晶度;原子力显微镜下GSWSP呈现球形结构,扫描电镜下呈现不规则和破碎的块状结构。其结果说明GSWSP有用于食品、食品配料或添加剂、化妆品等产品的潜力。
