β-乳球蛋白对VE热稳定性的影响
2022-03-30康佳欣宁雪楠魏子凯廖敏和巨欢欢辛秋艳
李 萌,康佳欣,宁雪楠,魏子凯,廖敏和,巨欢欢,辛秋艳,刘 宁,*
(1.东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;2.黑龙江辰鹰乳业有限公司,黑龙江 嫩江 161499)
VE是一种脂溶性的微量营养素,包括α-、β-、γ-和δ-生育酚和相应三烯生育酚,具有抗氧化[1]、抗衰老[2]、促进细胞代谢[3]、促进脂肪吸收[4]、预防心血管疾病[5]、预防老年阿尔兹海默症[6]等作用。VE摄入不足会导致人体免疫力下降,代谢失常[7]。牛乳作为一种富含多种微量营养素和生物活性成分的营养食品,是提供VE的良好来源[8-9],将VE添加到牛乳中制备营养强化乳,能够提高牛乳的营养价值,满足人体对VE的需求。许多乳制品在生产过程中需要经过超高温灭菌(ultra-high temperature instantaneous sterilization,UHT)等热处理,这导致乳中的VE发生热降解[10-12],因此,需要寻找一种载体保护乳中的VE免受热处理的影响。
已有研究表明β-乳球蛋白(β-lactoglobulin,β-LG)可作为维生素的载体。Futterman等[13]在1972年首次提出β-LG可与VA结合,结合位点位于β-LG花萼形状的疏水孔内,当VA近于疏水孔底部时,通过氢键和疏水相互作用形成复合物[14]。Mensi等[15]也证实了VA在β-LG疏水孔内结合,与类胡萝卜素的结合位点不同。β-LG可以与其他的脂溶性维生素结合,如VD3[16]和VK[17];也可与一些水溶性的维生素结合,如VB12[18]、叶酸和抗坏血酸[17],β-LG与叶酸结合后可延缓叶酸的光降解[19]。以上研究表明β-LG作为维生素的载体可靠,因此可以用β-LG作为VE的保护载体。
生物膜干涉技术是一种分析分子之间是否存在结合以及结合程度的技术,具有分辨率高、速度快、结果精准等优点[19-21]。它将生物分子固定在光纤生物传感器的底端形成一层生物膜,当一束可见光穿过生物膜时,在传感器底端光学膜层的两个界面会形成两束反射光谱,叠加形成一束干涉光谱,分析物与生物分子通过相互作用结合后会导致传感器底端生物膜厚度发生变化,干涉光谱发生相对位移,若两个分子之间发生相对位移则证明两者之间存在结合[22]。生物膜干涉技术通过传感器的连续上机检测联合结合速率Ka与解离速率Kd计算得到亲和力常数KD,KD值越小则说明分子之间结合程度越高,由此直接判断分子之间的结合程度[23]。目前,生物膜干涉技术广泛用于分析蛋白与蛋白、蛋白与核酸、蛋白与脂质之间的相互作用[24],但在β-LG与维生素之间相互作用的研究鲜见报道。
本研究以β-LG和VE为材料制备复合物。采用浊度、粒径、Zeta电位、扫描电子显微镜、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、红外光谱和荧光光谱分析β-LG与VE结合情况;利用生物膜干涉技术获得β-LG与VE之间的亲和力常数,以确定两者之间的结合程度;使用高效液相色谱法分析普通强化乳(添加VE)和复合物强化乳(添加β-LG/VE复合物)中VE的热损失率,探究β-LG对VE热稳定性的影响,以期为用于维生素强化乳制品中提供理论基础。
1 材料与方法
1.1 材料与试剂
VE(纯度>97%) 上海阿拉丁生化科技股份有限公司;β-LG(纯度90%) 上海源叶生物科技有限公司;生牛乳样品 哈尔滨市宏有牧业有限责任公司。
氢氧化钠、盐酸、氢氧化钾、2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)、抗坏血酸、磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L、pH 7.4)、无水乙醇、乙醚、无水硫酸钠、二甲基亚砜(dimethyl sulfoxide,DMSO)(均为分析纯) 上海源叶生物科技有限公司;甲醇(色谱纯) 德国CNW公司;SDS-PAGE凝胶配制试剂盒 上海碧云天生物技术有限公司;生物素化试剂EN-Link NHSPEG12-Biotin(21312)、Zeba脱盐离心柱(89889)美国Thermo Fisher公司;SA链霉亲和素传感器 美国ForteBio公司;吐温-20 广州赛国生物科技有限责任公司。
1.2 仪器与设备
BSA124S-CW分析天平、pH计 德国Sartorius公司;恒温磁力搅拌器 上海梅颖浦仪器仪表制造有限公司;SCIENTZ-18ND冷冻干燥机 宁波新芝冻干设备股份有限公司;U3000高效液相色谱仪、Nicolet iS50傅里叶变换红外光谱仪 美国Thermo Fisher公司;UV-2600/2700紫外分光光度计 日本岛津公司;Mastersizer 2000激光粒度仪 英国马尔文仪器有限公司;TM 3000扫描电子显微镜 日本日立公司;DYY-10C电泳仪 北京六一生物科技有限公司;RF-5301PC荧光分光光度计 日本Island Ferry公司;Octet RED96分子互作分析系统 美谷分子仪器(上海)有限公司。
1.3 方法
1.3.1β-LG/VE复合物的制备
用蒸馏水制备0.5 mg/mL的β-LG溶液,室温搅拌2 h,4 ℃过夜保存直至完全溶解,用1 mol/L NaOH或1 mol/L HCl溶液调节pH值至7.0,待用。将VE溶于无水乙醇中,制备4 种不同质量浓度的VE溶液(5、10、20、40 mg/mL)。将β-LG溶液与VE溶液按质量比95∶5均匀混合,制备4 种VE质量浓度的复合物,室温搅拌2 h,直至反应完全。用冷冻干燥机(-50 ℃、10 Pa)进行冻干,4 ℃密闭容器保存。
1.3.2β-LG/VE复合物中VE含量的测定
参照GB 5009.82—2016 《食品中维生素A、D、E的测定》中反相高效液相色谱法测定VE的含量[25]。称取0.001 0 g样品于150 mL锥形瓶中加20 mL水混匀,再加入1.0 g抗坏血酸和0.1 g BHT,混匀后加入30 mL无水乙醇和15 mL氢氧化钾溶液(质量分数50%),边加边振摇,于80 ℃恒温水浴振荡皂化30 min,皂化后立即冷却至室温。将皂化液转移至分液漏斗中,用石油醚-乙醚混合液(1∶1,V/V)振荡萃取。将醚层经无水硫酸钠滤入250 mL旋转蒸发瓶中,于40 ℃水浴中蒸馏,待醚液剩约2 mL时,取下蒸发瓶,立即用氮气吹干。用甲醇溶解瓶中残留物并转移至10 mL容量瓶中,定容。溶液过0.22 μm有机系滤膜,待测。
高效液相色谱条件:色谱柱为C30柱(250 mm×4.6 mm,3 μm);柱温20 ℃;流动相:A为水,B为甲醇,洗脱梯度见表1;流速0.8 mL/min;波长294 nm;进样量10 μL。

表1 洗脱梯度条件Table 1 Gradient elution conditions
1.3.3 浊度的测定
准确称取一定量的VE和4 种VE质量浓度下β-LG/VE复合物,分别溶解在10 mL PBS中,用来制备VE溶液和β-LG/VE复合物溶液,具体添加量见表2。每列中VE添加量与对应复合物所含VE的量相同(复合物所含VE的量为1.3.2节中的测定含量),以保证VE溶液与复合物溶液中的VE含量相同。使用紫外分光光度计在500 nm波长处测定4 种VE溶液和4 种复合物溶液的吸光度,用PBS作为空白,测定温度为25 ℃,每个样本测量3 次。浊度计算公式如下:

式中:T为浊度;A为吸光度。

表2 浊度测定液中VE及其复合物的添加量Table 2 Concentrations of VE and its complex in turbidity measurement solution
1.3.4 粒径和Zeta电位的测定
VE溶液和β-LG/VE复合物溶液的制备方法同1.3.3节。使用Mastersizer 2000激光粒度仪测定4 种VE溶液和4 种复合物溶液的平均粒径和Zeta电位,折光率为1.33,在25 ℃条件下,每个样品测量3 次。
1.3.5 扫描电子显微镜
使用扫描电子显微镜观察β-LG和40 mg/mL VE质量浓度制备的复合物微观结构。将样品喷一层20 nm厚的金粉,在电压5 kV和放大倍数500 倍条件下观察样品。
1.3.6 SDS-PAGE分析
使用SDS-PAGE法检测β-LG和4 种VE质量浓度下β-LG/VE复合物的分子质量。制备蛋白质量浓度为1 mg/mL的β-LG和4 种β-LG/VE复合物溶液,与上样缓冲液混合,煮沸5 min,待用。按照SDS-PAGE凝胶配制试剂盒的方法制备15%分离胶和5%浓缩胶。上样体积为10 μL,电压为80 V,待样品进入分离浓缩胶后,将电压调整为120 V。
1.3.7 红外光谱分析
使用傅里叶变换红外光谱仪对β-LG和4 种VE质量浓度下β-LG/VE复合物进行测定。将1 mg样品与150 mg溴化钾粉末混合后压片,扫描范围为4 000~400 cm-1。
1.3.8 荧光光谱分析
用PBS制备蛋白质量浓度为0.2 mg/mL的β-LG和4 种VE质量浓度下β-LG/VE复合物溶液。使用荧光分光光度计测β-LG和4 种β-LG/VE复合物的荧光强度,狭缝宽度为10 nm,扫描波长在300~500 nm之间,激发波长为280 nm。
1.3.9 生物膜干涉技术
1.3.9.1 固化物和分析物的制备
将1 mg EN-Link NHS-PEG12生物素化试剂溶于0.106 mL DMSO中,制备浓度为10 mmol/L的生物素化试剂母液。将500 μL 500 μg/mL的β-LG原液(0.01 mol/L PBS)与10 μL生物素化试剂母液混合。在25 ℃条件下,反应混合物孵育30 min后,使用Zeba脱盐离心柱将进行离心脱盐处理以去除未反应的生物素(1 000×g离心2 min),收集离心后的蛋白作为固化物,待用。样品PBST(0.01 mol/L PBS+0.02%吐温-20)作为分析物稀释液。将40 mg VE溶于1 mL PBST中制备分析物(40 mg/mL),随后进行梯度稀释为5、10、20、40 mg/mL,待用。
1.3.9.2 上机实验
将SA链霉亲和素传感器在PBS中预湿至少10 min。第1步,传感器在PBS中平衡60 s;第2步,传感器与固化物结合300 s;第3步,传感器在PBST中平衡120 s;第4步,传感器转入分析物中,使固化物与分析物结合60 s;第5步,传感器转入PBST中解离60 s。根据上机测量出的结合速率常数和解离速率常数计算亲和力常数,计算公式如下:

式中:KD为亲和力常数/(mol/L);Ka为结合速率常数/(L/(mol·s));Kd为解离速率常数/s-1。
1.3.10 普通强化乳和复合物强化乳的制备
根据中国居民膳食营养素每日参考摄入量,制备的普通强化乳中加入VE(8 mg/100 g),制备的复合物强化乳中加入40 mg/mL VE质量浓度下β-LG/VE复合物,使得复合物强化乳中VE含量为8 mg/100 g。UHT处理条件为138 ℃、5 s,经过无菌灌装加工后,室温保存。
1.3.11 VE损失率计算
普通强化乳和复合物强化乳中VE含量的参照1.3.2节中VE的测定方法,并计算VE在UHT前后的损失率,计算公式如下:

式中:C1为UHT处理前VE含量/(mg/100 g);C2为UHT处理后VE含量/(mg/100 g)。
1.4 数据处理
使用IBM SPSS Statistics 25软件对数据进行ANOVA差异显著性分析,所有数据以表示。使用Origin 2018软件作图。在生物膜干涉实验中,原始数据采用Octet数据分析软件(Version 6.4, ForteBio)分析。
2 结果与分析
2.1 β-LG/VE复合物中VE含量的测定
通过高效液相色谱法测定4 种VE质量浓度下β-LG/VE复合物中VE含量,见表3。当VE质量浓度为5、10、20 mg/mL和40 mg/mL时,对应复合物中VE含量分别为(29.54±1.03)、(42.93±2.14)、(59.02±2.85)mg/100 mg和(72.18±4.07)mg/100 mg。当VE质量浓度为40 mg/mL时,对应复合物中VE的含量最高,因此将40 mg/mL VE质量浓度的复合物添加到复合物强化乳中。

表3 4 种VE质量浓度下β-LG/VE复合物中VE含量Table 3 VE contents in β-LG/VE complexes prepared with four concentrations of VE
2.2 浊度的测定
浊度是评价脂溶性物质溶解度的重要指标,样品的浊度越高,溶解度越低。如图1所示,随着VE质量浓度的增加,4 种质量浓度下VE和β-LG/VE复合物的浊度逐渐升高。在同一质量浓度水平,β-LG/VE复合物的浊度低于VE的浊度。这是由于VE是脂溶性的,在水环境中会发生聚集导致浊度增加[26]。当β-LG与VE结合后,可以减少暴露在水溶液中VE的数量,减少VE的自我聚集,形成更多亲水性的复合物,使浊度降低[16,27]。因此,可以证明β-LG与VE存在结合,结合后增加了VE在水溶液中的溶解度。

图1 4 种质量浓度下VE和β-LG/VE复合物的浊度Fig. 1 Turbidity of free VE and β-LG/VE complexes prepared with four concentrations of VE
2.3 粒径和Zeta电位的测定
4 种质量浓度下VE和β-LG/VE复合物的粒径测定见图2A,随着VE质量浓度增加,VE和β-LG/VE复合物的粒径逐渐升高,这说明VE质量浓度越高,VE在水中聚集程度越高,粒径越大[16]。在同一质量浓度下,β-LG/VE复合物的粒径高于β-LG的粒径,说明β-LG与VE存在相互作用,使复合物尺寸变大;β-LG/VE复合物的粒径低于VE的粒径,进一步证明β-LG与VE之间存在结合,结合后使暴露在水中的VE数量减少,VE聚集程度降低,粒径减小。Haham等[26]测定VD3和酪蛋白胶束/VD3纳米复合物的粒径,结果表明纳米复合物的粒径低于VD3的粒径,与本研究结果一致。
4 种质量浓度下VE和β-LG/VE复合物的Zeta电位,如图2B所示。随着VE质量浓度增加,VE和β-LG/VE复合物的Zeta电位几乎保持不变。在同一VE质量浓度时,β-LG的电位高于VE和β-LG/VE复合物的电位,这三者的电位都是负值。据报道,VE不带电荷,VE的负电位可能是由于脂溶性维生素在水溶液中形成较大的纳米聚集体,聚集体表面会迅速吸收水中的羟基离子,呈现负电位[16]。

图2 4 种质量浓度下VE和β-LG/VE复合物的粒径(A)和Zeta电位(B)Fig. 2 Particle sizes (A) and zeta potentials (B) of free VE and β-LG/VE complexes prepared with four VE concentrations
2.4 扫描电子显微镜结构表征
由图3可见,β-LG和β-LG/VE复合物的表面结构呈片状,这是由于在冷冻干燥过程中,水从溶液中蒸发,分子之间的作用力更容易导致溶质聚集[28]。β-LG呈现光滑的片状结构,而β-LG/VE的微观结构呈微突起的片状结构,这可能是由于VE附着在β-LG表面形成了VE聚集物[29]。

图3 β-LG(A)和40 mg/mL VE质量浓度下β-LG/VE复合物(B)的微观结构Fig. 3 Microstructure of β-LG (A) and β-LG/VE complex prepared with 40 mg/mL VE (B)
2.5 SDS-PAGE分析结果

图4 β-LG和4 种VE质量浓度下β-LG/VE复合物的SDS-PAGE结果Fig. 4 Electrophoresis patterns of β-LG and β-LG/VE complexes prepared with four VE concentrations
通过SDS-PAGE分析β-LG与VE发生共价结合情况[30]。从图4可以看出,β-LG的分子质量约为18.3 kDa,4 种VE质量浓度下β-LG/VE复合物的分子迁移率与β-LG迁移率基本一致,这说明β-LG与VE结合后,β-LG的分子质量没有变化,结合过程中没有破坏β-LG的二硫键,属于非共价结合。
2.6 红外光谱分析
用红外光谱分析与VE结合后的β-LG的二级结构变化,如图5所示。在β-LG光谱中,氢键的峰值在3 292.38 cm-1,是氢键的—OH基团的伸缩振动吸收峰[31]。添加VE后,4 种VE质量浓度下β-LG/VE复合物的氢键峰向左移动,分别为3 292.82、3 293.34、3 294.30 cm-1和3 295.26 cm-1,说明氢键是β-LG与VE之间的重要作用力之一。在β-LG/VE复合物光谱中,酰胺I带(1 650~1 600 cm-1)和酰胺II带(1 550~1 500 cm-1)峰的位置也发生移动,表明β-LG通过疏水相互作用与VE结合[32]。与VE结合后,β-LG的α-螺旋、β-折叠、β-转角和无规卷曲的相对含量均未发生显著变化(表4),说明与VE结合后,β-LG的二级结构未受影响。Swain等[12]研究与VB12结合后β-LG的蛋白二级结构变化,结果表明β-LG的蛋白二级结构没有改变,与本研究结果一致。总的来说,β-LG可通过氢键和疏水作用与VE结合形成复合物,但蛋白二级结构不受影响。

图5 β-LG和4 种VE质量浓度下β-LG/VE复合物的红外光谱Fig. 5 Infrared spectra of β-LG and β-LG/VE complexes prepared with four VE concentrations

表4 β-LG和4 种VE质量浓度下β-LG/VE复合物的二级结构相对含量Table 4 Secondary structure contents of β-LG and β-LG/VE complexes prepared with four VE concentrations
2.7 荧光光谱分析结果
使用荧光光谱分析与VE结合后的β-LG的三级结构变化。如图6所示,蛋白的内在荧光是由280 nm波长处的酪氨酸(Tyr)和色氨酸(Trp)残基激发引起的[16]。通过对β-LG和4 种VE质量浓度下β-LG/VE复合物的荧光光谱分析发现,在332 nm波长处,β-LG的荧光强度最大,依次为5、10、20、40 mg/mL VE质量浓度下的复合物,这说明与VE结合增加了β-LG的荧光猝灭程度。荧光强度降低的主要原因是VE作为猝灭剂使得β-LG中Tyr和Trp的荧光猝灭。4 种VE质量浓度下β-LG/VE复合物的最大荧光强度始终保持在332 nm波长处,说明VE是与β-LG相互作用的小分子猝灭剂,与VE结合只是减少β-LG中荧光基团的数量,对β-LG的三级结构没有影响。Swain等[12]通过荧光光谱分析与VB12结合后β-LG的三级结构变化,结果表明β-LG的三级结构不受VB12的影响,与本研究结果一致。
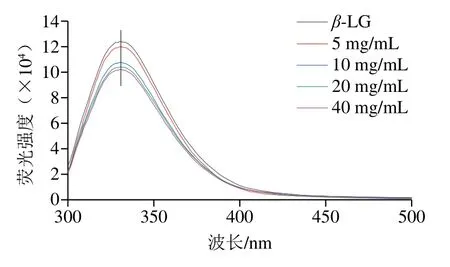
图6 β-LG和4 种VE质量浓度下β-LG/VE复合物的荧光光谱Fig. 6 Fluorescence spectra of β-LG and β-LG/VE complexes prepared with four VE concentrations
2.8 生物膜干涉技术检测结果
生物膜干涉技术包括5 个步骤:平衡1(PBS)、固化(β-LG)、平衡2(PBST)、结合(VE)和解离(PBST)。在固化步骤,SA传感器捕捉蛋白中的生物素标签使得蛋白固定在传感器上。随后将带有蛋白的SA传感器与4 种不同质量浓度的VE结合,在PBST中解离结合在β-LG上的VE完成解离过程。图7为β-LG和VE的结合解离拟合曲线(R2=0.99),可以观察到明显的结合信号,随着VE质量浓度的升高,结合信号逐渐增强,最高达到0.065 nm;在解离过程中,结合信号降低。通过数据分析软件得到结合速率常数为1.17 L/(mol•s),解离速率常数8.766×10-2s-1,计算的β-LG和VE的亲和力常数为7.493×10-2mol/L。已有研究表明在生物膜干涉技术中能够得到亲和力常数就可以证明两个分子之间存在结合,张英等[23]采用生物膜干涉技术研究花生蛋白与花生蛋白过敏患者血清IgE的相互作用,结果表明这两者之间亲和力常数为5.5×10-5mol/L,可以证明两者之间存在结合;Shang Jiaqi等[33]通过生物膜干涉技术研究乳清分离蛋白与金针菇多糖之间的相互作用,结果表明这两者之间亲和力常数为1.736×10-4mol/L,可以证明两者之间存在结合。由此得出β-LG和VE之间存在结合。
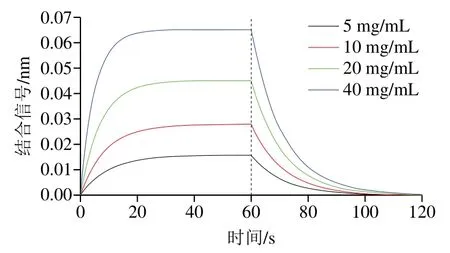
图7 4 种VE质量浓度下β-LG/VE复合物的结合解离拟合曲线Fig. 7 Fitting curves of association and dissociation of β-LG/VE complexes prepared with four VE concentrations
2.9 VE损失率计算
表5为普通强化乳和复合物强化乳中VE含量,可以看出热处理后VE含量均显著降低(P<0.05),这是由于高温条件下VE对热不稳定,导致VE降解,还可以观察到复合物强化乳中VE损失率(4.01±0.18)%显著低于普通强化乳中VE损失率(10.90±0.17)%(P<0.05),这说明β-LG与VE结合后可以保护VE免受热降解。因此,β-LG可有效改善VE的热稳定性。Saiz-Abajo等[34]研究在食品加工过程中酪蛋白对β-胡萝卜素的保护情况,结果表明酪蛋白可以降低β-胡萝卜素的降解程度。Gupta等[35]研究表明酪蛋白可有效提高VA的稳定性。Relkin等[36]研究,结果表明在储存过程中乳清蛋白具有保护α-生育酚的作用。综上所述,之前的研究已经表明乳蛋白可以作为维生素的保护载体,这与本研究的结果一致。

表5 普通强化乳和复合物强化乳中VE含量和损失率Table 5 VE contents and loss rates in common fortified milk and complex fortified milk
3 结 论
本研究以β-LG和VE为材料制备β-LG/VE复合物,通过浊度、粒径、Zeta电位、扫描电子显微镜、SDS-PAGE、红外光谱和荧光光谱分析证明β-LG与VE之间通过氢键和疏水相互作用结合,结合后提高VE在水溶液中的溶解性,不改变蛋白的结构。生物膜干涉技术进一步证明β-LG与VE之间存在结合,亲和力常数为7.493×10-2mol/L,因此,生物膜干涉技术可用于分析β-LG和VE之间的结合程度。将β-LG/VE复合物添加到乳中制备复合物强化乳可有效的降低VE在加工过程中的损失,为维生素的综合利用提供理论基础。
