精氨酸对杂交鳢生长性能、体组成、血浆生化指标及抗氧化能力的影响
2022-03-30李培佳陈晓瑛赵红霞曹俊明
李培佳 陈晓瑛 赵红霞* 曹俊明 陈 冰 彭 凯 黄 文,3 郭 慧
(1.广东海洋大学水产学院,湛江524088;2.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广州510640;3.广州飞禧特生物科技有限公司,广州510640)

杂交鳢,又称杂交乌斑鳢,是乌鳢(ChannaArgus)和斑鳢(Channamaculata)的杂交鳢新品种。杂交鳢通常生活在低洼、池塘、沼泽中,对水温适应强,耐低氧,杂交子1代具有双亲的优势,生长速度快,生长速度较乌鳢快20%,较斑鳢快50%,不仅能够缩短养殖周期,易驯食人工配合饲料,而且抗病能力强、个体大、肉质好,具有去淤生新、生肌补血等优点。特别在珠三角地区,杂交鳢已取代乌鳢、斑鳢,成为鳢科鱼类主要养殖品种,其中乌斑杂交鳢在池塘养殖过程中杂交性状优势较为显著,深受珠三角养殖户的欢迎。目前,精氨酸最适需要量在建鲤(CyprinuscarpiovarJian)[11]、军曹鱼(Rachycentroncanadum)[12]等多种鱼类上已有研究报道,但尚未见到杂交鳢的精氨酸需要量方面研究。因此,本试验拟通过评估精氨酸对杂交鳢生长性能、鱼体成分含量、血浆生化指标及抗氧化能力的影响,以期为精氨酸在杂交鳢人工配合饲料生产实践中的应用提供理论依据。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕、玉米蛋白粉、高筋面粉为主要原料,以大豆油、鱼油、磷脂油为脂肪源,配制精氨酸水平分别为2.31%、2.42%、2.72%、2.92%、3.12%的5种试验饲料,分别记作G1、G2、G3、G4、G5。饲料精氨酸采用L-精氨酸,菱形晶体精氨酸,纯度≥98%,购自某生物科技有限公司。精氨酸含量采用GB/T 18246—2019法测定。维生素及矿物质预混料添加量按照乌鳢营养需求量进行添加[13]。饲料原料称量前过60目筛粉碎饲料原料,按照饲料配方称量各原料,经混匀后加入鱼油、豆油、磷脂油和水混匀,充分混匀后,采用小型膨化机制成颗粒状膨化饲料(华强膨化机械T52型膨化机),55 ℃烘干后置于-20 ℃冰箱备用。试验饲料组成及营养水平见表1,饲料氨基酸组成见表2。

表1 试验饲料组成及营养水平(干物质基础)
1.2 试验设计及饲养管理
养殖试验在广东省农业科学院动物科学研究所白云实验基地进行。杂交鳢鱼苗购自广州市锦龙渔业有限公司。鱼苗运回后放入暂养池塘网箱(2.5 m×2.5 m×1.5 m)中进行暂养,暂养期间每天饱食投喂基础饲料2次,暂养1周后正式养殖试验。杂交鳢饥饿24 h,随机挑选750尾体格健壮,平均初始体重为(22.02±0.02) g的杂交鳢鱼苗,置于15个网箱(1.5 m×1.5 m×1.5 m)中,网箱高出水面20 cm,有效水体体积293 L。试验分成5组,每组3个重复(网箱),每个网箱50尾鱼,分别投喂5种试验饲料,持续饲养8周。每天定时投食2次,分别为08:00和16:00,表观饱食投喂,并根据鱼体生长、摄食情况和水温等环境条件及时调整投喂量,每天记录鱼摄食及死亡情况。试验期间水温为25~32 ℃,pH 8.0左右,溶氧浓度8 mg/L左右,氨氮浓度小于0.1 mg/L。
1.3 指标测定
1.3.1 生长性能测定
存活率(survival rate,SR)=100×
终末尾数/初始尾数;
WGR=100×(终末体重-初始体重)/初始体重;
饲料系数(feed coefficient rate,FCR)=摄食
饲料总重/(终末体重-初始体重);
蛋白质沉积率(protein productive value,PPV)=100×
(终末体重×终末鱼体蛋白质含量-初始体重×
初始鱼体蛋白质含量)/(饲料摄入量×
饲料蛋白质含量);
特定生长率(specific growth rate,SGR)=
100×(ln终末体重-ln初始体重)/养殖时间;
肥满度(condition factor,CF)=100×体重/体长3;
肝体比(hepatopancreas somatic indices,HSI)=
100×肝脏重/体重;
脏体比(viscera somatic indices,VSI)=100×
内脏重/体重。
1.3.2 鱼体成分测定
养殖试验结束后进行样品采集,首先将试验鱼禁食24 h,依次对每个网箱进行计数和称重。随后每个网箱随机选取3尾鱼置于-20 ℃保存,用于检测全鱼体成分。采用GB/T 6435—2014法测定鱼体水分含量,GB/T 6432—2018法测定鱼体粗蛋白质含量,GB/T 6438—2007法测定鱼体粗灰分含量,GB/T 6433—2006法测定鱼体粗脂肪含量,GB/T 18246—2019法测定鱼体氨基酸含量。
1.3.3 血浆生化指标测定
养殖试验结束后,杂交鳢停止摄食24 h,每个网箱随机取8尾鱼,采用MS-222溶液(120 mg/L)麻醉处理,尾静脉采血法,采用肝素钠抗凝管采集血液,4 000 r/min离心10 min,制备血浆,于-78 ℃冰箱保存备用。血浆生化指标在广州金域医学公司采用全自动化分析仪(贝克曼ProCX4,德国)测定。各指标测定方法如下:采用双缩脲法测定TP含量,酶偶联速率法测定尿素氮(urea nitrogen,UN)含量,速率法测定ALT、AST活性,采用酶法测定葡萄糖(glucose,GLU)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)含量。
1.3.4 血浆抗氧化能力测定
采用南京建成生物工程研究所试剂盒,测定血浆SOD、GSH-Px活性,总抗氧化能力(total antioxidant capacity,T-AOC)及MDA含量,测定步骤和计算公式等参考试剂盒说明书。
1.4 数据统计与分析
试验数据采用SPSS 20.0统计软件的ANOVA过程进行单因素方差分析,而后采用Duncan氏法进行多重比较,所有的试验结果均以平均值±标准差(mean±SD)表示,P<0.05表示差异显著。
2 结果与分析
2.1 饲料中精氨酸水平对杂交鳢生长性能的影响
由表3可见,随着饲料精氨酸水平的增加,杂交鳢WGR呈现先升高后降低的趋势,G4组显著高于G1、G2、G3、G5组(P<0.05);杂交鳢SGR呈现先升高后降低的趋势,G4组显著高于G1、G2、G3、G5组(P<0.05);杂交鳢FCR呈现先降低后升高的趋势,并在G4组达到最小值,显著低于G1、G2、G3、G5组(P<0.05);杂交鳢PPV呈现先升高后下降的趋势,在G4组最高,显著高于G1、G2、G3组(P<0.05);杂交鳢HSI呈现下降趋势,G4组显著低于G1和G2组(P<0.05)。杂交鳢SR、CF、VSI趋势变化不明显,各组之间无显著差异(P>0.05)。
由图1、图2、图3可知,在本试验条件下以杂交鳢SGR、PPV、WGR指标为判定依据,通过折线模型,杂交鳢幼鱼饲料精氨酸最适水平分别为2.91%、2.98%、2.95%。

图1 特定生长率为指标的折线模型
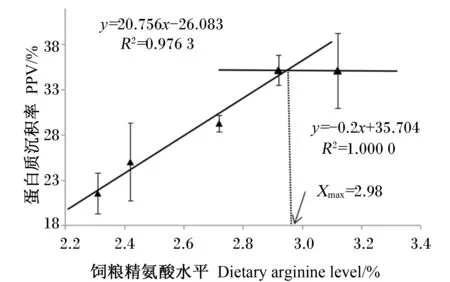
图2 蛋白质沉积率为指标的折线模型

图3 增重率为指标的折线模型
2.2 饲料中精氨酸水平对杂交鳢体成分和氨基酸成分的影响
由表4可知,杂交鳢各组之间全鱼的水分含量无显著差异(P>0.05);杂交鳢全鱼粗蛋白质含量各组间呈现先上升后下降的趋势,G4组达到显著水平(P<0.05),杂交鳢全鱼粗脂肪含量呈现下降趋势,但各组间无显著差异(P>0.05);杂交鳢鱼体粗灰分含量呈现升高趋势,并在G4组达到显著水平(P<0.05)。

表4 饲料中精氨酸水平对杂交鳢体成分的影响
由表5可知,必需氨基酸组成方面,杂交鳢全鱼精氨酸含量呈现先升高后下降的趋势,并在G4组达到显著水平(P<0.05);亮氨酸含量在G3组达到最高,与其他各组差异显著(P<0.05);蛋氨酸含量呈现先升高后降低趋势,G3组显著高于G5组(P<0.05);缬氨酸含量呈现先升高后下降趋势,G3组显著高于G1、G2和G5组(P<0.05)。非必需氨基酸方面,丙氨酸、甘氨酸、天冬氨酸含量均呈现先升高后降低的趋势,均在G3组达到最高值,显著高于G5组(P<0.05);其余氨基酸含量在G3组均高于其他各组,但无显著差异(P>0.05)。
2.3 饲料中精氨酸水平对杂交鳢血浆生化指标的影响
由表5可知,饲料中添加精氨酸对杂交鳢血浆生化指标均无显著影响(P>0.05)。随饲料精氨酸水平的上升,杂交鳢血浆中的TP含量呈现升高趋势,并在G4组达到最大值;血浆GLU含量呈现下降趋势,并且在G4组达到最小值。随饲料精氨酸水平的上升,杂交鳢血浆AST、ALT活性呈现先升高后下降趋势。

表5 饲料中精氨酸水平对杂交鳢鱼体氨基酸成分的影响(干物质基础)

表6 饲料中精氨酸水平对杂交鳢血浆生化指标的影响

续表6项目 Items组别 GroupsG1G2G3G4G5谷草转氨酶 AST/(U/L)75.33±2.0891.33±12.0186.33±15.5787.33±9.0779.33±15.53谷丙转氨酶 ALT/(U/L)5.33±3.066.33±2.087.33±1.154.00±2.654.33±0.58总胆固醇 TC/(mmol/L)2.74±0.112.58±0.092.90±0.392.72±0.122.71±0.19
2.4 饲料中精氨酸水平对杂交鳢血浆抗氧化能力的影响
由表7可知,随饲料精氨酸水平的上升,血浆SOD活性呈现先升高后下降趋势,并在G3组达到最大值,显著高于其他组(P<0.05);G5组血浆GSH-Px活性显著高于G2组(P<0.05),G4和G5组血浆T-AOC显著高于G1组(P<0.05),G5组血浆MDA含量显著低于G1和G2组(P<0.05)。

表7 饲料中精氨酸水平对杂交鳢血浆抗氧化能力的影响
3 讨 论
3.1 精氨酸对杂交鳢生长性能和体成分的影响
在本试验中,随着饲料精氨酸水平的上升,杂交鳢WGR、SGR、PPV显著升高,FCR显著下降,当饲料精氨酸水平为2.92%,FCR达到最低值,这一结果在印度鲤鱼上也得到证明[6]。在本试验条件下以杂交鳢SGR、WGR、PPV指标为判定依据,通过折线模型,进行综合分析表明,杂交鳢幼鱼饲料精氨酸最适水平分别为2.91%、2.95%、2.98%(饲料粗蛋白质含量分别为6.63%、6.65%、6.72%)。杂交鳢的精氨酸需要量与军曹鱼(2.38%)[12]、黄颡鱼(2.38%~2.74%)[14]、乌鳢(2.65%)[15]相似,低于建鲤(4.3%)[11]、斑点叉尾(4.3%)[16]。鱼体精氨酸适宜需求量受饲料配比、饲喂方式等多种因素制约,不同鱼类精氨酸适宜需要量有待研究。
在本试验中,随饲料精氨酸水平的添加,杂交鳢全鱼水分含量未产生显著变化,但是全鱼粗蛋白质含量显著升高,在G4组达到最大值,与其他各组差异显著。当精氨酸水平为1.76%时,军曹鱼鱼体粗蛋白质含量最低,当精氨酸水平为2.96%时,鱼体粗蛋白质含量最高,当精氨酸水平超出2.96%时则粗蛋白质含量显著下降,同时这在石斑鱼幼鱼(Epinephelusspp)上也得到证明[9,17]。研究表明,机体精氨酸在代谢过程中通过内分泌信号调节腺苷酸活化蛋白激酶(AMPK),抑制机体内脂肪酸和类固醇的合成,影响其合成过程,降低粗脂肪含量[18],在本试验中,粗脂肪含量呈现下降趋势,这与黑鲷[19]研究结果一致,当饲料精氨酸水平为1.5%~2.5%,与黑鲷鱼体粗脂肪含量呈负相关。随精氨酸水平的上升,杂交鳢全鱼粗灰分含量各组出现升高趋势,当饲料精氨酸水平为2.92%时,鱼体粗灰分含量达到显著峰值,这与团头鲂(Megalobramaamblycephala)[20]研究结果相一致,具体影响机理还需进一步研究。
动物机体内精氨酸与赖氨酸拮抗作用普遍存在,精氨酸与赖氨酸在肠道吸收过程中,利用同一种转运载体进行转运吸收,因此在代谢过程中存在拮抗现象[2]。鱼类体内精氨酸与赖氨酸是否存在拮抗仍有争议,研究发现在牙鲆[21]上并未出现明显拮抗作用,但在大西洋鲑(Salmosalar)[22]体内精氨酸与赖氨酸产生拮抗作用。本试验条件下,全鱼精氨酸含量呈现先升高后降低的趋势,当饲料精氨酸水平为2.92%时,杂交鳢鱼体精氨酸含量达到最大值,但未见精氨酸与赖氨酸之间产生相互拮抗影响。有报道指出,饲料中添加精氨酸可显著提高黑鲷幼鱼亮氨酸、异亮氨酸、精氨酸、谷氨酸、丙氨酸、丝氨酸含量[19]。在本试验条件下,随精氨酸水平的上升,对杂交鳢鱼全鱼精氨酸、亮氨酸、蛋氨酸、缬氨酸、丙氨酸、甘氨酸、天冬氨酸含量产生显著影响,表明在杂交鳢饲料中添加精氨酸可显著提高全鱼氨基酸含量。因此,在杂交鳢饲料中适量添加精氨酸能够提高其生长性能、降低饲料系数、促进蛋白质和氨基酸沉积。
3.2 精氨酸对杂交鳢血浆生化指标的影响
血浆生化指标可以反映鱼体代谢、健康、营养状况及对环境的适应性[23]。血浆TP起维持血管正常渗透压、酸碱度作用,间接反映机体消化能力[24]。本试验条件下,血浆TP含量呈现升高的趋势,并在G4组取得较高值,这与杂交鳢全鱼粗蛋白质含量升高结果一致,表明饲料添加适量精氨酸能够促进机体蛋白质生成。血脂含量关联鱼类机体新陈代谢,TG含量变化反映了肝脏代谢脂肪的状况。本试验结果表明,杂交鳢血浆TG、TC含量未出现显著变化,表明精氨酸对鱼体脂肪代谢没有显著影响,这与斜带石斑鱼幼鱼[17]的研究结果一致。AST、ALT活性作为评价细胞损伤指标,正常情况下活性较低,细胞病变或者通透性增加导致转氨酶活性的增加。本试验中,杂交鳢血浆AST、ALT活性呈现先升高后下降趋势,当精氨酸水平为2.92%时,AST、ALT活性达到最低。这与凡纳滨对虾、黑鲷[7-8]研究结果一致,表明饲料中添加适量精氨酸对鱼类细胞具有保护作用。血浆UN含量反映鱼体蛋白质和氨基酸代谢的平衡状态,当摄食氨基酸不平衡或者氨基酸缺乏的饲料后,会造成机体氨基酸代谢平衡紊乱,血浆UN含量随之上升[21,25]。在本试验中,血浆UN含量在G3组略低于其他组,表明精氨酸的缺乏或过量会导致杂交鳢血浆UN含量升高,进而反映鱼体氨基酸代谢平衡紊乱。
3.3 精氨酸对杂交鳢血浆抗氧化能力的影响
鱼类的有氧状态易产生活性氧(ROS),从而导致血细胞损伤和造血功能受阻,在正常条件下,鱼类自身的抗氧化防御系统通过酶,如SOD、GSH-Px,阻止了ROS的生成,清除氧自由基,调节机体氧化平衡,保护机体免受氧化损伤[26],鱼类机体抗氧化能力与健康密切相关,SOD作用于超氧阴离子自由基,使之转化为过氧化氢,从而保护机体细胞免受损伤,是机体抗氧化能力的指示器[27]。T-AOC是机体抗氧化能力的综合性指标。MDA可反映机体脂质过氧化的程度,MDA和SOD相互配合测定,SOD活性反映机体清除氧自由基的能力,而MDA反映了机体受自由基攻击的严重程度[25,28-29]。GSH作为机体内最重要的非酶性抗氧化物,含量高低直接反映机体抗氧化能力的大小。本试验中,随饲料精氨酸水平升高,杂交鳢血浆SOD活性产生显著影响,并在G3组达到最大值,但是在G4组又开始出现下降趋势,表明过量添加精氨酸可能会对机体抗氧化能力造成影响,这一点与斑点叉尾[30]研究结果相一致。精氨酸在体内代谢生成一氧化氮(NO),适量的NO可清除体内氧自由基,但过量的NO会促进过氧化物的产生,从而影响鱼类抗氧化能力[31]。随着饲料中精氨酸水平增加,杂交鳢血浆GSH-Px活性、T-AOC呈现显著升高趋势,表明饲料添加精氨酸显著提高杂交鳢鱼体抗氧化能力,在黄颡鱼[9]上也有同样的结果。在本试验中,杂交鳢血浆MDA含量呈显著下降趋势,并在G5组取得最小值,这与杂交鲟[31]研究结果相一致,表明在杂交鳢饲料中添加精氨酸可显著缓解鱼体细胞过氧化造成的损伤。本试验结果表明,饲料中添加适宜水平的精氨酸可以增加杂交鳢血浆SOD、GSH-Px活性和T-AOC,并降低MDA含量,从而提高鱼体抗氧化能力,这可能与谷氨酰胺的调节作用密切相关[30]。研究表明,机体内精氨酸水平升高能够促进鱼类机体内谷氨酰胺生成,谷氨酰胺可作为能源物质氧化,清除细胞内氧化物质保护细胞组分免受氧化损伤[31]。
4 结 论
饲料中添加适宜水平的精氨酸显著提高杂交鳢WGR、SGR、PPV和全鱼粗蛋白含量以及血浆SOD、GSH-Px活性及T-AOC,并降低饲料系数和血浆MDA含量。以杂交鳢SGR、WGR、PPV指标为判定依据,通过折线模型分析表明,杂交鳢幼鱼饲料精氨酸适宜水平分别为2.91%、2.95%、2.98%(饲料粗蛋白质含量分别为6.63%、6.65%、6.72%)。
