蜱携带牛丙型肝炎病毒新亚型巢式PCR检测方法的建立
2022-03-30郭銮英王妮娜李杭远纪雨霏裴明超邵建伟
郭銮英,王妮娜,李杭远,纪雨霏,马 骏,裴明超,邵建伟,刘 全
(佛山科学技术学院生命科学与工程学院,佛山 528000)
丙型肝炎病毒(hepatitis C virus,HCV),是黄病毒科(Flaviviridae)、丙型肝炎病毒属(Hepacivirus)的成员,是人患肝炎、肝硬化和肝癌的主要原因之一[1]。HCV慢性感染是一个全球性的健康问题。据估计,全球超过1.84亿人感染HCV[2],每年有300万~400万新感染病例。丙型肝炎病毒不仅存在于人类,也存在各种动物中,包括马[3-4]、啮齿动物[5]、蝙蝠[6]和非人类灵长类动物[7]。2015年,Baechlein等[8]首次发现HCV可以感染牛,并证实了该病毒为丙型肝炎病毒属的一个新种——丙型肝炎病毒N(Hepacivirus N,HNV)。因为牛是其特异性宿主,故HNV又被称为牛丙型肝炎病毒(BovHepV)[2]。截至2020年,BovHepV共分为7个亚型(A~G型),我国主要流行E和G型[9]。HNV具有强嗜肝性,主要造成牛无症状持续性感染,感染时间可长达13个月[10]。
HNV在(我国)牛群中普遍存在,但HNV的检测方法尚未见报道。在之前的研究中发现,当使用血清学检测方法时,黄病毒科的病毒间普遍存在交叉反应现象,因此血清学检测方法可能不适用于HNV的临床快速诊断。PCR技术已成为多种病毒早期临床检测的金标准,而巢式PCR是PCR的优化方法,具有敏感性高、特异性强,重复性好的特点。因此,建立HNV病毒的巢式PCR检测方法,可有助于HNV病毒在临床上的快速诊断。
本实验室前期对采集自牛体表的蜱进行了宏转录组高通量测序,经试验获取到1株病毒全基因组,基于保守基因NS3、NS5B构建系统发育树,发现其为HNV新亚型,命名为BovHepV-GDZJ(GenBank登录号MZ221927)。为了更好地鉴别、监测、防控以及深入研究该新亚型病毒的流行情况,本研究结合蜱样品中的BovHepV的高通量测序结果,探索并建立了针对该病毒株的巢式PCR检测方法。经试验证明,该方法敏感性高、重复性好、特异性强,具有较好的临床检测应用价值。
1 材料与方法
1.1 材料
1.1.1 样品 2020年6—10月,在广东省湛江市牛养殖场采集蜱115只;在揭阳市牛养殖场采集蜱59只;在广东省佛山市犬身上,采集蜱126只。经形态学和分子生物学鉴定,蜱均为扇头蜱属,其中,微小扇头蜱59只、镰形扇头蜱241只。
1.1.2 病毒毒株或病毒核酸 BovHepV-GDZJ、淋巴细胞脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus,LCMV)、阿龙山病毒(Alongshan virus,ALSV)、广平病毒(Quang Binh virus)、Lihan蜱病毒(Lihan tick virus,LTV)、发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome virus,SFTSV)等病毒毒株或病毒核酸均由本实验室提供。
1.1.3 主要试剂与仪器 MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0、PremixTaq、pMDTM18-T Vector Cloning Kit试剂盒、PrimeScript One Step RT-PCR kit Ver 2(宝日医生物技术北京有限公司);TRIzol LS 试剂(赛默飞世尔科技中国有限公司);TIANprep Mini Plasmid Kit质粒小提试剂盒;组织研磨机(QIAGEN,德国);超低温冰箱(海尔DW-40L508);涡旋混匀器(WIGGENS,德国);三槽基因扩增仪(Biometra TRIO 48);经典电泳仪电源(WIX-EP600C);恒温金属浴(上海一恒科技有限公司);Axygen琼脂糖凝胶回收试剂盒。
1.2 方法
1.2.1 蜱样品RNA的提取 根据MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0试剂盒说明书,提取蜱样品RNA。本研究所使用的RNA终浓度约200 ng·μL-1或使用量为1 ng·50 μL-1体系。
1.2.2 BovHepV序列丰度分析 使用软件Geneious、PUTTY和FileZilla,结合宏转录组高通量测序原始数据,对实验室获得的BovHepV全基因组进行简易可视化定量分析。
1.2.3 HNV巢式PCR引物的设计 根据广东湛江地区的蜱样品宏转录组测序结果,比较BovHepV基因组信息及mRNA表达量;利用生物学软件Primer Primeier 6、Oligo 7,在病毒mRNA表达量相对高的区域设计巢式PCR引物。引物经NCBI在线功能Primer-BLAST验证,对蜱传或蜱携带的多种病原体,如无形体、立克次体均无非特异性扩增。引物序列见表1,由广州天一辉远生物科技有限公司合成,引物使用浓度均为10 μmol·L-1。
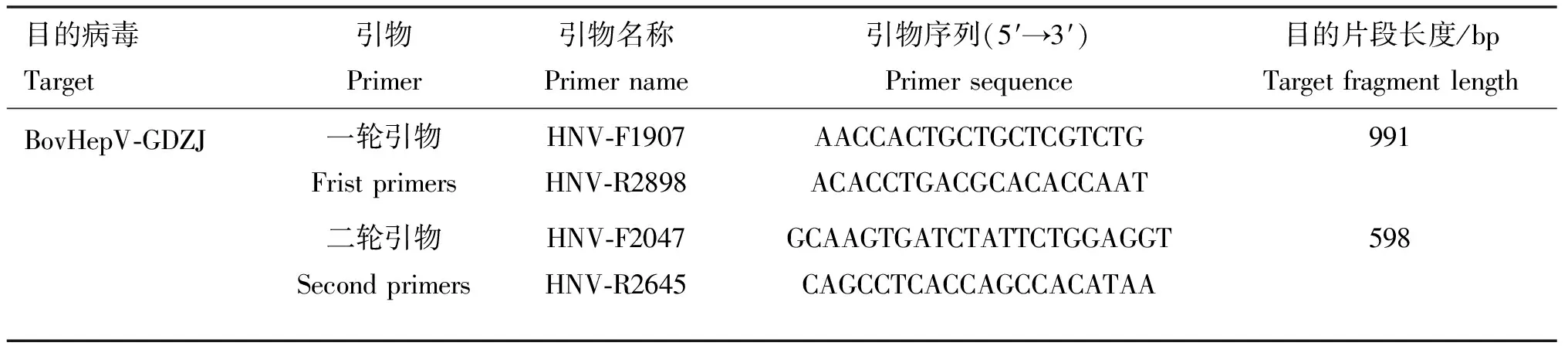
表1 巢式PCR引物
1.2.4 BovHepV巢式PCR检测方法的建立及优化 以阳性样品为模板,进行巢式PCR扩增并优化退火温度。一轮RT-PCR反应体系(10 μL):灭菌去离子水2.8 μL,2×1 Step Buffer 5 μL,上游及下游引物各0.4 μL,PrimeScript Enzyme 酶0.4 μL,模板1.0 μL。一轮RT-PCR反应条件:50 ℃ 30 min;94 ℃ 2 min;94 ℃ 30 s,56、57、58、59、60、61 ℃(6个不同温度)30 s,72 ℃ 1 min 30 s,30个循环;72 ℃ 5 min;4 ℃ 保温。巢式PCR反应体系(50 μL):灭菌去离子水18.5 μL、PremixTaq25.0 μL、上游引物及下游引物各2 μL、模板2.5 μL。二轮PCR反应条件:98 ℃ 1 min;98 ℃ 30 s,55、56、57、58、59、60、61 ℃(7个不同温度)30 s,72 ℃ 90 s,30个循环;72 ℃ 5 min;4 ℃保温。PCR产物进行1.5% 琼脂糖凝胶电泳。
1.2.5 BovHepV-GDZJ株标准品的制备 以阳性样品的cDNA为模板,上游引物BovHepV-F:5′-AACCACTGCTGCTCGTCTG-3′,下游引物BovHepV-R:5′-ACGCAGTCGCCTTCAGTT-3′进行扩增,扩增终产物大小为2 094 bp。反应体系共50 μL:灭菌去离子水18.5 μL、PremixTaq25.0 μL、上游引物及下游引物各2 μL、模板2.5 μL。反应条件:98 ℃ 1 min;98 ℃ 30 s;59 ℃ 30 s;72 ℃ 90 s,30个循环;72 ℃ 5 min;4 ℃保存。PCR产物通过核酸凝胶电泳、胶回收后连接到pMD18-T载体,转化到DH5α 感受态细胞,于含氨苄青霉素的培养板37 ℃培养12 h,挑单个菌落扩大培养,经菌液PCR鉴定后,阳性克隆送公司测序。提取质粒,采用分光光度计测定浓度,计算质粒copies数。Copies数=质量浓度(mg·L-1)×6.023×1014/(碱基数×660)。
1.2.6 特异性试验 用巢式PCR方法检测蜱携带病毒的核酸,包含HNV、LCMV、ALSV、广平病毒、SFTSV,以灭菌去离子水作为阴性对照,扩增产物用1.5% 的琼脂糖凝胶电泳检测或鉴定。
1.2.7 敏感性试验 10倍梯度稀释(105~10-1copies·μL-1)的质粒标准品作为模板,灭菌去离子水作为阴性对照,琼脂糖凝胶电泳验证检测一轮PCR产物和二轮PCR产物,统计检出质粒DNA的最小拷贝数。
1.2.8 重复性试验 以构建的阳性质粒为模板,进行组内试验和组间试验。组内试验,取3个不同浓度梯度(105~103copies·μL-1)的BovHepV质粒标准品作为重复性试验的检测对象,每个梯度重复3次;组间试验,以质粒标准品为模板,每间隔1周做1次BovHepV的巢式PCR检测试验,连续3周。比较组内、组间试验的检测结果,评估该方法的可重复性。
1.2.9 蜱样品检测 采用PCR方法和巢式PCR方法,对2020年在广东地区采集的蜱样品进行检测,疑似阳性条带的PCR产物均经测序方法验证,比较并分析两种检测方法的检测效率。
2 结 果
2.1 BovHepV-GDZJ序列丰度分析
蜱样本宏转录组测序数据中,BovHepV-GDZJ株全基因组序列的可视化定量分布见图1。以BovHepV-GDZJ的全基因组序列为内参序列,样品高通量测序结果共有224个reads定向到该内参序列上,获得了92.1%的基因组覆盖率(8 115 nt/8 808 nt,两两相似性为99.7%。病毒reads占非核糖体reads总数的百分比为0.003 8%(224 reads/5 883 446 reads)。其中,BovHepV-GDZJ株基因组序列上的1 743―2 665、3 833―4 205、7 877―8 622位区域序列丰度较高,在高丰度区域设计本研究巢式PCR引物。

图1 广东湛江BovHepV-GDZJ基因组高通量测序拼接图
2.2 巢式PCR检测方法的优化
以阳性样品RNA为模板,通过调整不同的退火温度,筛选最适退火温度,结果如图2所示。6个退火温度均能产生与预期大小相符的目的条带,其中58 ℃温度条带最清晰且无明显杂带或拖带。将二轮PCR退火温度设为55、56、57、58、59、60、61 ℃,结果显示7个退火温度均能产生目的条带,其中第二轮退火温度最适为56~57 ℃。
M.DNA相对分子质量标准;1.55 ℃;2~7.56~61 ℃;8.阴性对照
2.3 标准品的制备
将BovHepV目的基因克隆至pMD18-T载体。经PCR扩增验证,目的片段为2 094 bp,与预期大小一致。后将质粒送往测序,确定成功构建标准质粒。超微量分光光度计测得重组质粒浓度为276.70 ng·μL-1,根据公式计算得知,标准品的浓度为6.86×1010copies·μL-1。
2.4 特异性、敏感性及重复性检验
特异性试验结果显示,此方法仅能扩增BovHepV-GDZJ质粒标准品,对其他病原无反应,表明该巢式PCR方法的特异性较好。
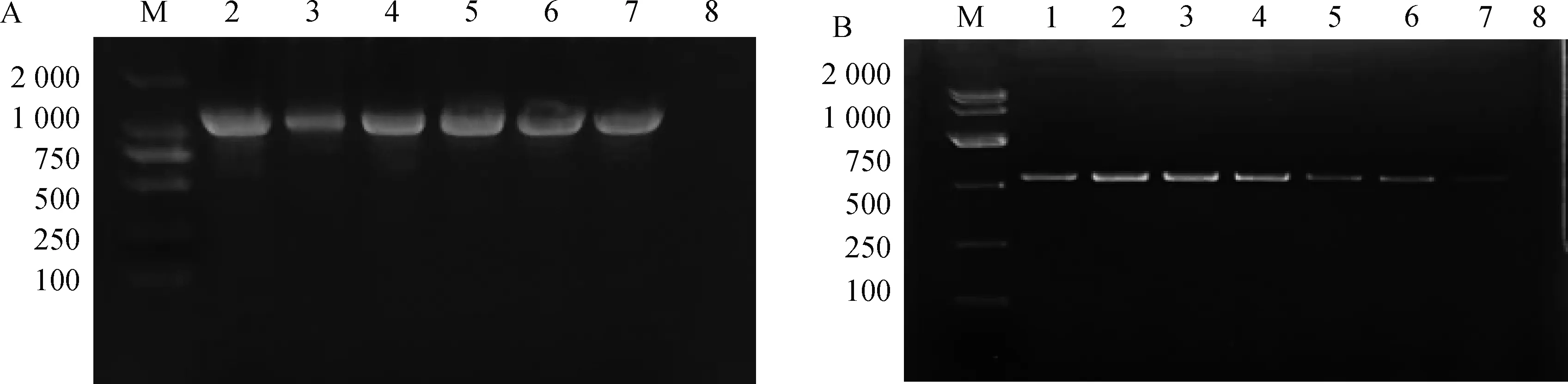
敏感性试验结果显示,一轮PCR的检测下限为6.8×103copies·μL-1(图3A)。巢式PCR检测下限为6.8 copies·μL-1,结果表明,本方法具有较高的敏感性,巢式PCR比一轮PCR敏感性高1 000倍(图3B)。

M.DNA相对分子质量标准;1~7.105~10-1;8.阴性对照
组间及组内试验均能出现单一目的条带,表明本方法具有良好的重复性。
2.5 蜱样品检测
采用PCR和巢式PCR方法分别检测300份蜱样中HNV的流行情况。检测结果经基因测序方法验证,揭阳市和佛山市的蜱样中均未检测到BovHepV-GDZJ,而湛江市蜱样中,PCR检测的阳性率为33.04%(38/115),巢式PCR检测的阳性率为46.09%(53/115)。结果说明巢式PCR灵敏性明显优于PCR。
3 讨 论
HNV会造成牛无症状持续性感染[8],对养牛业的健康发展构成了潜在威胁。同时,我国在商品化的胎牛血清中也检测出HNV核酸[9],揭示HNV可能对细胞培养等科研试验及疫苗制备造成不利影响。HNV在全球广泛分布流行,但关于HNV的传播方式、传播途径、流行情况及早期快速检测方法均存在较大研究空间。
目前,HCV的检测方法有血清学方法和分子学方法[11]。血清学方法包括重组免疫印迹试验和酶联免疫吸附试验。分子学方法有直接测序、特异性引物PCR法、特异性探针杂交法等,一部分丙型肝炎病毒是通过高通量测序方法发现的。目前,国内外对HNV的发现及研究都是基于高通量测序技术和PCR方法,还未有系统的分子学或血清学检测方法,HNV的鉴定及检测采用何种方法,主要取决于实验室的现有条件及目的。对临床而言,能确定病毒基因型、评估牛丙型肝炎病毒在动物种群中受感染的比率及感染既往史,血清学调查可以提供比核酸检测更真实的结果;对于流行病学研究而言,准确定位到病毒亚型的检测试验也是必需的。
此外,本研究结果提示,蜱很可能是HNV机械性传播媒介而不是自然宿主。与澳大利亚一项关于蜱中发现啮齿动物肝炎病毒的研究类似[12],BovHepV-GDZJ在蜱高通量数据集中表现出极低的丰度(0.003 8%),加上HNV在黄病毒科系统发育中的位置,表明该病毒很可能来自蜱的脊椎动物宿主,并且主要存在于饱血蜱的血液中,而不是来自蜱本身,也可能不感染蜱或在蜱中进行复制。本研究的蜱存在BovHepV高阳性率是因为本次检测的蜱样品采集自同一个牛养殖场,不具有统计学意义。后续可重点关注饱血蜱及未吸血蜱携带HNV的流行情况、进行湛江市牛场甚至广东地区牛场BovHepV流行病情况的大规模调查。
4 结 论
基于宏转录组学高通量测序方法,首次在广东湛江市采集的蜱中发现BovHepV-GDZJ并建立敏感性高、特异性强、稳定性好的巢式PCR检测方法,揭示了蜱携带新型病毒的能力,建立的检测方法也可为后续该病毒株的诊断及防控提供技术支持,为HNV流行病学监测奠定基础。
