百令胶囊对急性胰腺炎模型大鼠肺损伤的修复作用*
2022-03-30李淑敏肖志彬田增奎陈振谨
李淑敏,肖志彬,田增奎,陈振谨
(1.天津河西医院药剂科,天津 300202;2.内蒙古医科大学药学院临床药学教研室,内蒙古 呼和浩特 010110)
胰腺炎为常见消化系统疾病,病死率为15%~30%[1],其发病时常伴多器官衰竭,肺损伤为常见并发症之一。肺损伤的严重程度与胰腺炎患者的住院时间、预后等密切相关[2]。Rho/ROCK通路是与哮喘、肺动脉高压、肺纤维化等呼吸系统疾病相关的信号转导通路[3]。该通路的异常表达是导致肺组织损伤等病理学变化的重要原因[4]。百令胶囊具有补肺益肾功效,治疗肺损伤的疗效显著[5]。本研究中探讨了百令胶囊对急性胰腺炎模型大鼠肺损伤的修复作用,为该制剂的药理学机制研究提供参考。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:Multiskan Sky型全波长酶标仪(赛默飞世尔科技有限公司);EasyStat型全自动血气分析仪(美国Medica公司);OmegaFluor型凝胶成像仪(美国Aplegen公司);CKX53型倒置显微镜(日本Olympus公司);RM2235型石蜡切片机(德国Leica公司);Neofuge 23R型台式高速冷冻离心机(力康国际贸易<上海>有限公司);C1000型Touch聚合酶链反应仪(美国Bio-Rad公司);Oven125型烘箱(艾卡仪器设备有限公司)。
试药:百令胶囊(杭州中美华东制药有限公司,批号为20191102);盐酸法舒地尔注射液(天津红日药业股份有限公司,批号为2018131);牛磺胆酸钠(北京诺博莱德科技有限公司,批号为1105261);Trizol试剂、SYBR Green PCR Master Mix、反转录试剂盒(赛默飞世尔科技有限公司,批号分别为21065,11431,72401);RhoA、Rho激酶1(ROCK1)、GAPDH兔单克隆抗体、Rho激酶2(ROCK2)兔多克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(碧云天生物技术公司,批号分别为13140,62809,17165,12203,31781);高效RIPA裂解液、ECL Plus超敏发光液、苏木素-伊红(HE)染色剂、淀粉酶、白细胞介素6(IL-6)试剂盒、肿瘤坏死因子-α(TNFα)试剂盒、超氧化物歧化酶(SOD)试剂盒、BCA试剂盒(北京索莱宝科技有限公司,批号分别为483121,567121,103217,652311,212631,403417,118910,707830);髓过氧化物酶试剂盒(MPO,上海广锐生物科技有限公司,批号为GRDS13-178);活性氧试剂盒(ROS,武汉恒意赛生物科技有限公司,批号为ELK7244)。
动物:健康清洁级成年Wistar大鼠72只,雄性,体质量180~200 g,均购自豪威生物科技有限公司,实验动物许可证号为SYXK(津)2019-0002。饲养于动物使用房,12 h/12 h明暗交替,温度(23±1)℃,相对湿度40%~70%。
1.2 方法
将72只大鼠随机分为假手术组(等体积生理盐水灌胃),模型组(等体积生理盐水灌胃),百令胶囊低、中、高剂量组(1,2,4 g/kg灌胃)及法舒地尔组(30 mg/kg腹腔注射),各12只。除假手术组外,其余5组大鼠腹腔注射10%水合氯醛麻醉,沿腹部正中线切开,以0.2 mL/min的速率向胰胆管内注射4%牛磺胆酸钠(1 mL/kg),以复制胰腺炎大鼠模型;注射后关腹,以术后2 d大鼠出现耳缘静脉变粗突起,呼吸急促,肺部听诊出现湿罗音为建模成功[6-7]。假手术组大鼠仅开腹暴露十二指肠后关腹。建模成功后,各组大鼠均予相应药物或生理盐水,每天1次,连续5 d[8-10]。
1.3 观察指标
血清淀粉酶及炎性因子:末次给药后,取大鼠腹主动脉血液,4℃下静置2 h,8 000 r/min离心10 min,分离血清,收集上清液,采用酶联免疫吸附(ELISA)法检测血清淀粉酶、IL-6、TNF-α的水平。
肺功能指标:取腹主动脉血,采用血气分析仪检测动脉血二氧化碳分压(PaCO2)、氧分压(PaO2),计算氧合指数(OI)。OI=PaO2/吸入氧浓度(FiO2)。
肺组织湿干质量比(W/D)及MPO,SOD,ROS:每组取6只大鼠,取右肺下叶,称定的质量记为湿质量(W),将其置80℃烘箱中烘烤至恒重,称定的质量记为干质量(D),计算W/D。每组另取6只大鼠肺组织,采用ELISA法检测肺组织MPO,SOD,ROS的水平。
肺组织病理形态学:取大鼠肺组织,用4%多聚甲醛固定,梯度乙醇脱水,石蜡包埋,切片(厚度为5µm),用二甲苯脱蜡、梯度乙醇复水后,HE染色,显微镜下观察。
肺组织RhoA,ROCK1,ROCK2 mRNA表达:采用实时荧光定量聚合酶链反应(RTq-PCR)法。取大鼠肺组织适量,以Trizol试剂提取RNA,反转录合成cDNA,以GAPDH为内参,采用2-ΔΔCt法计算相对表达水平。PCR条件为94℃30 s;94℃30 s,55℃30 s,72℃1 min,30个循环。基因引物信息见表1。

表1 各基因引物信息Tab.1 Primer sequences of genes
肺组织RhoA,ROCK1,ROCK2蛋白表达:采用Western blot法。取大鼠肺组织适量,加入蛋白裂解液,匀浆,以BCA法测定样品的蛋白浓度。样品经变性后上样,经聚丙烯酰胺凝胶电泳分离等量蛋白样品,并将蛋白条带转至聚偏二氟乙烯(PVDF)膜上,封闭(5%脱脂奶粉),加RhoA抗体(1∶500)、ROCK1抗体(1∶500)、ROCK2抗体(1∶500)及GAPDH抗体(1∶500),孵育过夜,清洗3次,加二抗山羊抗兔IgG(1∶1 000),室温下孵育40 min,清洗3次,加入化学发光试剂,显色。采用Image J软件分析蛋白相对表达水平。
1.4 统计学处理
2 结果
2.1 血清淀粉酶、IL-6及TNF-α
与假手术组比较,模型组大鼠血清淀粉酶、IL-6及TNF-α水平均显著升高(P<0.05);与模型组比较,百令胶囊低、中、高剂量组及法舒地尔组大鼠血清淀粉酶、IL-6、TNF-α水平均显著降低(P<0.05)。详见表2。
表2 各组大鼠血清淀粉酶、IL-6及TNF-α水平比较(±s,n=12)Tab.2 Comparison of serum amylase,IL-6 and TNF-αlevels of rats in each group (±s,n=12)

表2 各组大鼠血清淀粉酶、IL-6及TNF-α水平比较(±s,n=12)Tab.2 Comparison of serum amylase,IL-6 and TNF-αlevels of rats in each group (±s,n=12)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。表3至表5、图2同。Note:Compared with those in the sham operation group,*P<0.05(for Tab.2-5,Fig.2);Compared with those in the model group,#P<0.05(for Tab.2-5,Fig.2).
IL-6(pg/mL)42.76±1.26 148.66±2.18*107.85±2.81#84.47±1.81#50.85±1.43#58.40±1.13#组别假手术组模型组百令胶囊低剂量组百令胶囊中剂量组百令胶囊高剂量组法舒地尔组血清淀粉酶(U/L)1 053.27±24.17 4 128.61±15.63*3 370.59±13.94#2 660.12±27.45#1 245.73±31.25#2 178.17±43.37#TNF-α(pg/mL)29.39±0.89 90.14±1.05*78.59±1.77#61.67±0.92#41.77±1.22#52.40±1.38#
2.2 肺功能及肺组织W/D
与假手术组比较,模型组大鼠动脉血PaCO2、肺组织W/D均显著升高(P<0.05),PaO2和OI显著降低(P<0.05);与模型组比较,百令胶囊低、中、高剂量组及法舒地尔组大鼠PaCO2、肺组织W/D均显著降低(P<0.05),PaO2和OI均显著升高(P<0.05)。详见表3。
表3 各组大鼠PaCO2,PaO2,OI及肺组织W/D水平比较(±s,n=12)Tab.3 Comparison of PaCO2,PaO2,OI and lung tissue W/D levels of rats in each group(±s,n=12)

表3 各组大鼠PaCO2,PaO2,OI及肺组织W/D水平比较(±s,n=12)Tab.3 Comparison of PaCO2,PaO2,OI and lung tissue W/D levels of rats in each group(±s,n=12)
组别假手术组模型组百令胶囊低剂量组百令胶囊中剂量组百令胶囊高剂量组法舒地尔组PaCO2(mmHg)33.69±0.97 62.01±1.24*53.06±1.48#46.68±1.31#37.77±0.79#43.69±1.52#PaO2(mmHg)90.86±1.31 47.99±2.95*57.70±0.96#72.24±1.19#84.99±1.17#77.34±1.53#OI(mmHg)419.43±5.44 213.8±3.47*298.82±5.80#347.24±4.59#404.71±4.08#368.27±3.18#W/D 3.91±0.73 6.57±1.60*5.54±1.23#4.91±0.91#4.28±0.62#4.82±0.77#
2.3 肺组织MPO,SOD,ROS
与假手术组比较,模型组大鼠肺组织MPO及ROS水平均显著升高(P<0.05),SOD水平显著降低(P<0.05);与模型组比较,百令胶囊低、中、高剂量组及法舒地尔组大鼠肺组织MPO及ROS水平均显著降低(P<0.05),SOD水平显著升高(P<0.05)。详见表4。
表4 各组大鼠肺组织MPO,SOD,ROS水平比较(±s,n=6)Tab.4 Comparison of MPO,SOD and ROS levels in lung tissue of rats in each group(±s,n=6)

表4 各组大鼠肺组织MPO,SOD,ROS水平比较(±s,n=6)Tab.4 Comparison of MPO,SOD and ROS levels in lung tissue of rats in each group(±s,n=6)
组别假手术组模型组百令胶囊低剂量组百令胶囊中剂量组百令胶囊高剂量组法舒地尔组MPO(U/gprot)0.81±0.09 3.89±0.17*2.74±0.11#1.86±0.12#1.03±0.04#1.16±0.15#SOD(U/mgprot)117.08±3.20 42.86±1.55*62.58±1.16#78.11±1.09#95.26±1.23#88.10±1.44#ROS(U/mgprot)20.43±0.78 86.52±1.18*71.51±1.30#56.12±1.12#43.95±1.71#46.33±0.74#
2.4 肺组织病理形态学
假手术组大鼠肺组织未见明显病理形态学变化;模型组大鼠肺组织出现明显炎性浸润,毛细血管充血、水肿,肺间隔增厚;百令胶囊低、中、高剂量组及法舒地尔组大鼠肺组织炎性浸润、组织结构均较模型组大鼠明显改善。详见图1。
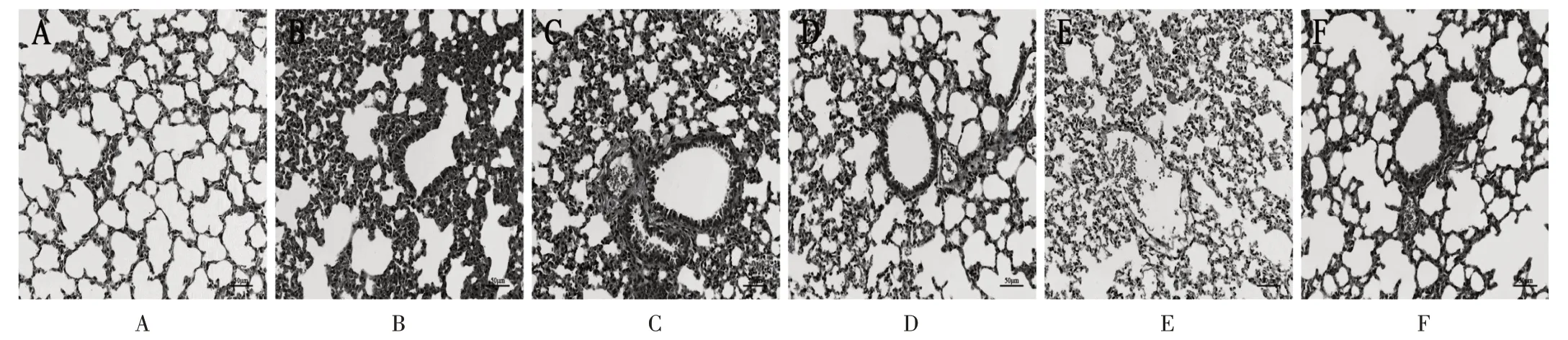
图1 大鼠肺组织病理形态学(HE,×200)A.Sham operation group B.Model group C.Bailing Capsules low-dose group D.Bailing Copsules medium-dose group E.Bailing Capsules high-dose group F.Fasudil groupFig.1 Pathological morphology of lung tissue of rats(HE staining,×200)
2.5肺组织RhoA,ROCK1,ROCK2 mRNA水平
与假手术组比较,模型组大鼠肺组织mRNA水平显著升高(P<0.05);与模型组比较,百令胶囊低、中、高剂量组及法舒地尔组大鼠肺组织RhoA,ROCK1,ROCK2 mRNA水平均显著降低(P<0.05)。详见表5。

表5 各组大鼠肺组织RhoA,ROCK1,ROCK2 mRNA水平比较(X±s,n=12)Tab.5 Comparison of RhoA,ROCK1 and ROCK2 mRNA levels in lung tissue of rats in each group(X±s,n=12)
2.6肺组织RhoA,ROCK1,ROCK2蛋白水平
与假手术组比较,模型组大鼠肺组织RhoA,ROCK1,ROCK2蛋白水平均显著升高(P<0.05);与模型组比较,百令胶囊低、中、高剂量组及法舒地尔组大鼠肺组织RhoA,ROCK1,ROCK2蛋白水平均显著降低(P<0.05)。详见图2。

图2各组大鼠肺组织RhoA,ROCK1,ROCK2蛋白水平A.Electroploregogram B.Data statisticsFig.2 RhoA,ROCK1 and ROCK2 protein levels in lung tissue of rats in each group
3 讨论
胰腺炎是由于胆道系统疾病、高脂血症等导致胰腺被胰蛋白酶自身消化,进而引发胰腺水肿、坏死,发热、腹痛等症状的全身性疾病。肺损伤是胰腺炎的常见并发症,胰腺炎肺损伤患者的病死率高达60%,故对于肺损伤的治疗是影响胰腺炎患者预后及病死率的关键环节[11]。目前,主要采用对症治疗,但尚未发现药理学作用及机制相对明确的药物。
百令胶囊是以中医理论为指导、主要由发酵冬虫夏草菌粉制成的中成药,具有补肺益肾等功效,临床用于治疗咳嗽、气喘、面目浮肿等症。衷敬华等[12]的研究表明,百令胶囊能降低肺损伤模型大鼠体内IL-6,TNF-α,TGF-β1等炎性因子水平,进而抑制肺泡炎性反应及纤维化进展。徐金芬等[13]的研究发现,百令胶囊能明显降低放射性肺炎及肺纤维化的发生率,以及肺损伤患者体内降钙素原及C反应蛋白水平,减轻放疗相关性肺损伤程度。可见,百令胶囊治疗肺损伤具有潜力。
血清淀粉酶水平升高是胰腺炎发病的典型表现,IL-6和TNF-α作为重要的炎性因子,在胰腺炎的发生、发展中起着重要作用。刘隽等[14]的研究表明,胰腺炎模型小鼠血清淀粉酶、IL-6及TNF-α水平均明显升高,降低IL-6及TNF-α水平能明显阻止模型小鼠胰腺炎的病情进展。栾晓峰等[15]的研究发现,胰腺炎患者血清TNF-α和IL-6水平均明显升高,清胰汤可降低患者血清TNF-α及IL-6水平,抑制炎性反应,并降低胃肠激素水平,进而缓解患者的临床症状;PaCO2,PaO2,OI是反映肺功能的重要指标,且与肺损伤预后及病理进展密切相关。杨永康等[16]的研究发现,胰腺炎肺损伤模型大鼠肺组织充血水肿,PaCO2升高,PaO2及OI明显降低;MPO,ROS,SOD参与氧化应激损伤的发生,肺损伤大鼠MPO和ROS水平升高及SOD水平降低均会加重模型大鼠肺组织氧化损伤程度,促进炎性因子释放,而降低MPO和ROS水平,升高SOD水平,能减轻大鼠炎性级联放大效应,修复肺损伤[17]。本研究结果表明,百令胶囊能明显抑制胰腺炎肺损伤模型大鼠炎性因子的释放,恢复肺功能,提高肺组织抗氧化损伤的能力。
Rho/ROCK通路被证明与肺损伤密切相关。张琳等[18]研究发现,内毒素引起的肺损伤与Rho/ROCK通路过度激活有关,利多卡因能通过抑制Rho/ROCK通路的活性,发挥抗炎及修复作用。汪文淑等[9]的研究表明,慢性阻塞性肺疾病并肺动脉高压模型大鼠的肺血管损伤,与其体内Rho/ROCK通路相关蛋白的过表达有关,应用Rho/ROCK通路抑制剂能明显阻止肺组织血管重构,改善肺损伤。丁仁彧等[19]报道了脓毒症引起的肺损伤也与Rho激酶的激活有关,抑制Rho激酶活性可缓解肺损伤,减少肺积液。本研究结果提示,百令胶囊可能通过抑制Rho/ROCK通路,进而抑制胰腺炎肺损伤进展,并修复模型大鼠肺组织炎性改变。
综上所述,百令胶囊能通过改善急性胰腺炎肺损伤模型大鼠的肺功能,抑制炎性因子释放及氧化损伤,其机制可能与抑制Rho/ROCK通路有关。
