CsA与厄洛替尼共载壳聚糖纳米粒的制备及作用
2022-03-30于熹微赵亮
于熹微,赵亮
(1.锦州医科大学附属第三医院;2.锦州医科大学,辽宁 锦州121000)
化疗被作为当今肿瘤治疗的主要手段,由于药物治疗耐药性(multiple drug resistance,MDR)而限制了化疗的有效性,MDR机制是在细胞膜上高表达跨膜转运蛋白,即P-糖蛋白(P-gp)[1-2]。P-gp这种膜转运蛋白能够依赖于能量将药物转运到胞外,干扰药物发挥作用。本文要以P-gp为靶点克服耐药过程[3]。环孢菌素A是第一代以P-gp为靶点的抑制剂,能够与药物竞争P-gp的结合位点,减少药物被排出,提高细胞内的药物浓度。借助纳米技术,将抑制剂高效低剂量的递送到肿瘤细胞,同时增加药物敏感性在肿瘤治疗中发挥更大的应用价值[4]。
作为表皮生长因子受体(epithelial growth factor receptor,EGFR)酪氨酸激酶结构域的选择性抑制剂,厄洛替尼(erlotinib)被广泛用于人类癌症的化疗[5]。壳聚糖(chitosan,Cs)是甲壳素(chitin)脱乙酰化的天然碱性多糖,已经被广泛应用,作为纳米材料递送药物,效果极佳[6]。在本课题中,我们制备了能够同时包裹抑制剂CsA和药物erlotinib的共载壳聚糖纳米粒,旨在验证共载纳米粒是可以增加抗肿瘤药物的敏感性[7]。探索共载纳米粒对耐药Hela细胞的抗肿瘤效果,预示纳米药物输送系统将对逆转耐药具有很大的贡献[8-9]。
1 仪器与材料
AL-204型精密电子天平(梅特勒-托利多上海有限公司)、HH-M8数显恒温水浴锅(金坛市城西春兰实验仪器厂)、DF-1型集热式磁力搅拌器(金坛市金城国胜实验仪器厂)、Nano ZS90 纳米粒度仪(英国Malvem公司)、JEM-1200EX透射电子显微镜(日本电子株式会社)、Zeta电位及分子量分析仪(英国Malvem公司)、低温高速离心机(Sigma公司)、UV-2450紫外可见分光光度计(日立岛津公司)、XD-101型倒置显微镜(日本OLYMPUS公司)、全自动酶标仪(美国Bio-Rad公司)。
厄洛替尼(纯度98%,批号1241608,美国Sigma公司)、环孢菌素A(纯度98%,批号Y0002292,美国Sigma公司)、壳聚糖(脱乙酰度:80%,海信生物制品有限公司)、冰醋酸(TEDIA公司)、多聚磷酸钠(天津天河试剂)、CLARK血清(赛默飞世尔科技(中国)有限公司)、RAPI-1640培养液(赛默飞世尔科技(中国)有限公司)、胰蛋白酶(biosharp公司)、四氮唑溴盐(MTT)、耐厄洛替尼宫颈癌Hela细胞株(锦州医科大学生命科学研究院)。
2 实验方法
2.1 CsA/erlotinib NPs的制备
2.1.1 Cs NPs的制备:采用离子交联法制备纳米粒。精密称取35 mg壳聚糖溶解于冰醋酸中,室温下搅拌15 min,在60 ℃进行充分溶解,直至溶胀完全冷却至室温。于3000 r/min下,离心10 min,除去壳聚糖冰醋酸溶液中的杂质。用0.22 μm微孔滤器对壳聚糖溶液进行滤过除菌。精密量取壳聚糖溶液于锥形瓶中,在500 r/min的磁力搅拌下用输液器缓慢滴加1 mg/mL的多聚磷酸钠溶液保持30滴/分钟的速度,直至有乳光出现,停止滴加TPP,继续搅拌30 min,即得空白壳聚糖纳米粒(Cs NPs)悬液。将悬液于12 000 r/min下,离心25 min,弃去上清液,超纯水洗涤纳米粒后,再次离心回收沉淀,置于真空冷冻干燥机,冷冻干燥48 h,得到Cs NPs。
2.1.2 CsA/erlotinib NPs的制备:精密称取35 mg壳聚糖溶解于冰醋酸中,室温下搅拌15 min,在60 ℃进行充分溶解,直至壳聚糖溶胀完全冷却至室温。于3000 r/min下,离心10 min,除去壳聚糖冰醋酸溶液中的杂质。用0.22 μm微孔滤器对壳聚糖溶液进行滤过除菌。精密量取壳聚糖溶液于锥形瓶中,在500 r/min的磁力搅拌下缓慢滴加含有CsA(10、15、20 μg/mL)与erlotinib(0.5、1、2 mg/mL)的TPP溶液,保持每分钟30滴的速度进行滴加,直至溶液有乳光出现,停止滴加,继续搅拌30 min,即制得CsA /erlotinib壳聚糖纳米粒悬液。将悬液于12 000 r/min下,离心25 min,弃去上清液,超纯水洗涤纳米粒后,再次离心回收沉淀,最后经冷冻干燥既得CsA/erlotinib NPs。
2.2 表征
2.2.1 TEM透射电镜:JEM-1200EX透射电子显微镜观察CsA/erlotinib NPs的形态。
2.2.2 粒径和Zeta电位的测定:取超纯水适量将纳米粒冻干粉末复溶,Nano ZS90纳米粒度分析仪对CsA/erlotinib NPs进行粒径和Zeta电位分析。
2.3 体外响应性释放实验
pH响应性体外释放度考察:使用pH为5.8和7.4磷酸盐缓冲液作为释放介质,考察CsA/erlotinib NPs在不同pH介质中的释放程度。
2.4 细胞实验
2.4.1 细胞培养:将Hela(耐erlotinib)细胞培养于含有10%胎牛血清的培养基中,在37 ℃,5% CO2培养箱中培养,采用0.25%胰蛋白酶进行消化传代细胞。
2.4.2 细胞摄取实验:采用荧光定量分析erlotinib和CsA/erlotinib NPs的细胞摄取。调整Hela细胞数目为1×106个/毫升后接种于96孔板内,孵育24 h。加入最终浓度为1 μg/mL的erlotinib及CsA/erlotinib NPs,并使用酶标仪检测在激发波长为495 nm处FITC的荧光强度。通过计算细胞从erlotinib和CsA/erlotinib NPs中摄取的荧光强度与两者的初始荧光强度的比值来测定在3、6、9、12 h erlotinib和CsA/erlotinib NPs的相对摄取比率。
2.4.3 细胞毒性实验:调整Hela细胞数目为1×106个/毫升后接种于96孔板内,孵育24 h。按照Cs NPs、free erlotinib、free erlotinib and CsA、erlotinib NPs、和CsA/erlotinib NPs的顺序,用培养基稀释成不同浓度梯度,每孔100 μL加入到96孔板中,同时预留空白培养基作为调零孔,设置6个复孔。继续孵育24 h,将MTT(5 mg/mL)按每孔20 μL与培养基80 μL的比例加入到96孔板中,孵育4 h,然后弃去培养液,各孔加入200 μL DMSO,置于酶标仪上在OD=490 nm处检测吸光度值对细胞活率定量分析。
3 结 果
3.1 CsA/erlotinib NPs的制备
首先采用离子交联剂TPP使Cs能组装成Cs NPs,确定好最适配比,即CsA为15 μg/mL,壳聚糖为3.5 mg/mL,厄洛替尼为1 mg/mL的浓度,利用离子交联法将CsA和erlotinib加入到溶胀完全的壳聚糖中,经交联后能够很好实现共载。
3.2 表征
3.2.1 TEM透射电镜:采用TEM对制备的CsA/erlotinib NPs的形态进行分析,可以观察到所制备共载纳米粒形态紧致呈球形,外观均一,分散性良好,见图1。

图1 CsA/erlotinib NPs电镜图
3.2.2 粒径和Zeta电位的测定:所得纳米粒的粒径大小均一,分布图形可见峰形匀称,粒径主要集中在100 nm左右,符合纳米粒的粒径要求,见图2。
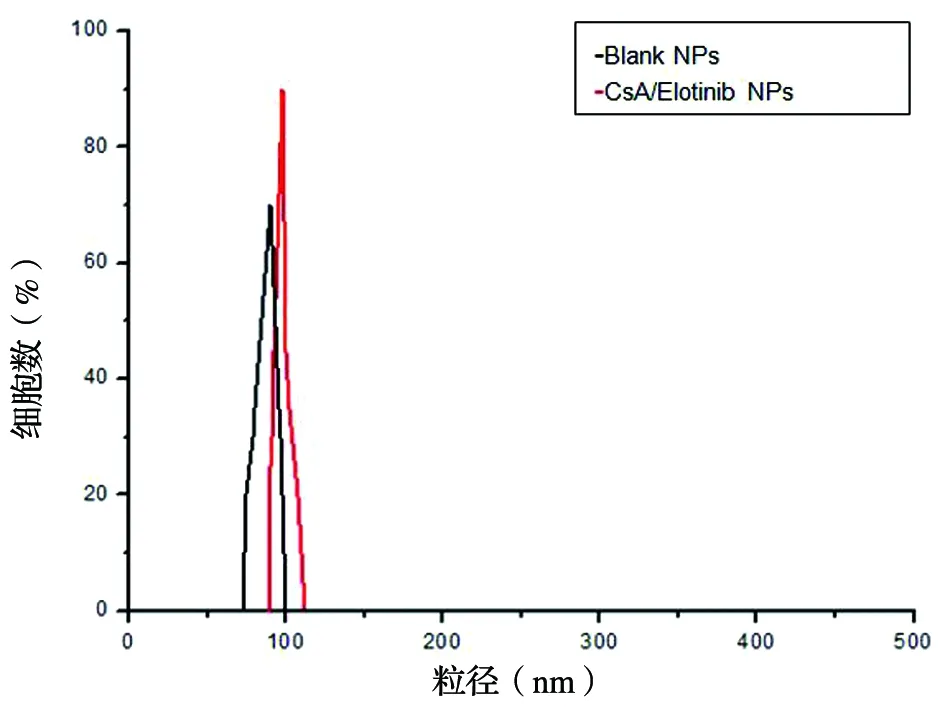
图2 CsA/erlotinib NPs粒径分布图
包封率CsA为(85.3±0.2)%,erlotinib为(88.8±3.1)%以及多分散指数为0.24±0.06,结果可以看出所制备纳米粒共载效果良好,见表1。
3.3 体外响应性释放实验
pH响应性释放实验:erlotinib在48 h内几乎完全释放。考察整体释放结果,发现药物释放模式呈pH依赖性,在pH=5.8条件下迅速释放,但在pH=7.4条件下缓慢释放。说明共载纳米粒在弱酸性环境下更易释放,这将有利于纳米粒选择性的在肿瘤酸性环境下释放出内容物。同样CsA在纳米粒中的释放均能在48 h内从纳米粒中释放到缓冲液中,释放度考察良好,见图3。
3.4 细胞实验
3.4.1 细胞摄取实验:当使用相同浓度的erlotinib和CsA/erlotinib NPs处理细胞时,erlotinib在前3 h内被细胞几乎完全摄取呈饱和状态,摄取率为83.2%,相反,CsA/erlotinib NPs表现出较好的摄取程度,缓慢且呈时间依赖性累积摄取持续达12 h,摄取率也能达到79.8%,表明Hela细胞对CsA/erlotinib NPs摄取与erlotinib相比无明显差异,这将有利于保证erlotinib与CsA被顺利的递送到Hela细胞内,发挥药物抑制细胞增值的作用,进一步发挥抑制药物外排而克服耐药的发生,见图4。
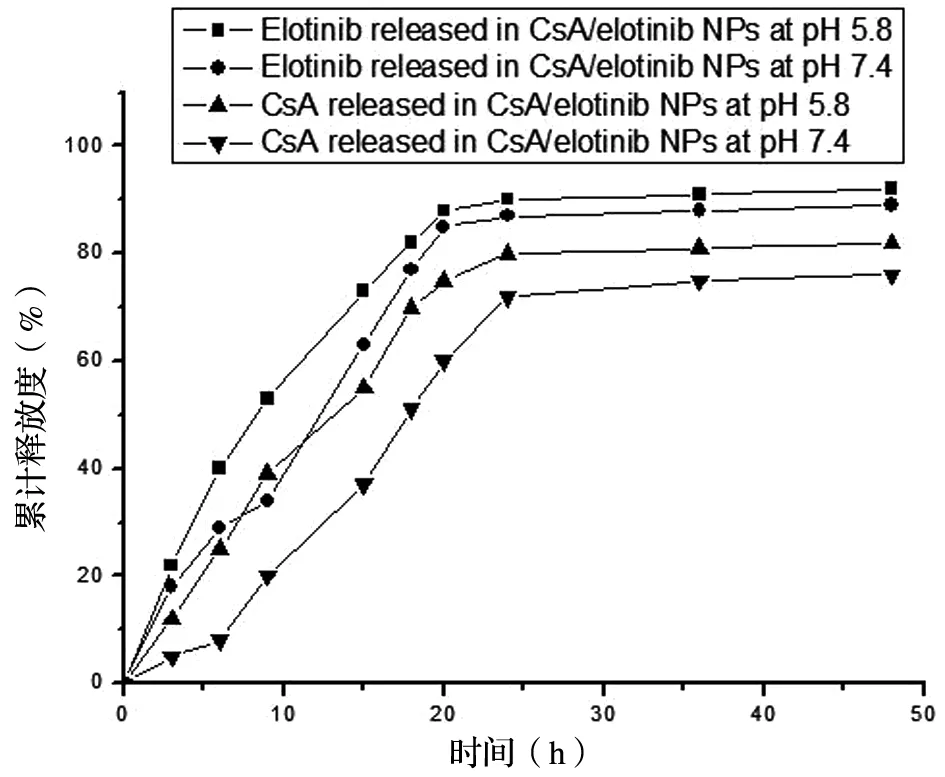
CsA/erlotinib NPs在磷酸盐缓冲液(pH 5.8和pH 7.4,37 ℃)中48 h体外释放分布图
3.4.2 细胞毒性实验:Cs NPs对细胞几乎没有毒性,2.0 μg/mL Cs NPs作用细胞经过24 h后,细胞存活率仍超过95%,CsA/erlotinib NPs组半数抑制浓度(IC50)为14.5 μg/ mL,表现出对耐erlotinib 的Hela较明显的抑制增殖作用,呈浓度-时间依赖性,差异具有统计学意义(P<0.05),erlotinib的IC50为25.3 μg/ mL,结果大于共载纳米粒组,差异具有统计学意义(P<0.05),而游离组效果不甚理想,这可能因为药物裸露在外,缺少壳聚糖纳米载体保护易被细胞排出,导致细胞内有效浓度降低。说明当两者被包封于Cs中时,能够被保护不被外排,进而发挥显著抑制增殖效果,见图5。

表1 CsA /erlotinib NPs的表征参数
4 讨 论
MDR机制介导耐药的过程主要是细胞失去对传统化疗药物的敏感性,导致疗效不理想。目前研究对MDR形成的主要原因是跨膜转运蛋白介导的药物外排。肿瘤内部特殊微环境、上皮-间质细胞转化、细胞抗凋亡等因素也是成为耐药的诱因[10]。借助有效手段去抑制药物被泵出胞外这将成为克服耐药的重点[11]。选择天然有机高分子材料的壳聚糖作为载体,探讨其共包载erlotinib与CsA后对erlotinib作用发生的变化,在大量递送erlotinib入胞后,借助CsA选择性竞争P-糖蛋白的结合位点,使得更多erlotinib不被细胞转运出胞外[12]。
本研究成功制备了CsA/erlotinib NPs,将抗肿瘤经典药物erlotinib和药物外排抑制剂CsA一同包载于稳定的壳聚糖中成为功能型载药纳米粒,体外释放度结果表明CsA/erlotinib NPs能够呈pH响应性药物释放特性,共载纳米粒在pH为5.8时释放较为迅速体现出纳米粒在肿瘤弱酸性环境下释放的特点,进而能够靶向肿瘤细胞迅速释放。摄取实验能够直观发现纳米粒被细胞摄入这一主动过程,呈时间依赖性累积,包裹于壳聚糖纳米粒中的erlotinib能够顺利被细胞摄入,入胞后CsA从中释放,抑制细胞的外排作用,使同载的erlotinib能够更多的滞留于细胞中发挥作用,与游离组药物相比几乎无明显摄取差异,细胞实验结果表明CsA/erlotinib NPs对耐药Hela细胞比erlotinib具有更显著的细胞毒性。
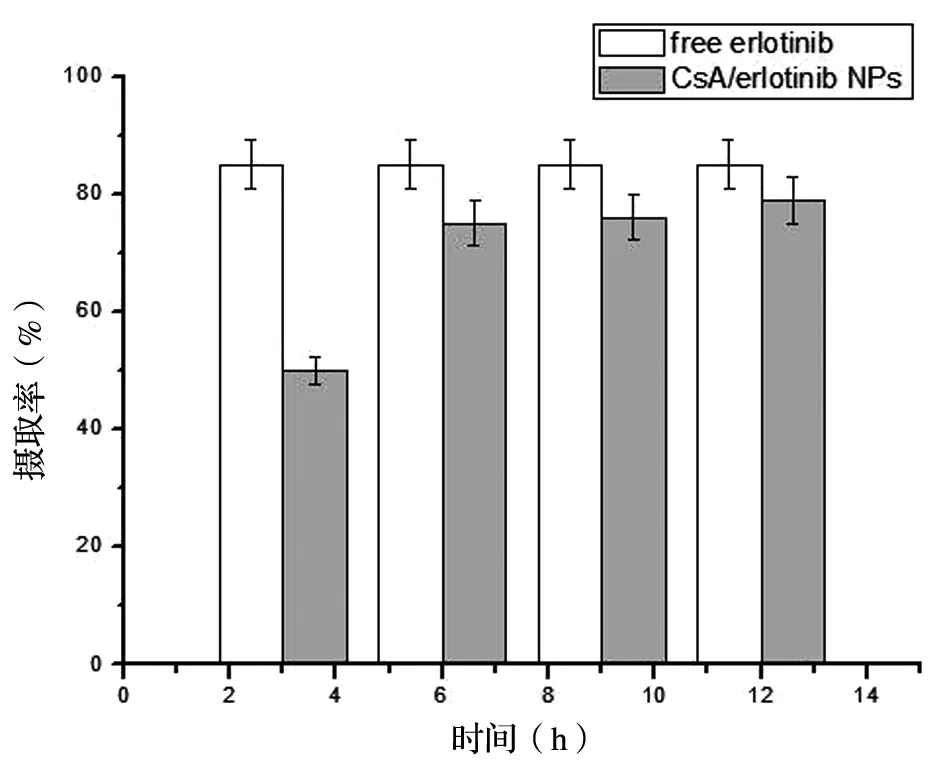
图4 erlotinib和CsA/erlotinib NPs在Hela细胞中的荧光定量
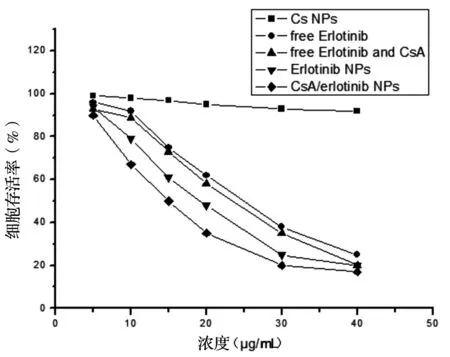
图5 Cs NPs及CsA/erlotinib NPs对耐药Hela的细胞活力
综上所述,CsA/erlotinib NPs能够将二者同时靶向到肿瘤部位,实现共载后能够增加erlotinib的敏感性,将有助于克服宫颈癌化疗时出现的耐药现象,增加了化疗药物抗肿瘤的效果,这将为以后新药开发提供新研究思路。
