金纳米星诊疗剂的光热特性及其在光热治疗和光学相干层析成像中的应用研究
2022-03-29陆冬筱李金华
吴 哲,陆冬筱 ,李金华
(1.长春理工大学 物理学院 吉林 长春 130022;2.纳米光子学与生物光子学吉林省重点实验室,吉林 长春 130022)
1 引 言
在过去的几十年间,人们对于癌症的研究方式有了巨大的转变。治疗和诊断相结合的诊疗一体化已经成为癌症诊疗研究的热点。实现诊疗一体化不但可以实时精确地诊断病情,也能够同时加以治疗,从而获得良好的治疗效果[1]。
光热治疗作为一种新兴的微创治疗癌症方法,是利用纳米粒子吸收光能转化为热能,引起肿瘤部位温度升高,杀死癌细胞的方法[2],在恶性肿瘤治疗中具有潜在的应用价值[3]。以各种材料开发的光热剂作为引导光热治疗的关键媒介也逐渐被研究人员报道[4-6]。如碳基纳米材料[7]、硫化铜纳米材料[8]和过渡金属硫化物[9]等。在这些被开发的光热剂中,金纳米粒子因为具有独特的局域表面等离子共振(LSPR)特性[10],使其在受激光辐照时对光的吸收性能增强,并能够将吸收的光能高效转化为热能,因此是一种有潜力的光热剂材料。此外,由于金纳米粒子较好的生物兼容性[11]、高稳定性和较为简单的表面功能化[12-13]的特点,更使其作为一种出色的生物医疗材料而受到关注。研究者们已经设计了许多种金纳米结构,如金纳米棒[14]、金纳米壳[15]、金纳米笼[16]和纳米球[17]都已被证明在近红外区具有等离子体共振特性,并可在近红外激光照射下产生热量从而杀死癌细胞。
光学相干层析成像(OCT)是一种新兴的成像技术,可以在保持较高分辨率的情况下对微米级别的生物组织进行成像[18]。由于OCT技术具有非接触、无损伤、图像分辨率高且操作简单的优点[19],研究人员不断开拓OCT在生物成像上的应用[20]。最早期Wang等人利用光学多普勒层析成像技术实现了对血管的无创造影[21]。之后,人们逐步开发了许多有针对性提高OCT成像效果的造影剂作为辅助,比如聚吡咯纳米粒子[22]、金、银等贵金属纳米粒子[23-24]。其中,金纳米材料被人们开发出了多种形貌用于研究其造影性能。
为了达到更好的诊疗效果,实现高效诊疗一体化,本文将光热治疗与OCT成像相结合,并选用金纳米材料作为诊疗剂。利用金纳米材料尖锐尖端的电场增强特性[25-26],设计制备多尖刺状结构的金纳米星(Au Nano Stars, AuSTs)材料,以提高其表面等离子体共振效应,进而提升基于金纳米星诊疗剂的光热治疗效果和OCT成像效果。研究结果显示制备的金纳米星诊疗剂具有优异的光热特性和生物兼容性,其光热效率达到42%,将制备的金纳米星诊疗剂用于乳腺癌细胞的光热治疗,癌细胞存活率低至37%。同时,制备的金纳米星诊疗剂具有优异的OCT成像造影特性,在癌症诊疗一体化领域具有较好的应用前景。
2 实验部分
2.1 材料和试剂
柠檬酸三钠(C6H5Na3O7·2H2O, 99%, Alfa Aesar)、盐酸(HCl, 分析纯, 北京化工厂)、氯金酸(HAuCl4·4H2O, 99.99%, Alfa Aesar)、硝酸银(Ag-NO3, 99%, Alfa Aesar)、抗坏血酸(AA, 分析纯, 国药集团上海试剂有限公司)、高糖培养基(DMEM,CORNING)、磷酸盐缓冲液(PBS, Solarbio)、噻唑蓝(MTT, C18H16N5SBr,Alfa Aesar)。
2.2 金纳米星诊疗剂的制备
金纳米颗粒(种子液)的制备:首先配制100 mL浓度为1mM的HAuCl4溶液,加热至沸腾后,向其中加入15mL质量分数为1%的柠檬酸三钠水溶液。在保持体积稳定的情况下,持续沸腾15 min之后自然冷却至室温,得到了AuNPs,将其作为种子液,在4℃保存备用。
金纳米星的制备:向10 mL浓度为0.25 mM的HAuCl4溶液中加入20 μL浓度为1 M的HCl 溶液。在中速搅拌的条件下加入100 μL种子液。同时迅速加入100 μL浓度为2 mM的Ag-NO3溶液和50 μL浓度为100 mM的抗坏血酸溶液。1 min后混合溶液从浅红色变为蓝黑色,说明反应完成。立即进行3 000~5 000 r/min离心。然后使用去离子水进行分散。4℃保存备用。
2.3 金纳米星诊疗剂的表征
使用透射电镜(TECNAI G2 20 S-TWIN,FEI)和X射线衍射分析仪(D8 Advance,布鲁克)观察金纳米星的形貌和结构,使用紫外-可见分光光度计(UV-Vis,UV-2450,岛津)测定金纳米星的吸收光谱,使用粒度分析仪(ZetaSizer,Malvern)测定样品尺寸,808 nm激光器(长春新产业技术有限公司)用于材料的光热特性和体外光热治疗研究,酶标仪(M200PRO, Infinite)用于测定细胞存活率时的吸光度,光学相干层析成像仪(Telesto-1 325 nm, ThorImage)用于OCT成像研究。
2.4 金纳米星诊疗剂的光热特性曲线测试
温度时间曲线测试:取不同溶液于离心管中,使用808 nm激光器进行照射,记录温度-时间变化曲线。
光热稳定性测试:取一定浓度的AuSTs溶液于离心管中,2 W/cm2的808 nm激光器照射,照射10 min后停止照射,10 min后再继续照射。反复5个循环,记录温度-时间曲线,并比较每个循环的最终温度。
2.5 金纳米星诊疗剂的生物兼容性测试
细胞和诊疗剂培养:将人乳腺癌细胞MCF-7接种于96孔板中。用200 μL DMEM培养基孵育24 h后,更换全新的DMEM培养基180 μL,之后向其中分别加入20 μL不同浓度的AuSTs,每个浓度设置6个孔。另有一个空白对照组,向其中加入20 μL PBS缓冲液,与细胞再培养24 h。
使用噻唑蓝比色法(MTT)对金纳米星诊疗剂的生物兼容性进行测试:向上面培养好的实验组和对照组中分别加入20 μL MTT 溶液(5 mg/mL),继续共培养4 h。移除培养基和未反应的MTT,向每个孔中加入200 μL DMSO来溶解Formazan晶体。室温下持续振荡15 min后使用酶标仪测定490 nm波长处的吸光度。计算公式如下:细胞活性(%)=实验组吸光度/对照组吸光度×100%。
2.6 金纳米星诊疗剂对乳腺癌细胞进行光热治疗实验
细胞和诊疗剂培养方法同2.5节。
对癌细胞进行光热治疗:将上面培养好的实验组和对照组更换新鲜的培养基,之后进行光热治疗实验。使用808 nm,2 W/cm2激光器对实验组和对照组分别进行照射。记录时间以保证每个孔径照射时间为10 min。之后,利用MTT法测定细胞活性:具体方法同2.5节。
2.7 金纳米星诊疗剂对模拟组织进行光学相干层析成像测试
首先,按照文献报道的方法制备了模拟组织的第二类组织体模[27]。具体制备方法如下:将0.2 g聚乙烯醇(PVA)加入至10 mL煮沸的去离子水中,并向其中加入4 mL AuSTs溶液。在沸腾状态下持续搅拌30 min后,倒入模具中,进行光学相干层析成像观测。
随后,采用鲫鱼眼部作为真实生物组织,进行前房注射AuSTs溶液,观察注射前后的OCT成像变化。
3 结果和讨论
3.1 金纳米星材料的表征
在制备AuSTs的过程中,为了实现其刺状结构与尺寸的一致性控制,探究了不同Ag+浓度对AuSTs形貌的影响。对制备的AuSTs进行了表征(图1)。图1(a)、1(b)和1(c)分别是Ag+浓度为1 mM、2 mM和4 mM制备所得AuSTs的透射电镜照片,可以看出随着Ag+浓度的增加对于AuSTs的尺寸没有明显的影响,但随着Ag+的浓度增加,在Au的球核上长出的尖刺变得更多、更长且更尖。图1(b)的插图为枝状结构的高分辨透射电镜照片,经测量,其晶格间距约为2.03 Å左右,与Au的(200)晶面对应,说明已经制备出多枝状的金基纳米星材料(AuSTs)。图1(d)为AuSTs的XRD图谱,可以看出样品的衍射峰与标准卡片对应,且衍射峰较强,这说明本文制备的AuSTs材料的结晶性较好。对AuSTs进行了粒径分析,其直径在70 nm左右(图1(e)),这个尺寸适合细胞光热治疗实验。对制备的AuSTs进行了吸收光谱表征,AuSTs在500~900 nm具有一个较宽的吸收波段(图1(f)),吸收峰位于780 nm处,在808 nm处也有较强的吸收,这有利于其在基于近红外光的光热治疗中的应用。

图1 金纳米星的表征。Ag+浓度分别为(a)1 mM,(b)2 mM和(c)4 mM金纳米星的透射电子显微镜照片。(d)金纳米星的XRD图谱。(e)金纳米星的粒径分析。(f)金纳米星的吸收光谱Fig.1 Characterization of AuSTs.Transmission electron micrographs of gold nanostars with Ag+ concentrations of (a) 1 mM,(b) 2 mM and (c) 4 mM.(d) XRD patterns of AuSTs.(e) Particle size of AuSTs.(f) Absorption spectra of AuSTs
3.2 金纳米星诊疗剂的光热性能研究
本文首先研究了激光器功率对材料光热性能的影响,如图2(a)所示。结果显示,随着激光器功率密度的增加,AuSTs的光热性能有了明显的提高。随后对不同Ag+浓度所制备AuSTs的光热性能进行了探究。结果显示,由于Ag+浓度为2 mM时制备的AuSTs在808 nm处具有最高的吸收强度,所以也具有最好的光热效果,其温度极限达到了56.9℃(图2(b))。肿瘤细胞的敏感温度为50℃,在这一温度环境下,肿瘤细胞会大量死亡,所以制备的金纳米星诊疗剂可以用于对肿瘤细胞进行光热治疗。然后,研究AuSTs诊疗剂浓度对光热效果的影响,随着AuSTs浓度的升高,AuSTs溶液的升温速率和极限温度也在进一步提高(图2(c))。在对不同形貌的金纳米材料的光热性能研究的结果显示,与水相比,金纳米材料在激光照射10 min后,具有明显的光热效果,而AuSTs的升温速率和极限温度要明显高于AuNPs(图2(d))。此外,研究了AuSTs诊疗剂的光热稳定性,结果如图2(e)所示,可见,每次光照后样品均能升高到相近的温度,升降温速率也基本保持不变,说明制备的AuSTs诊疗剂的光热稳定性较好。依据公式计算了AuSTs的光热转换效率,如下:其中,TMax代表激光照射过程中的最高温度;TSurr代表环境温度;MD为溶液质量,CD为溶液比热容;τs代表特征热时间常数;h为传热系数;S为样品容器表面积;I为激光功率;Aλ为在某处波长的吸光度;QDis为样品容器和溶剂所吸收的能量。
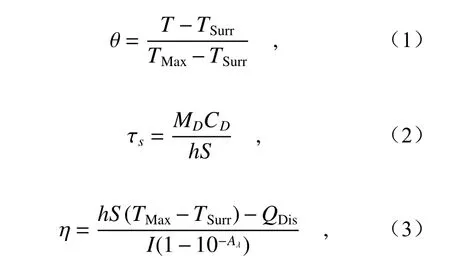

图2 金纳米星的光热性能测试。(a)AuSTs在808 nm激光不同功率密度下的温度-时间曲线。在808 nm,2 W/cm2激光照射下。(b)不同Ag+浓度制备的AuSTs的温度-时间曲线。(c)不同浓度金纳米星的温度-时间曲线。(d)AuSTs、AuNPs和去离子水的温度-时间曲线。(e)金纳米星系统的光热稳定性测试。(f)金纳米星系统的特征热时间常数Fig.2 Photothermal property of AuSTs.(a) Temperature-time curves of AuSTs at different power densities.Under 808 nm,2 W/cm2 laser irradiation.(b) Time-temperature curve of AuSTs prepared with different Ag+ concentrations.(c) Temperature-time curves of AuSTs at different concentrations.(d) Temperature-time curves of AuSTs, AuNPs and DI Water.(e) Photothermal stability of AuSTs.(f) Graph of cooling period of the time versus negative natural logarithm of the temperature
具体计算过程如下:选取图2(c)中降温过程,根据公式(1)和温度T计算出θ,然后以-lnθ为横坐标,时间为纵坐标作图(图2(f)),拟合直线的斜率即为系统热时间常数τs。随后带入公式(2)中计算出hS,最后根据公式(3)计算出AuSTs的光热转换效率η=42%,而实验组中的金纳米颗粒光热转换效率为36%。
金纳米星的光热效率高于金纳米颗粒是因为金纳米星比金纳米颗粒具有更多尖锐的尖端结构和更大的金核,而金纳米材料的中心核的尺寸、尖刺的长径比、尖刺的长度和数量越多,其具有的LSPR效应越强[10]。而金纳米材料的光热转换过程主要依赖LSPR效应,因此金纳米星的光热转换效率要远高于金纳米颗粒。同时,金纳米星的多尖端结构使其在近红外区存在较大的吸收截面,使入射的近红外光能够高效被吸收,以用于光热转换[28]。
3.3 金纳米星诊疗剂的光热治疗效果研究
对AuSTs诊疗剂的生物安全性进行研究,使用MCF-7乳腺癌细胞通过噻唑蓝比色法(MTT)进行了生物兼容性测试,结果如图3(彩图见期刊电子版)所示,不同浓度下,细胞的存活率均可达到80%以上,随着诊疗剂浓度的增加,细胞存活率下降非常缓慢,说明制备的AuSTs诊疗剂具有较好的生物安全性。
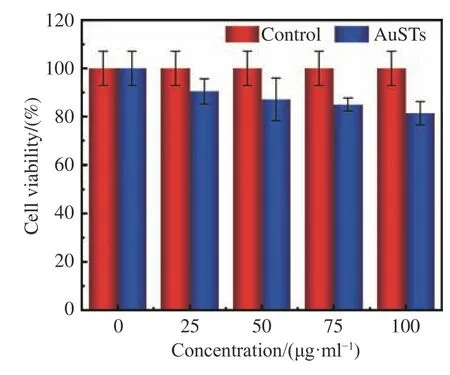
图3 金纳米星诊疗剂的生物兼容性测试Fig.3 Biocompatibility test of AuSTs
随后研究了不同浓度的AuSTs诊疗剂对MCF-7乳腺癌细胞的光热治疗效果。如图4(彩图见期刊电子版)所示,选择808 nm,2.0 W/cm2的激光对癌细胞进行照射,在不使用AuSTs诊疗剂或不经激光照射时,对癌细胞的杀伤作用不明显。而在使用AuSTs诊疗剂并经激光照射后,对癌细胞的杀伤效果显著提高。随着AuSTs诊疗剂浓度的增加,癌细胞的存活率接近直线下降。使用浓度为100 μg/mL的AuSTs诊疗剂对癌细胞进行光热治疗后,癌细胞存活率大幅降低为37%,说明制备的AuSTs诊疗剂具有优异的乳腺癌细胞光热治疗效果。
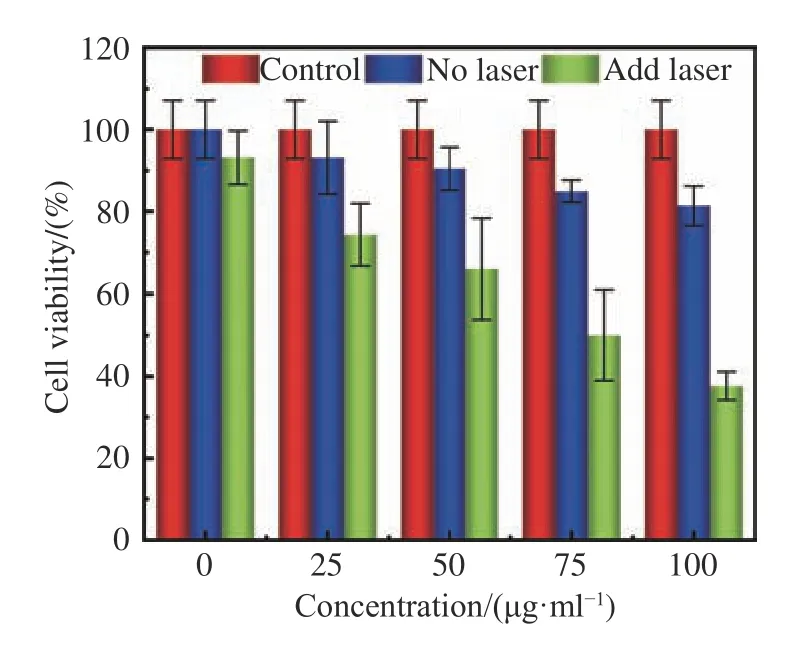
图4 金纳米星诊疗剂的光热治疗效果Fig.4 The photothermal therapy effect of AuSTs
3.4 金纳米星诊疗剂的OCT成像造影效果研究
使用聚乙烯醇(PVA)制作了模拟第二类组织体模[27]用于OCT成像研究,结果如图5(彩图见期刊电子版)所示。从图5(a)、图5(b)和图5(c)中可以看出,添加去离子水前后的组织体模的OCT图像没有明显差异,而添加了30%聚乙二醇(PEG)作为造影剂的组织体模的信号强度也没有明显提高,这说明去离子水没有造影效果,而PEG作为一种常用的造影剂在30%浓度下的造影效果也不如AuSTs理想。在使用AuSTs诊疗剂后,组织体模的OCT成像效果显著提高,而且成像深度也有较大提升,可以达到近2 mm。此外,对于图5(a)、图5(b)和图5(c)中框选区域的信号强度进行了统计可以发现,在深度测量范围内,使用AuSTs诊疗剂后样品的成像信号强度远高于不使用AuSTs诊疗剂时样品信号的强度(图5(d))。而且使用AuSTs诊疗剂后,当深度从0变化到0.8 mm时,样品的成像信号强度逐渐增强,在0.8 mm处信号最强,说明AuSTs诊疗剂在0.8 mm深度下的浓度最大,随着AuSTs诊疗剂浓度的增加,样品成像信号也逐渐变强,并且在组织体模的更深处同样有较强的信号。

图5 AuSTs作为造影剂在OCT成像中的效果。(a)加入去离子水的组织体模。(b)嵌入PEG-200的体模成像效果。(c)嵌入AuSTs的体模成像效果。(d)对(a)、(b)和(c)中框选区域的信号强度统计。鲫鱼眼部AuSTs造影剂注射前(e)和注射后(f)的OCT成像效果。(g)对(e)和(f)中框选区域的信号强度统计Fig.5 OCT imaging with AuSTs as contrast agents.OCT image of simulated tissue with (a) DI water, (b) PEG-200, and(c) AuSTs.(d) OCT signal intensity on depth of simulated tissue with DI water, PEG-200 and AuSTs.The OCT imaging effects of AuSTs in the eyes of crucian carp before (e) and after (f) injection.(g) Statistics on the signal strength of the area selected in (e) and (f)
此外,OCT也被常用于眼科疾病的诊断。本课题组利用鲫鱼眼部作为活体模型,来研究AuSTs作为诊疗剂在体内的应用。为了清晰地进行比较,先对鲫鱼眼部进行OCT成像。在图5(e)中可以清晰地看出眼部的角膜、前房和晶状体结构。而前房部位由于房水透明导致这一部位的信号强度较弱。在前房注射AuSTs作为造影剂之后,其信号强度有了明显提高(图5(f))。对框选区域进行了信号强度统计,如图5(g)所示,在相同部位信号强度有了大约10倍的提高。这说明制备的AuSTs诊疗剂是一种优异的OCT成像造影剂。
4 结 论
这项工作利用尖端结构增强金纳米材料的局域表面等离子共振特性,成功设计制备了AuSTs诊疗剂,使其在近红外区域具有优异的光热特性,其光热转换效率高达42%。此外,将制备的AuSTs诊疗剂用于对MCF-7乳腺癌细胞的光热治疗以及对组织体模进行OCT成像的应用研究。由于具有较高的光热转换效率,AuSTs诊疗剂具有较好的肿瘤光热治疗能力,当AuSTs诊疗剂浓度为100 μg/mL时,对MCF-7乳腺癌细胞进行光热治疗后,癌细胞存活率低至37%。由于具有较高的光散射特性,AuSTs诊疗剂具有较好的OCT成像造影能力,在使用AuSTs诊疗剂后,模拟组织样品的成像深度和信号强度显著提升,与空白对照组相比,添加AuSTs诊疗剂的模拟组织成像深度可达2 mm。由此可知,制备的AuSTs诊疗剂既具有高效的光热治疗能力,又具有出色的OCT成像造影能力,有望在未来多种功能协同作用的诊疗一体化平台中进行更广泛的应用。并且,金纳米粒子作为一种易于偶联修饰的纳米材料,其在多功能和高效率的生物医学领域有着非常好的应用前景。
