双蛋白酶解法制备低抗原性乳清蛋白肽及其抗氧化性能研究
2022-03-29闫蓉蓉张兆中李书国
闫蓉蓉,张兆中,李书国
(河北科技大学 食品与生物学院,石家庄 050018)
0 引言
乳清蛋白作为乳品工业中最重要的一种副产物,其主要成分α-乳白蛋白(α-LA)和β-乳球蛋白(β-LG)会引发2岁以下的儿童出现牛乳蛋白过敏现象,严重阻碍了婴幼儿的生长发育与生命安全,且婴幼儿中牛乳蛋白过敏的发病率逐年上升[1-3]。而乳清蛋白有较高的营养价值,近年来广泛应用于食品工业中生产增值营养产品,因此对于乳清蛋白的研究是很有必要的。目前脱敏技术主要有热处理、辐照处理、糖基化修饰以及酶法水解等方法[4],其中蛋白酶解能得到一些具有降血压、降血糖、抗氧化和抗菌功能的肽段[5-6]。采用酶解法处理乳清蛋白,不仅可以减控原料中致敏蛋白含量,也可制备一些功能性肽段。
本文以乳清蛋白粉为原料,通过复合酶解工艺、将酶解产物超滤分离制备低抗原性和高抗氧化活性的乳清蛋白肽段,主要采用响应面法对影响低抗原性、高抗氧化活性肽酶解的双蛋白酶复配比例、p H值、酶解温度、时间等因素进行优化,以期对低抗原性乳制品的开发提供参考。
1 材料与方法
1.1 材料与试剂
碱性蛋白酶Al kaline(200 000 U/g)、中性蛋白酶Dispase(60 000 U/g)、胰 蛋 白 酶Trypsin 1∶250(250 000 U/g)、木瓜蛋白酶Papain(800 000 U/g)、风味蛋白酶Flavourzyme(30 000 U/g)均购自北京索莱宝科技有限公司;WPC80 HS浓缩乳清蛋白粉,德国WHEYCO;铁氰化钾,天津市博迪化工有限公司;1,1-二苯基-2-苦基肼自由基(分析纯),梯希海(上海)化成工业发展有限公司;无水乙醇(分析纯),天津市富宇精细化工有限公司;盐酸(分析纯),天津市河东区红岩试剂厂;氢氧化钠、氯化钠、氯化钾、磷酸二氢钾、磷酸氢二钠、三氯化铁、三氯乙酸均为分析纯,天津市永大化学试剂有限公司;蒸馏水。
1.2 仪器与设备
HH-S6型恒温水浴锅,北京科伟永兴仪器有限公司;SHZ-B恒温水浴振荡器,上海博讯医疗生物仪器股份有限公司,FRESCO 21冷冻离心机,美国赛默飞尔公司;TGL-16C高速离心机,上海安亭科学仪器厂;Multiskan FC型酶标仪,赛默飞世尔(上海)仪器有限公司;UV-5500PC型紫外可见分光光度计,上海元析仪器有限公司;MSC300超滤杯,上海摩速科学器材有限公司;ST 2100型pH计,奥豪斯仪器(常州)有限公司;96孔可拆酶标板,美国康宁;氮气减压器,上海兴立电器仪表厂。
1.3 方法
1.3.1 水解乳清蛋白
单酶水解工艺流程:配制50 g/L的乳清蛋白溶液,于80℃下搅拌15 min,用1.0 mol/L的NaOH调节至水解酶所需p H值后,通过水浴振荡进行酶解反应(期间维持反应体系pH恒定),然后在95℃下保持10 min以灭酶,再用离心机以12 000 r/min的转速冷冻离心15 min,最后取上清液备用。
分步复合水解工艺:第一步酶解结束后立即灭酶,调节反应体系p H值并将温度降至第二步水解酶的最适温度,继续水浴振荡酶解,结束后灭酶分离取上清备用。
1.3.2 水解度的测定根据消耗的碱液量计算水解度[7],即:
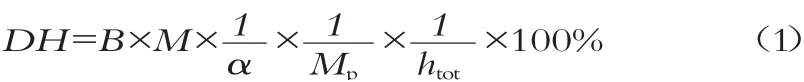
式中:B为NaOH体积,mL;M为NaOH浓度,mol/L;α为解离系数;Mp底物中蛋白质质量,g;htot为每克原料蛋白质中肽键的毫摩尔数,mmol/g;对于乳清蛋白htot取8.8 mmol/g。
1.3.3 抗原抑制率的测定
采用ic-ELISA法测定乳清蛋白的抗原抑制率,即把包被抗原稀释到一定的质量浓度,以每孔100μL包被96孔酶标板,4℃过夜放置12 h,次日倾倒孔内液体,加入150μL洗涤液PBST震荡洗涤4次,每次不少于2 min,垂直甩干板内洗涤液。按每孔100μL加1%BSA封闭液,37℃下封闭1 h,弃封闭液,PBST洗涤4次,垂直甩干板内洗涤液。用磷酸盐缓冲液PBS稀释β-LG和α-LA,并与一定稀释度的抗血清溶液均匀混合,检测样品以每孔100μL加入酶标板,37℃反应1.5 h,倾倒孔内液体,PBST洗涤4次,垂直甩干板内洗涤液。加入羊抗兔IgG辣根过氧化物酶标记抗体,每孔100μL,37℃反应1 h,倾倒孔内液体,PBST洗涤4次并甩干。加入新鲜预混的TMB双组分显色液,每孔100μL,37℃反应10 min后,每孔加入50μL的2 mol/L H2SO4终止液终止反应。
采用酶标仪双波长测定各孔的OD450和OD620值,实际OD=OD450-OD620;
样品中抗原性大小通常用抗原抑制率表示[8],本文理解为待测样品中的β-LG和α-LA抑制酶标板中的抗血清与包被在酶标板上的蛋白结合能力的大小。抑制率越小,表明样品中β-LG和α-LA含量越少,见式(2):
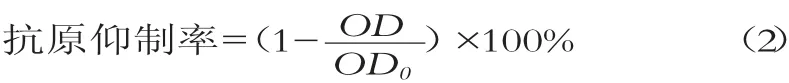
式中:OD为被测样品的吸光值;OD0为无竞争体系的吸光值。
1.3.4 抗氧化性测定
1.3.4.1 DPPH自由基清除率测定
DPPH自由基清除率计算参考文献[9]并做一些改动。配制浓度为1×10-4mol/L的DPPH无水乙醇溶液,4℃保存备用。移取2 mL乳清蛋白酶解液与2 mL DPPH溶液于试管中震荡混匀,即样品组;再取2 mL乳清蛋白酶解液和2 m L蒸馏水混合均匀,即对照组;最后移取2 mL DPPH溶液和2 mL无水乙醇溶液混匀,即空白组;将3组试管放置常温下避光反应30 min,于波长517 nm测定对应吸光值,计算公式为
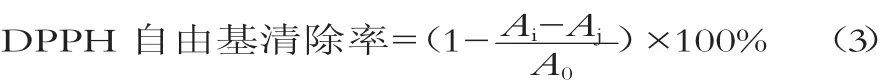
式中:Ai为样品组吸光值;Aj为对照组吸光值;A0为空白组吸光值。
1.3.4.2 还原力测定
参照韩雪兰测定方法[10]并做少许改动。测定前配制浓度0.2 mol/L(pH值为6.6)的磷酸缓冲溶液,质量分数1%铁氰化钾溶液,体积分数为10%三氯乙酸和质量分数为0.1%的FeCl3溶液。移取1 m L乳清蛋白酶解液和1 mL蒸馏水于2个试管,设置一组空白,分别加入2.5 m L磷酸缓冲溶液和2.5 mL铁氰化钾溶液震荡混匀,50℃恒温水浴20 min,迅速冷却至室温后,再次向2个试管中加入2.5 m L体积分数为10%三氯乙酸,混匀后转速为5 000 r/min离心10 min,取上清液2.5 mL,再分别加入2.5 mL蒸馏水与0.5 mL的FeCl3溶液,混匀静置10 min,波长700 nm读数,样品组减去空白组读数即为还原力。
1.3.5 蛋白酶的筛选
在乳清蛋白溶液中分别加入碱性蛋白酶、中性蛋白酶、胰蛋白酶、木瓜蛋白酶和风味蛋白酶,在合适的酶解条件下水解3 h,计算每种酶的水解度,并测定酶解产物的抗原性大小和抗氧化能力,综合选择一个最适蛋白酶作为两步复合酶解的第一步酶。
1.3.6 蛋白酶组合的选择
将确定的第一步水解酶与其余4种酶以相同酶活比复配后继续酶解乳清蛋白溶液,测定每个组合的水解度、抗原抑制率、DPPH自由基清除率和还原力,通过比较4个组合的水解效率及其功能性,选择最优一组为复合蛋白酶组合。
1.3.7 单因素试验设计
确定好最优蛋白酶组合后,选择双酶复配比例、底物浓度、酶解温度、酶解p H、酶解时间为因素进行单因素试验。其中,双酶复配比设置为1∶0.6、1∶0.8、1∶1.0、1∶1.2、1∶1.4、1∶1.6,底物质量分数设定为3%、5%、7%、9%和11%,酶解温度设定为40、45、50、55、60℃,酶解p H值设定为6.5、7.0、7.5、8.0、8.5,酶解时间设定为10,20,30,40,50,60 min。
1.3.8 响应面分析实验设计
根据单因素试验结果如图1所示,双酶复配比、酶解温度与酶解p H对水解度的影响最显著,而DPPH自由基清除率和还原力都能表示乳清蛋白酶解产物的抗氧化活性,由图2、图3可知,DPPH自由基清除率可以更明显地表达出乳清蛋白酶解产物的抗氧化活性,因此按照Box-Behnken中心组合设计原理,选择双酶的复配比、第二步蛋白酶的酶解温度和p H值得3个因素为自变量,分别以抗原抑制率和DPPH自由基清除率为检测指标,采用Design-Expert 11软件进行响应面分析,进行三因素三水平响应面优化实验,结果如表1所示。
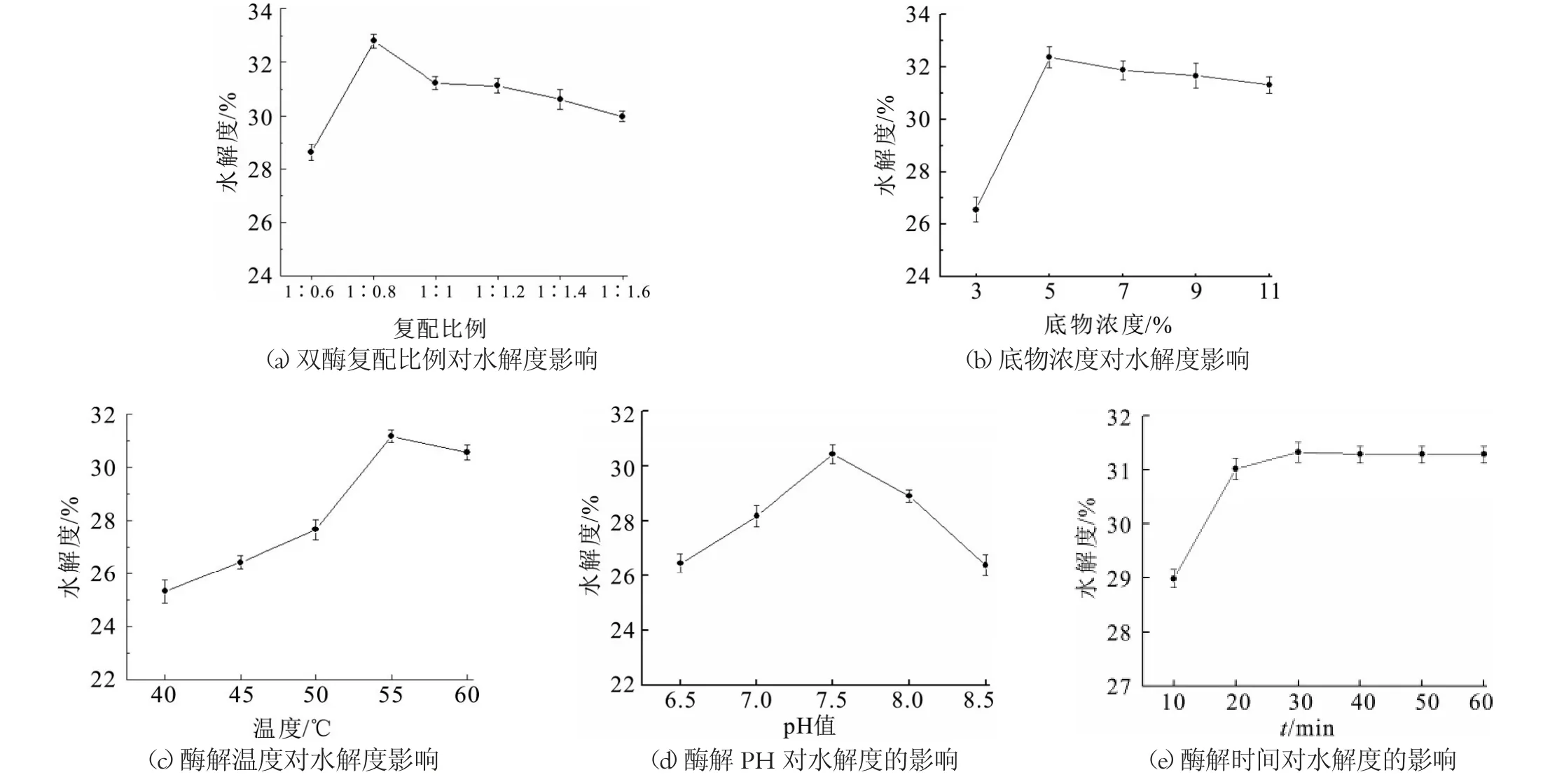
图1 不同反应条件对水解度的影响
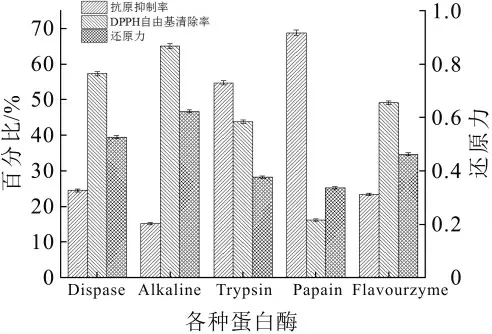
图2 不同蛋白酶对酶解产物功能性的影响
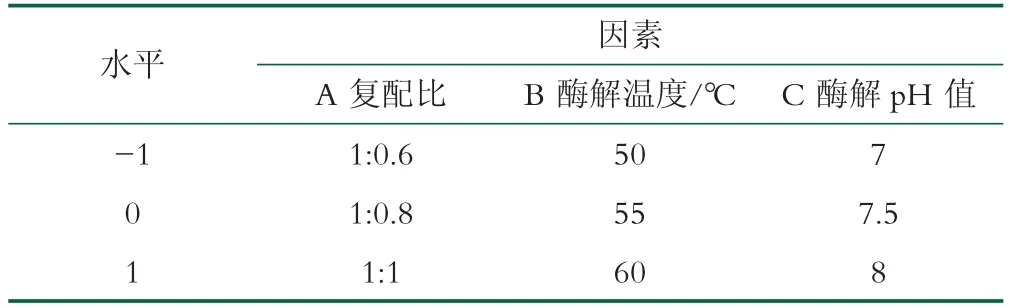
表1 两步酶解条件优化响应面实验因素与水平
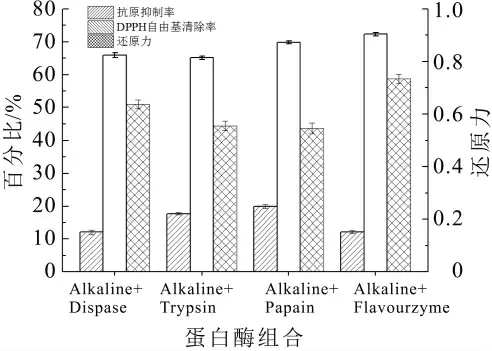
图3 不同蛋白酶组合对酶解产物功能性的影响
1.3.9 乳清蛋白酶解液的分离纯化
选取3、5、10 ku 3个不同分子截留量超滤膜,采用超滤杯分离纯化乳清蛋白酶解产物,得到不同分子量范围的肽段,进而分析各个肽段的抗原性和抗氧化能力。
1.3.10 数据分析
采用Design-Expert 11软件进行数据统计分析。
2 结果与分析
2.1 蛋白酶的筛选
水解度可直接反映了乳清蛋白的水解程度,故可作为筛选最佳水解蛋白酶的一个直观指标。图4为5种蛋白酶分别水解乳清蛋白的水解度变化,随着水解时间的延长,水解度都呈现上升趋势。其中Alkaline和Dispase在2 h内涨幅较大,Trypsin和Papain增长较为缓慢。Alkaline作用底物范围广泛,因此其水解效率相较其余4种酶最高,3 h后可达到28.85%。Dispase水解度略低于Alkaline,而Flavourzyme、Trypsin和Papain作用范围更小,只能水解一些特定氨基酸的羧基,故水解效率相对较低。

图4 不同蛋白酶对乳清蛋白水解度的影响
除此之外,乳清蛋白酶解产物的抗原性以及抗氧化性也可间接反映蛋白酶的水解效率。抗原抑制率可表示样品抗原性的大小,两者呈正比关系。如图2所示,水解度较高的酶的水解产物抑制率也较小,因此Alkaline水解后的样品抑制率最低,仅为15.4%,其次是Flavourzyme和Dispase,Trypsin和Papain的水解效率较低,裂解抗原表位能力有限,故两者抗原抑制率都较大。
本文通过DPPH自由基清除率和还原力来表征乳清蛋白肽的抗氧化能力,这两者数值越大表明酶解肽段的抗氧化活性越大。图2中,Alkaline的水解后产物的DPPH自由基清除率和还原力最大,Papain的最小,表明水解度越大,其DPPH自由基清除率和还原力也越大,反之亦然。这可能是由于水解过程中释放了较多的氨基酸残基、寡肽和多肽,提高了自由基清除活性和还原能力。综合考虑水解度和抗原抑制率以及抗氧化活性这3个指标,Alkaline的水解效率最高,作用底物更广泛,水解产物抗原性最小,抗氧化活性最高,因此选择Alkaline为分步复合酶解的第一步水解酶。
2.2 复合酶组合的确定
分步复合酶解法相较一步复合酶解法可以更好地发挥每种酶的水解特异性,达到更高的水解效率,而一步复合水解难以保证两种酶的最适酶解条件。因此将Alkaline分别与Dispase、Trypsin、Papain和Flavourzyme复配,由于碱性蛋白酶水解2 h后水解度变化缓慢,为了在较短时间内达到更好的水解效果,将Alkaline水解2 h后立即灭酶并加入另外一种蛋白酶继续水解。
如图3和图5所示,经分步酶解法水解乳清蛋白的水解度相较单酶水解度都明显提高,同时酶解产物的抗原抑制率下降,抗氧化活性提高。其中Alkaline+Flavourzyme组合后水解度高达32.0%,DPPH自由基清除率和还原力也是达到4种组合中的最大值,而抗原抑制率低至12.17%,Alkaline+Dispase组合后水解度也有30.80%,抑制率仅有12.09%,DPPH自由基清除率和还原力与Alkaline+Flavourzyme组合相差甚微。其余两种组合的水解效率以及功能性远不及前两种。Dispase与Alkaline都属于内肽酶,酶解后易形成小分子的苦味肽[11],而Flavourzyme属内、外肽酶,外肽酶可以有效切除疏水性氨基酸,使肽的苦味明显下降[12]。因此综合考虑酶解效率、酶解产物的抗原性、抗氧化活性以及滋味,最终选取Alkaline为第一步水解酶,Flavourzyme为第二步水解酶。

图5 不同蛋白酶组合对乳清蛋白水解度的影响
2.3 不同反应条件对水解度的影响
为了得到低抗原性和高抗氧化活性的乳清蛋白肽,在Alkaline和Flavourzyme组合的基础上进行单因素试验,由于加入第二步水解酶后,其酶解产物功能性变化较大,因此本文主要控制第二种水解酶的单因素条件。
(1)双酶复配比对水解度的影响:复合水解中两种酶的复配比例对水解效率有一定影响,由图1(a)可得,随着复配比例增加,水解度呈先增大后减小趋势。当Alkaline和Flavourzyme酶活比为1∶0.8时,水解度达到最大,此时酶与底物充分反应,达到最高的酶解效率,但随着Flavourzyme加酶量的增加,酶解达到饱和,水解度降低,酶解效率也随之下降。故选择1∶0.8为Alkaline和Flavourzyme最佳复配比例。
(2)底物浓度对水解度的影响:底物浓度反映了原料中乳清蛋白质量分数,从图1(b)可得到,在加酶量固定后,底物浓度较低时,酶解速率随着浓度增大而急剧上升,底物浓度达到5%后水解度最大。但随着底物浓度继续增加,水解度基本保持不变,说明酶与底物反应达到饱和,不再反应,因此选择5%为最佳底物浓度。
(3)温度对水解度的影响:如图1(c)所示,随着酶解温度的升高,水解度先缓慢增加再急剧增加最后缓慢下降。在较低温度时,酶活性较低,水解底物速率较慢。当温度上升55℃时,水解度迅速达到最高,此时酶活达到最大。继续升高温度会抑制酶的活性,导致水解效率降低。因此选择55℃为Flavourzyme最佳水解温度。
(4)p H值对水解度的影响:酶解过程中pH值对水解度也有较大的影响,由图1(d)可得,水解度随着溶液p H值增大呈先增大后减小的趋势,表明过酸或过碱可导致Flavourzyme活性降低,底物蛋白质水解不完全。当p H值为7.5时,水解度为30.44%达到最大,因此第二步水解过程中选择7.5作为最佳酶解p H值。
(5)酶解时间对水解度的影响:如图1(e)所示,前20 min内底物被酶快速催化,水解度迅速增大,随着时间的增加,水解度变化缓慢。当30 min以后,底物与酶反应基本饱和,水解度变化甚微,为了加快整个酶解反应进程,选择酶解时间为30 min。
2.4 响应面优化结果
根据单因素试验结果表明,底物浓度和酶解时间在乳清蛋白水解过程中变化相对比较稳定,故固定底物浓度为5%,酶解时间为30 min,选择对乳清蛋白酶解影响较大的三个因素:复配比(A)、温度(B)、p H值(C)为评价因素,根据2.1和2.2中筛选结果表明,酶解后的乳清蛋白肽的DPPH自由基清除率和还原力呈现正相关,因此选择其一作为响应面试验中抗氧化活性评价指标即可,故分别以抗原抑制率(Y1)和DPPH自由基清除率(Y2)为评价指标,采用Design-Expert 11软件进行响应面实验,结果如表2所示。

表2 响应面分析设计及结果
2.4.1 乳清蛋白酶解液的抗原性
以抗原抑制率指标建立二次响应面模型Y=11.50.9550A+1.19B+1.01C-0.4375AB+0.6125AC-0.1950C-0.1690A2+2.25B2+0.9535C2,回归与方差分析结果如表3所示。
从表3得到该模型回归极其显著(P<0.0001),失拟项不显著,且该模型R2=0.9871,R2Adj=0.9705,说明该模型具有较好的实验稳定性,可较好地预测实验结果。其中双酶复配比(A)、酶解温度(B)、酶解p H(C)极显著;二次项B2极显著,C2显著;交互项AB、AC显著。由响应曲面图6分析可得,随着各因素水平的升高或增大,乳清蛋白肽的抗原抑制率均呈现先减小后增大的变化特征。a、c图中温度等差线相比复配比和p H更加密集,表明温度对抗原抑制率影响相比另外两个因素更加显著,并且与表3中F值大小得到影响抗原抑制率的各因素主次顺序一致。
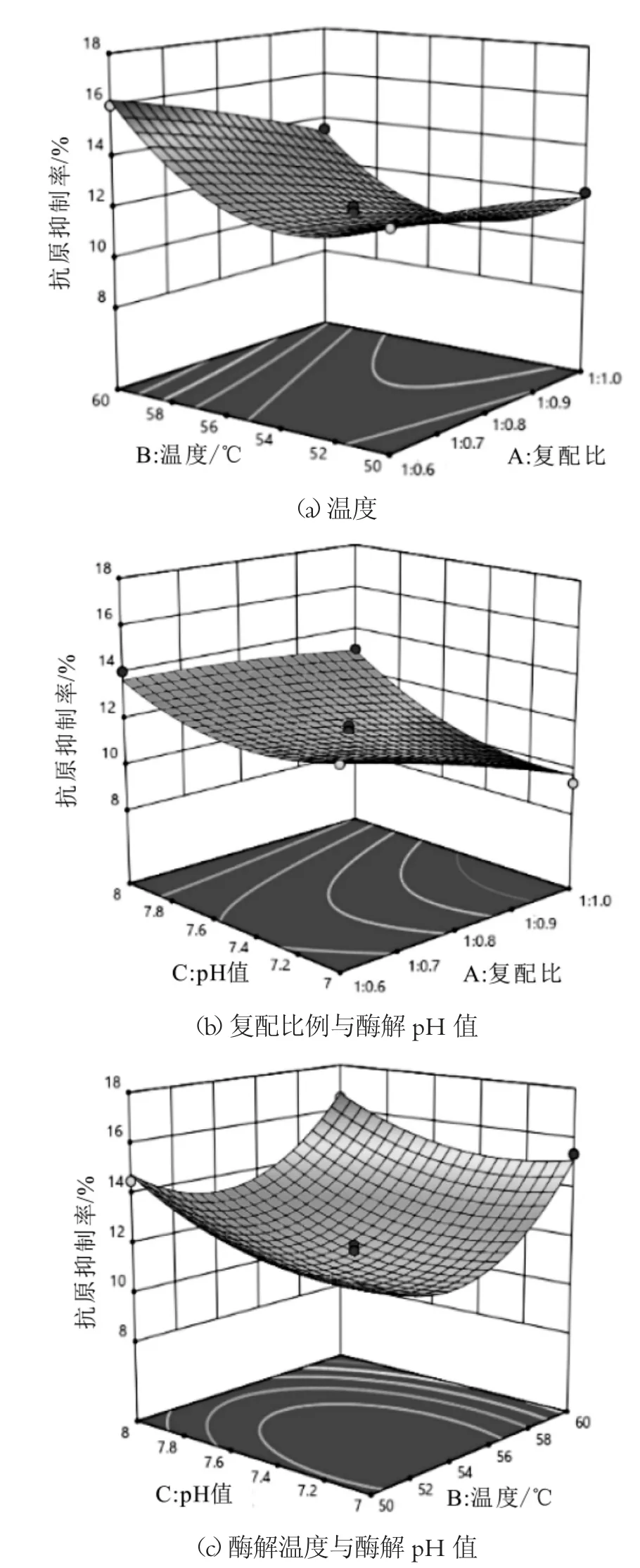
图6 响应面实验各因素对抗原抑制率的影响
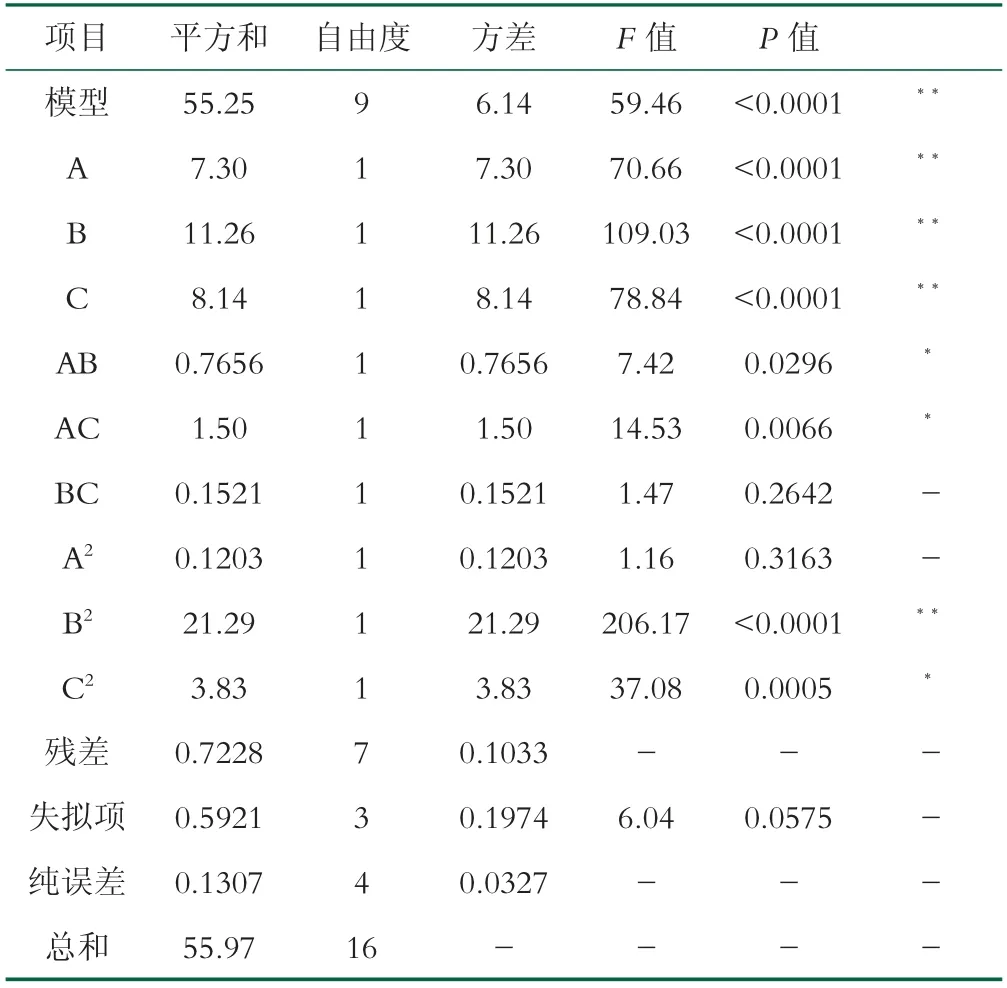
表3 抗原抑制率方差分析结果
根据响应面分析结果,回归模型预测Al kaline和Flavourzyme复合后最佳酶解条件在复配比例1∶1,酶解温度53.98℃,p H值7.06下酶解,乳清蛋白肽的抗原抑制率仅仅为9.63%。在此条件下酶解进行验证,为保证试验可操作性,将酶解温度设为54℃,p H值调至7.1,水解后检测产物的抗原抑制率为10.02%。
2.4.2 低抗原性乳清蛋白溶液抗氧化活性
通过数据分析,以DPPH自由基清除率为指标建立二次响应面模型为Y=70.19+0.3463A-3.29B-4.54C-0.1500AB-0.4675AC-2.82BC-2.78A2-0.8418B2-4.30C2,回归与方差分析结和曲面图如表4。
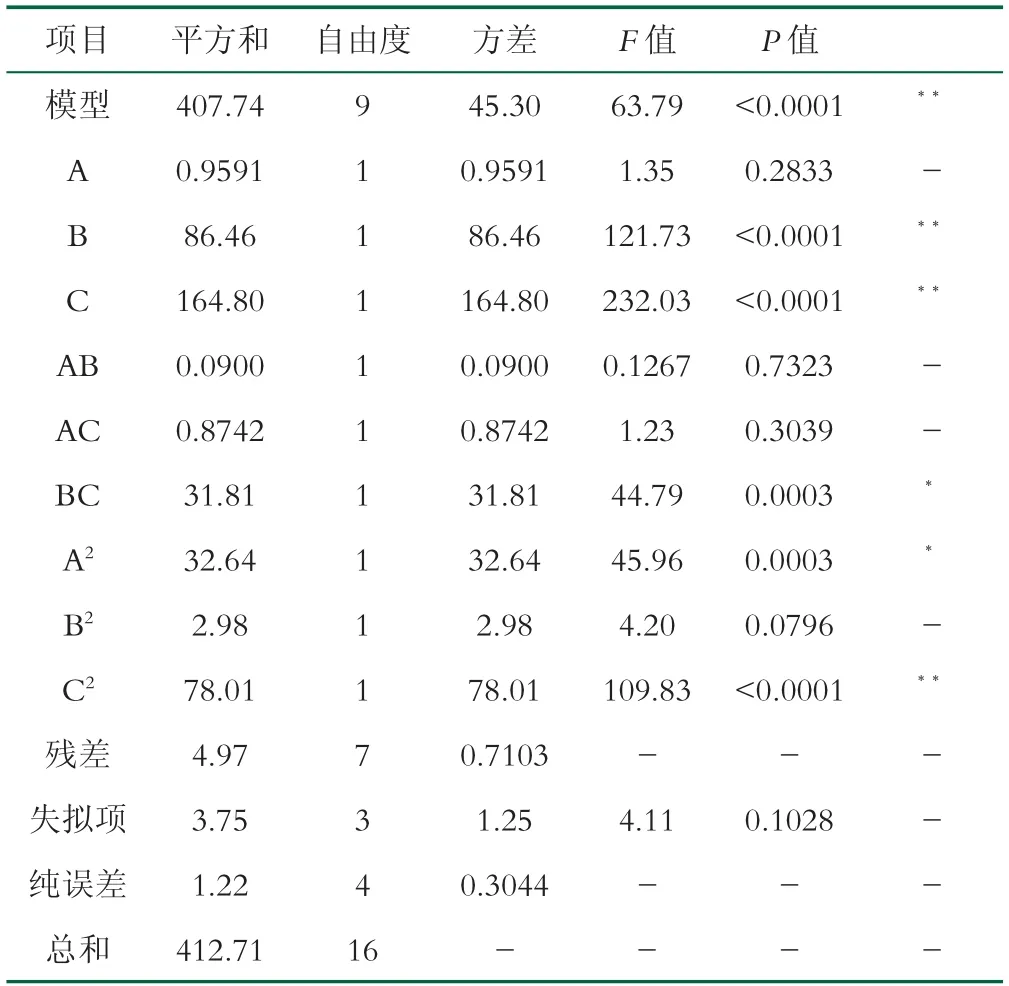
表4 DPPH自由基清除率方差分析
由表4得出该模型回归极其显著(P<0.0001),R2=0.9880,R2Adj=0.9725,表明该模型可较好地对实验结果进行预测。一次项酶解温度(B)和酶解p H(C)极显著;二次项C2极显著,A2显著;交互项BC显著,根据F值大小得到影响DPPH自由基清除率的各因素主次顺序为p H(C)>温度(B)>复配比(A)。通过图7中3组响应面及等高线的形状分析,a、b中温度和pH值等差线相比复配比更加密集,表明这两者相较复配比对DPPH自由基清除率影响更大。同时响应曲面越陡峭,等高线越偏向椭圆,表明两因素交互作用越显著,因此交互项BC对DPPH自由基清除率具有显著性。
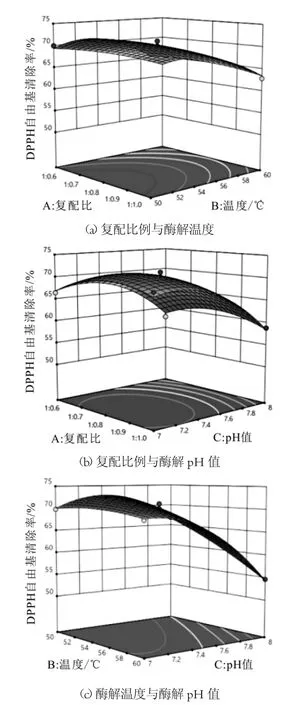
图7 各因素对DPPH自由基清除率的影响
针对DPPH自由基清除率回归模型预测最佳酶解工艺条件是复配比1∶0.8,温度50℃,pH值7.40,并且DPPH自由基清除率可达到72.84%。在此条件下平行实验3次验证,得到乳清蛋白肽段的DPPH自由基清除率为71.69%,两者相对误差仅有1.58%。
2.5 不同分子量乳清蛋白肽段的功能性
通过不同截流量的超滤膜分离乳清蛋白肽,得到小于3 ku,3~5 ku,5~10 ku和大于10 ku的4种肽段并测其功能性,其中抗原性大小和抗氧化活性分别在其最优酶解条件下酶解得到的水解产物中测定。
如图8所示,不同分子量范围的乳清蛋白肽的抗原抑制率相差甚大,其中分子量越小,抗原抑制率越小,反之亦然。当分子质量小于3 000 u,此时抗原抑制率仅有7.44%,而分子质量大于10 000 u时,抑制率可高达70.0%。这说明大分子量乳清蛋白肽段仍然存在较多的抗原表位,而分子量较小的酶解产物中氨基酸和短肽链居多,抗原表位较少,因此抗原抑制率较低。
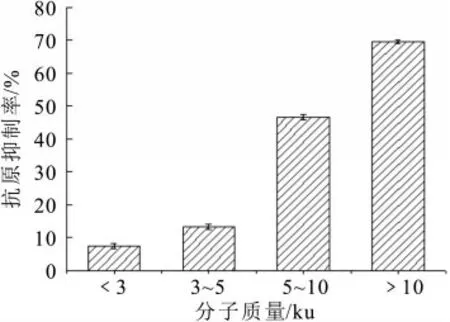
图8 不同分子质量肽段的抗原抑制率
如图9所示,分子质量越小的肽段抗氧化能力越强,小于3 ku的肽段DPPH自由基清除率和还原力都达到最大。此前有研究证明,分子量小于3 ku的多肽具有较高的抗氧化活性,更有效的清除HO·自由基[6]。这是由于分子量较小的肽段中暴露了较多的氨基酸残基从而终止自由基链反应,进而提高了清除自由基活力,而还原能力也可能是小分子质量肽段中存在较多的抗氧化活性多肽,因此表现出较强的抗氧化性。

图9 不同分子质量肽段的抗氧化活性
3 结束语
本文主要研究了复合酶法水解乳清蛋白工艺并获得低抗原性和高抗氧化活性肽段的方法。以水解度、抗原性和抗氧化活性为指标,通过单因素实验考察酶解温度、加酶量、酶解p H值、双酶复配比的影响,在此基础上,采用响应面实验对乳清蛋白低抗原性肽的制备条件进行优化。结果表明,复配比为1∶1,酶解温度为54℃,p H值为7.1的条件下水解时,水解产物抗原抑制率最低;当复配比为1∶0.8,温度50℃,pH值7.40条件下水解时,DPPH自由基清除率最高,并得出乳清蛋白肽分子量越小,其抗原性越低,抗氧化能力越强的结论。本文提出的双蛋白酶酶解法可有效降低乳清蛋白中地抗原性,并获得低抗原性和高抗氧化活性的乳清蛋白肽,可为后期低过敏性功能性乳制品开发应用提供一种思路。
