颅脑超声评估宫内生长受限对新生儿脑发育的影响
2022-03-29侯留杰栗河舟吴娟王延佳杨坡肖沛刘云
侯留杰,栗河舟,吴娟,王延佳,杨坡,肖沛,刘云
郑州大学第三附属医院超声科,河南 郑州 450052;*通信作者 栗河舟 lihezhou67@126.com
胎儿生长受限(fetal growth restriction,FGR)是指胎儿在母体、胎盘等病理因素影响下未达到其应有的遗传潜能[1]。FGR影响5%~10%的妊娠,胎儿产前多普勒发生异常变化,围生期死亡率和发病率均较高[2-3]。小于胎龄儿(small-for-gestational age,SGA)通常为“体格”较小的胎儿,其产前多普勒无明显变化,大多围生期结局正常[4]。FGR和SGA胎儿均表现出相似的长期适应特征,出生后亦会出现多种胎源性疾病,其中最常见、最严重的是神经系统功能障碍[5]。早发型FGR脑瘫发生率明显增高[6]。晚发型FGR常在新生儿期出现神经行为异常,这些神经功能障碍甚至会持续到学龄期和青春期[7]。少数MRI研究宫内生长迟缓对新生儿大脑结构的影响[8],但相关超声研究较少。本研究拟应用颅脑超声分析适于胎龄儿(appropriatefor-gestational age,AGA)、SGA及FGR脑发育即胼胝体长度、胼胝体-顶点长度、小脑蚓部高度、小脑蚓部前后径的差异,并探讨宫内生长迟缓、出生体重等围生期因素与宫内脑发育的相关性。
1 资料与方法
1.1 研究对象 前瞻性选取2020年4月—2021年2月郑州大学第三附属医院新生儿科收治的190例新生儿。纳入出生体重在第10~90百分位数与胎龄相匹配的新生儿96例为AGA组。出生体重<第10百分位数的新生儿94例,分为SGA组63例和FGR组31例。检查前,记录新生儿性别、胎龄、出生体重以及围生期基本情况。纳入符合FGR和SGA诊断标准的新生儿。FGR诊断标准:①出生体重/腹围<第3百分位数或脐动脉舒张末期血流消失;②出生体重/腹围<第10百分位数合并产前子宫动脉搏动指数>第95百分位数或脐动脉搏动指数>第95百分位数或脑胎盘率<第5百分位数[9]。SGA诊断标准:出生体重位于第3~10百分位数且产前多普勒正常。排除标准:先天性畸形、遗传性代谢性疾病、染色体异常、中枢神经系统异常、颅内感染、多胎及胎龄不明确的新生儿。胎龄从母亲末次月经第1天开始计算,所有病例均经早孕期超声检查确定孕周,且在中孕期进行系统超声筛查排除胎儿畸形。本研究获得郑州大学第三附属医院医学伦理委员会批准(2021-WZ-006)及新生儿监护人知情同意。
1.2 仪器与方法 采用GE Logiq e型床旁彩色多普勒超声诊断仪,凸阵探头,频率为5~8 MHz。于新生儿出生后24~48 h在安静状态下行颅脑超声检查,取平卧位,以前囟为透声窗,不断调整探头角度,做冠状切面与矢状切面连续扫查,获得颅脑超声扫查常用冠状与矢状切面声像图。观察新生儿胼胝体形态正常、无缺失后,于正中矢状切面测量胼胝体长度(膝部到压部的距离)、胼胝体-顶点长度(胼胝体膝部至第四脑室顶点连线的长度)、小脑蚓部高度(上蚓最高点与下蚓最低点之间的最大距离)、小脑蚓部前后径(第四脑室顶点至小脑蚓部后缘连线的长度),测量3次,取平均值(图1)。
1.3 统计学方法 采用SPSS 25.0软件,以Shapirowilk检验计量资料的正态性,正态分布的计量资料用±s表示,多组间比较采用单因素方差分析,两两比较采用LSD法;非正态分布的计量资料用M(Q1,Q3)表示,多组间比较采用Kruskal-Wallis秩和检验。计数资料组间比较采用χ2检验。两两比较采用Bonferroni法校正显著性水平。采用多元线性回归分析变量间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 3 组基线资料比较 3组孕产妇年龄、孕产史、产前应用皮质类固醇差异均无统计学意义(P>0.05)。FGR组与SGA组母体子痫前期人数明显多于AGA组,差异有统计学意义(P均<0.05),见表1。FGR组与SGA组新生儿出生体重较AGA组低,FGR组剖宫产率较AGA组、SGA组高,差异有统计学意义(P均<0.05)。其余指标差异均无统计学意义(P>0.05),见表2。

表1 各组孕妇孕期情况比较
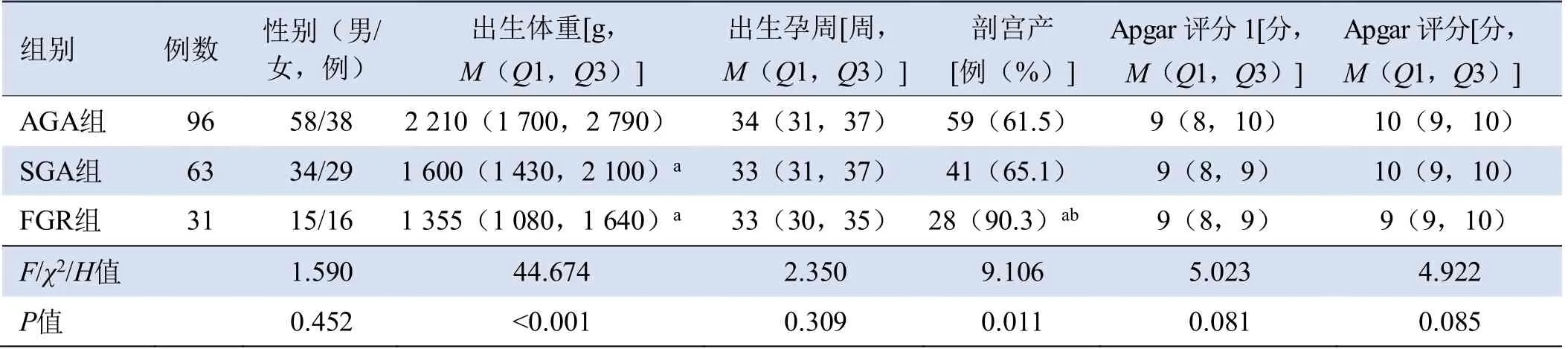
表2 各组新生儿基本情况比较
2.2 3 组新生儿各颅内结构测量值比较 FGR组胼胝体长度(t=3.121)、胼胝体-顶点长度(t=2.083)、小脑蚓部高度(t=2.801)及SGA组小脑蚓部高度(t=3.451)均小于AGA组(P<0.05)。SGA组胼胝体长度、胼胝体-顶点长度与AGA 组比较,差异无统计学意义(P>0.05)。FGR组、SGA组及AGA组小脑蚓部前后径差异无统计学意义(P>0.05)。FGR组与SGA组各颅内结构测量值差异均无统计学意义(P>0.05),见表3。
表3 各组新生儿颅内结构测量值比较(mm,±s)

表3 各组新生儿颅内结构测量值比较(mm,±s)
注:AGA为适于胎龄儿,SGA为小于胎龄儿,FGR为胎儿生长受限;与AGA组比较,aP<0.05;与SGA组比较,bP<0.05
组别例数胼胝体长度胼胝体-顶点长度小脑蚓部高度小脑蚓部前后径AGA组 96 37.51±3.40 42.62±3.72 20.76±2.90 12.52±2.20 12.35±1.86 FGR组 31 35.38±3.97a 41.07±3.77a 19.17±2.85a 12.02±1.88 SGA组63 36.46±2.77 41.49±3.32 19.23±2.40a F值5.414 3.079 7.609 0.717 P值 0.005 0.048 0.001 0.490
2.3 新生儿各颅内结构测量值与围生期因素的关系随着出生体重增加,AGA、SGA及FGR新生儿各颅内结构测量值亦逐渐增加,胼胝体长度、胼胝体-顶点长度、小脑蚓部高度、小脑蚓部前后径均与出生体重呈正相关(P<0.05)。在调整出生体重、子痫前期、剖宫产等混杂因素后,宫内生长迟缓与新生儿脑发育仍有相关性(P<0.05),见表4。
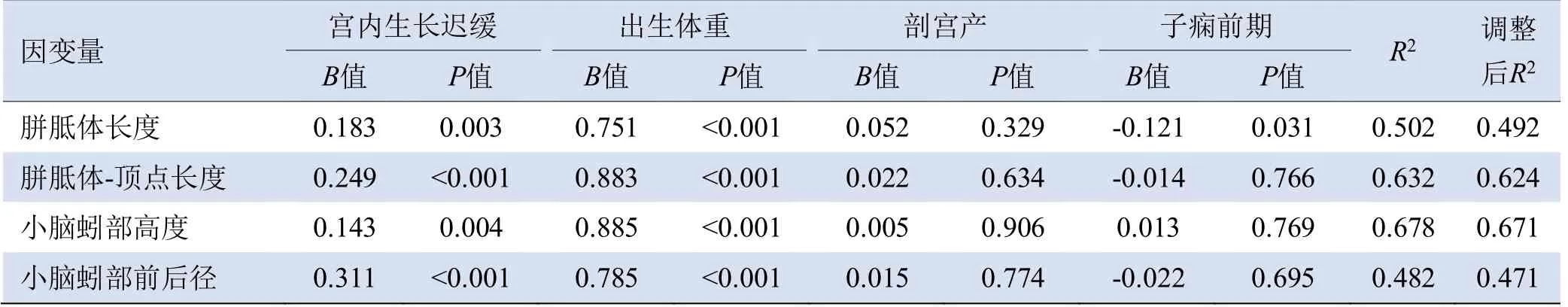
表4 围生期因素与各颅内结构测量值的多元线性回归分析
3 讨论
3.1 宫内生长迟缓与脑发育 新生儿胼胝体(幕上)是大脑中央连接两侧大脑半球的最大的白质结构,能够在两侧大脑半球之间进行信息传递,是大脑皮层的重要信息传导和储存介质[10-11]。小脑蚓部(幕下)是两侧小脑半球间的主要结构,与脊髓和幕上结构之间均存在关键连接[12]。因此,小脑蚓部和胼胝体的生长情况可以代表脑发育的总体情况。
Paules等[13]通过颅脑超声证实FGR胎儿胼胝体长度明显短于AGA。MRI评估FGR胎儿胼胝体发育与神经发育结局的关系,证实胼胝体长度越短,神经行为评分越低[14]。本研究发现FGR胎儿出生后胼胝体长度明显短于AGA,表明FGR胎儿因子宫内环境如慢性缺氧等而发生脑结构改变。FGR脑血流优先再分布可能是对脑损伤的无效保护反应,更准确地说是FGR严重程度的指标之一。
小脑发育从胚胎时期一直延伸至出生后第一年,漫长的发育过程使小脑更容易出现发育障碍[15]。既往研究证实在胎龄≥34周新生儿中,SGA的小脑发育明显落后于AGA[16]。本研究结果表明FGR与SGA组小脑蚓部高度均明显低于AGA组,提示宫内生长迟缓胎儿长期慢性的宫内缺血缺氧,脑血流的代偿不足以维持神经系统的正常发育。发育不成熟的大脑对缺氧、低血糖及酸中毒等损伤因素十分敏感,母体子痫、胎盘功能不足等使FGR胎儿处于更加不利的宫内环境中,引起大脑神经元迁移,髓鞘形成延迟及小脑神经元细胞减少。
FGR胎儿出生后大脑容积、胼胝体、小脑和皮质不同区域灰质的发育受损持续1年左右,且运动和适应行为评分较差[17-18]。胼胝体-顶点长度作为一种监测脑发育的新指标,是间脑、中脑和小脑蚓部生长发育的综合评估标志,且可重复性高[19]。一项产前(孕22、26、32周)和产后(孕42周)进行的三维超声研究发现,FGR的胼胝体-顶点长度生长曲线较AGA显著降低[20]。产前多普勒异常的FGR胎儿出生后胼胝体-顶点长度亦明显短于AGA[21]。这均与本研究结果一致,但上述研究纳入样本量少,且未纳入SGA,未深入分析SGA与AGA脑发育的差异,可能对评估宫内生长迟缓脑发育差异造成一定的偏倚。本研究将190例病例进一步分为FGR、SGA与AGA,对宫内生长迟缓导致的脑发育差异有一个更准确、更完整的评估。
3.2 宫内脑发育的影响因素 本研究结果显示,胼胝体长度、胼胝体-顶点长度、小脑蚓部高度、小脑蚓部前后径均与出生体重呈正相关,提示胎儿宫内脑发育是一个动态过程,可通过颅脑超声进行实时动态监测,为临床及时干预提供依据。在调整出生体重、子痫前期、剖宫产等混杂因素后,宫内生长迟缓与宫内脑发育仍有较大的相关性,提示宫内生长迟缓是胎儿宫内脑发育的重要影响因素,临床医师应注重加强FGR孕母围生期保健,控制FGR孕母的血压,监测脐带及胎盘情况,在FGR胎儿出生后尽早采取干预措施及康复治疗,并进行长期神经发育随访。
3.3 本研究的局限性 纳入新生儿样本量相对较少,未深入分析孕妇临床信息,未连续评估产前脑发育状况,未来需要扩充临床研究样本证实宫内脑发育的影响因素。此外,还需要进一步评估宫内生长迟缓影响脑发育的机制,并随访这些受影响新生儿进行长期神经发育结局。
综上所述,FGR新生儿脑发育明显落后于AGA,颅脑超声对评估FGR新生儿脑发育差异有重要临床价值,可为临床医师进行早期神经发育干预及康复治疗提供理论依据。
