硫化氢对骨与关节保护作用机制的研究进展
2022-03-29张博文闫景龙
张博文,闫景龙
(哈尔滨医科大学附属第二医院脊柱外科,黑龙江 哈尔滨 150086)
硫化氢(H2S)是一种无色、具有典型臭鸡蛋气味的有毒气体[1]。近几十年来,许多文献已经报道H2S存在于生物系统中并具有多种生物学功能,其中最主要的功能是维持生理稳态。它和一氧化氮、一氧化碳一样是组织系统中内源性释放的气体递质[1],在大脑、心脏、肾脏、胃肠道、骨骼肌和骨骼中产生[2]。在哺乳动物组织中,H2S主要在同型半胱氨酸代谢的转硫途径中内源产生,其中胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)和胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)是生成H2S的两种关键酶[2]。H2S不仅仅是这一途径的二次反应产物,而且是调节多种组织生理功能的重要因子。
H2S的合成和分布取决于组织特异性,CBS主要在骨髓间充质干细胞(bone mesenchymal stem cells,BMSC)、中枢神经、回肠、肾脏及胰岛中表达,CSE主要在心脏、肾脏、血管内皮和血管平滑肌中大量表达[3]。有报道指出,H2S通过调控BMSCs的表观遗传分化来维持骨骼合成代谢及稳态[3-4],这表明了H2S对骨的保护作用。还有研究表明H2S是免疫系统中维持T细胞内稳态的重要介体[5-6],它不仅可以起到抗氧化、抗炎,还具有平衡氧化还原和诱导抗氧化应激转录因子核因子E2相关因子2(nuclear factor erythroid 2-related factor,Nrf2)的作用[5,7],表明了H2S能够抗炎症性关节炎,体现了其对关节的保护作用。本文综述了H2S对骨骼及关节的保护作用及其分子机制。
1 H2S通过抑制JNK-p-DNMT1通路抵抗高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)导致的骨质丢失
H2S作为一种内源性气体递质,具有抗炎、抗氧化和抗细胞凋亡的作用,与骨骼发育密切相关。H2S的生理和病理作用的相关研究清楚地解释了H2S在骨骼疾病中的骨保护作用[1,3-4]。骨质疏松症是一种以骨吸收和骨形成(破骨和成骨)失衡为特征的骨骼疾病。甲硫氨酸的过量摄入往往会导致骨骼脆弱而增加骨折的风险[8]。甲硫氨酸代谢途径的紊乱会导致血清同型半胱氨酸升高,引起HHcy,它是一种涉及CBS的常染色体隐性疾病[8]。研究表明,H2S在逆转HHcy诱导的骨丢失中有重要作用[9]。实验人员以高甲硫氨酸饮食喂养小鼠,降低内源性H2S产生,诱发小鼠产生HHcy,HHcy激活C-Jun/JNK-p通路并进一步调节转录增强DNA甲基转移酶1(DNA methyltransferase 1,DNMT1)的表达,DNMT1升高会导致破骨细胞抑制因子(osteoclastogenesis inhibitory factor,OPG)启动子过度甲基化,从而导致BMSCs分化的成骨细胞功能障碍,并且HHcy使核因子κB受体活化因子配体(receptor activator for nuclear factor-kappa Bligand,RANKL)上调,增加了破骨细胞生成和骨质流失[9]。使用硫氢化钠(H2S供体)能够抑制JNK-p-DNMT1通路,使DNMT1表达减少,进而上调OPG,从而增加成骨,这显示了H2S的骨保护特性[9](见图1)。还有研究表明,HHcy可诱导蛋白磷酸酶2A磷酸化,进而下调p38 MAPK和叉形头转录因子1(forkhead transcription factor 1,FOXO1)的表达,从而抑制OPG的合成,实验中给予N-乙酰半胱氨酸可以提高骨骼中FOXO1和OPG的水平,从而逆转HHcy介导的骨丢失[10]。调节H2S的代谢或使用H2S供体能够在治疗HHcy引起的骨质疏松方面发挥重要作用。
2 H2S通过维持组蛋白去乙酰化酶3(histone deacetylase-3,HDAC3)活性抵抗CBS缺乏导致的骨质流失
CBS表达水平在骨髓间充质干细胞成骨分化过程中升高,并发挥重要作用,由它介导生成的H2S可以维持骨髓间充质干细胞和成骨细胞的增殖和分化[11]。实验数据表明,缺乏CBS小鼠的血清和细胞内H2S水平降低,使其血浆中的同型半胱氨酸水平升高,这会导致骨髓间充质干细胞的氧化损伤和功能障碍,从而导致严重的骨质疏松[11]。有研究表明,H2S缺乏会通过增强氧化损伤来抑制HDAC3的活性,使染色质的组蛋白(H3K27ac)上的乙酰化赖氨酸残基与启动子结合,进一步降低Runt相关转录因子2(Runt related transcription factor 2,RUNX2)的成骨作用,同时转录激活炎症细胞因子白细胞介素(interleukin,IL)-6和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)[5,12]。并且研究发现BMSCs分泌的IL-6可以诱导破骨细胞分化和骨吸收[12]。因此,H2S缺乏会减弱成骨作用,增强破骨作用。在缺乏CBS的小鼠中使用H2S能够通过恢复BMSCs中的HDAC3活性来减弱组蛋白乙酰化依赖性炎症,从而促进RUNX2介导的骨形成[12](见图2)。总体而言,恢复血浆中的H2S水平可能是治疗CBS缺乏引起代谢性骨质疏松症的一种新方法。
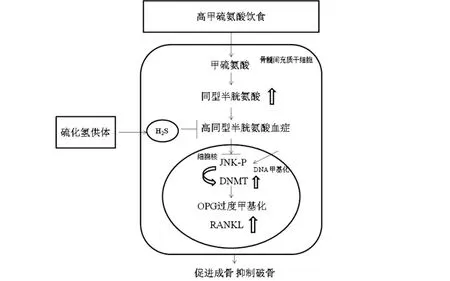
图1 H2S通过抑制JNK-p-DNMT1通路抵抗HHcy导致的骨质丢失示意图
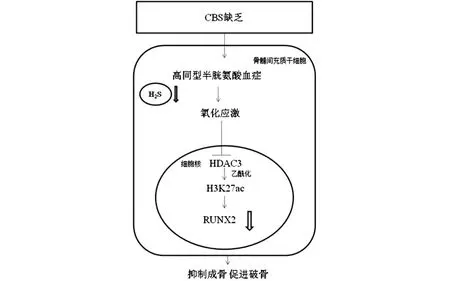
图2 H2S通过维持HDAC3活性抵抗CBS缺乏导致的骨质流失示意图
3 H2S通过调控Ca2+瞬态受体电位通道维持骨稳态
机制研究表明,BMSCs中H2S在生理水平上对维持细胞钙通道的正常功能起着关键作用。H2S缺乏使多个Ca2+瞬态受体电位通道上半胱氨酸残基的蛋白巯基化减少而导致细胞内Ca2+内流减少,而细胞内Ca2+流量水平降低进一步抑制了蛋白激酶C(protein kinase C,PKC)依赖的信号通路,使骨髓间充质干细胞的成骨分化减弱,最终导致严重的骨质疏松[11]。通过使用硫氢化钠或GYY4137(H2S供体)使体内H2S浓度达到生理水平,从而在通道蛋白硫基化过程中,反应性半胱氨酸的巯基被修饰为-SSH基团,提高了半胱氨酸残基的反应性,进而使BMSCs可以发生正常的级联反应,最终恢复正常的骨稳态[11](见图3)。总的来说,生理水平的H2S能够确保BMSCs上Ca2+瞬态受体电位通道的正常功能,以维持机体骨稳态。
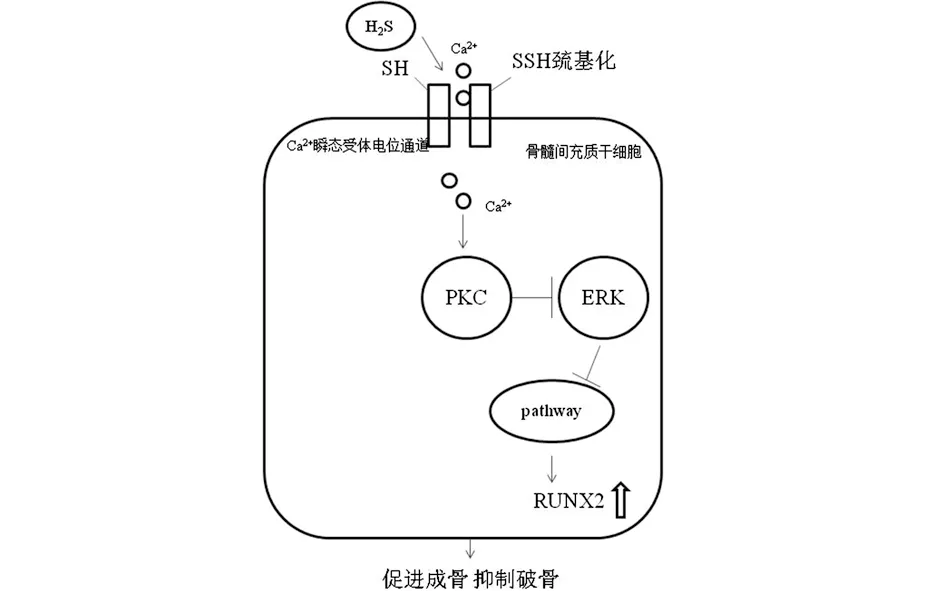
图3 H2S通过调控Ca2+瞬态受体电位通道维持骨稳态示意图
4 H2S能够抵抗雌激素缺乏导致的骨质流失
雌激素由于具有抗氧化的活性和平衡体内磷酸钙并维持骨代谢的作用,可以预防骨质疏松症[8,13]。绝经后骨质疏松症是一种常见的骨骼疾病,由于绝经后雌激素水平下降,使破骨细胞成熟而增加了骨吸收过程,最终导致骨小梁和皮质骨进一步改变,使骨质流失增加骨折风险[8,13]。有研究表明,遗传因素对于确定雌激素缺乏后小鼠的骨质流失程度很重要,此报道提出更年期期间和之后的骨丢失可能是由部分遗传因素调控的[13]。但是,仍然需要进一步地研究遗传因素控制由雌激素缺乏引起骨骼变化的机制。有研究以去卵巢大鼠为研究对象,探讨了H2S在机体缺乏雌激素的病理环境下的骨保护作用[14]。实验人员通过卵巢切除术(oophorectomy,OVX)增加破骨细胞的形成来增强骨吸收,用以模拟雌激素缺乏的病理状态[14]。通过使用GYY4137缓慢释放H2S,最终使血浆H2S水平趋于正常化,能够防止甚至逆转OVX引起的骨小梁和骨皮质改变的结果[14]。实验证明,使用H2S可以逆转由雌激素缺乏引起的骨质疏松,增加骨骼的最大应力,减少骨质疏松及相关并发症的发生[14]。实验中使用GYY4137很好地模拟了内源性神经内分泌气体信号分子H2S的骨保护作用,然而不足的是,他们没有在临床上探索GYY4137的治疗效果,所以在人体上的治疗结果可能会有所不同,并且GYY4137作用的分子机制还有待进一步研究。总体而言,恢复血浆H2S水平可能是治疗绝经后骨质疏松症的一种方法,为今后研究绝经后骨质疏松症的治疗靶点指明了方向。
5 H2S有调控细胞增殖、分化和凋亡的作用
H2S的作用与其他生长因子相似,能够通过促进骨折处干细胞的增殖和分化来启动修复过程[15]。研究报道指出在小鼠下颌骨缺损模型中,使用GYY4137可以促进骨折愈合[15]。此外,给予外源性H2S可以治疗由模拟微重力和牵张成骨等引起的骨丢失[16]。在小鼠牵张成骨模型中,给予H2S可以加速骨小梁成熟微结构的形成和矿化,取代纤维结缔组织,并改善骨痂在牵张间隙内愈合的力学性能[16]。机制研究表明,CSE是成骨细胞中主要表达促进H2S产生的酶,CSE-H2S系统作为一种新的反式激活调节剂通过使RUNX2巯基化促进细胞成骨分化,从而促进骨愈合[15]。已有报道提出H2S是各种细胞存活和凋亡的调节剂,给予H2S可以预防多种形式的应激(低氧、氧化损伤或血清剥夺)引起的细胞凋亡,促进间充质干细胞的增殖和存活[3,17-18]。例如,H2S可通过上调抗凋亡基因B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的表达来调节间充质干细胞的功能,从而减弱缺氧引起的效应[17]。还有研究发现H2S通过抑制成骨细胞(MC3T3-E1细胞)中的促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路和激活PI3K/Akt通路来防御氧化应激,保护MC3T3-E1细胞免受凋亡,起到骨保护的作用[19]。调节H2S代谢或使用H2S供体可能成为骨折的治疗方法,然而要使H2S在临床中直接给药,还需要更深入的研究和实践。
6 H2S能够诱导细胞迁移
自体内皮祖细胞和骨髓间充质干细胞在骨缺损部位的募集是诱导骨组织修复的关键[20]。内皮祖细胞还在动脉损伤后的内皮修复中起着至关重要的作用,骨髓间充质干细胞的迁移能力是新生血管和血管再生重要的因素之一[20]。H2S在两种类型的细胞中都有诱导迁移的功能,H2S的缺乏减弱了血管损伤后内皮祖细胞的动员,削弱了它们的黏附和克隆能力,CSE缺乏介导的H2S水平下降导致高糖处理的骨髓间充质干细胞迁移能力减弱,给予硫氢化钠治疗恢复了两种细胞的上述能力[21-22]。此外,实验还发现H2S增强了其他类型细胞的迁移能力,例如给予硫氢化钠能加速皮肤成纤维细胞和人类角质形成细胞的迁移,从而促进伤口愈合[22]。
7 H2S具有抗氧化和抑制炎性因子的作用
H2S是一种可以限制自由基损伤和炎症的内源性介质,是一种能够与多种氧化应激源直接反应的强还原剂,在平衡细胞氧化还原状态方面起着重要的作用[23]。此外,H2S能够对抗脂质过氧化,逆转线粒体功能障碍和增加参与细胞抗氧化防御的超氧化物歧化酶活性[23-24]。最近已经证实内源性H2S在不同的炎症性疾病中的抗氧化和抗炎特性,它能够抑制淋巴细胞和天然免疫细胞产生促炎介质,从而使促炎介质和黏附分子的表达减少[5]。在关节炎的早期阶段,氧化应激是蛋白质翻译后修饰和产生自身反应性抗体的原因,在启动炎症过程中起着关键作用[25]。促炎症细胞因子、生长因子,尤其是血管内皮生长因子在滑膜中的放大表达,增加了失调的新生血管,导致滑膜缺氧[26]。关节炎活动期的特征是血管化、氧化应激和滑膜中免疫细胞浸润,从而诱导成纤维细胞样滑膜细胞(fibroblast-like synoviocytes,FLS)肥大,最终使炎症持续,形成慢性循环,导致软骨的损伤。这使得FLS、免疫细胞和促炎细胞因子能够侵入软骨下骨,形成特征性的骨质侵蚀[27]。核因子κB(nuclear factor kappa-B,NF-κB)是破骨细胞分化和成熟进而导致关节炎骨侵蚀的关键因素,而H2S对NF-κB活性的抑制能够减少促炎细胞因子的产生[28](见图4)。研究表明,能够释放H2S的化合物诱导了基质金属蛋白酶的抑制和细胞外基质蛋白的产生,从而逆转IL-1的分解作用[24]。H2S还能下调FLS中由IL-1诱导的IL-6、IL-8、基质金属蛋白酶(matrix metalloproteinase,MMP)-2和MMP-14的表达[24]。此外,H2S还可以抑制炎性关节炎发病过程中必不可少的细胞因子TNF-α的活性[29]。这些研究表明,H2S具有对关节炎患者关节损伤的保护作用。已经有研究发现,H2S与非甾体抗炎药偶联可抑制破骨细胞的产生和成熟,这表明了H2S与非甾体抗炎药偶联用于治疗炎症性关节炎有叠加作用[30]。然而,H2S的关节保护作用并不是剂量依赖性的,有研究表明,在脂多糖刺激的小鼠巨噬细胞中,低浓度H2S(硫氢化钠200 μmol/L)可以抑制几种促炎介质(NO、NF-κB、IL-6和IL-1)的合成和激活,而高浓度H2S(硫氢化钠1 000 μmol/L)却能刺激巨噬细胞产生促炎分子[28]。H2S可以作为一种关节炎疾病中的调节性保护药物,但H2S在临床应用的方案还需要进一步的研究。
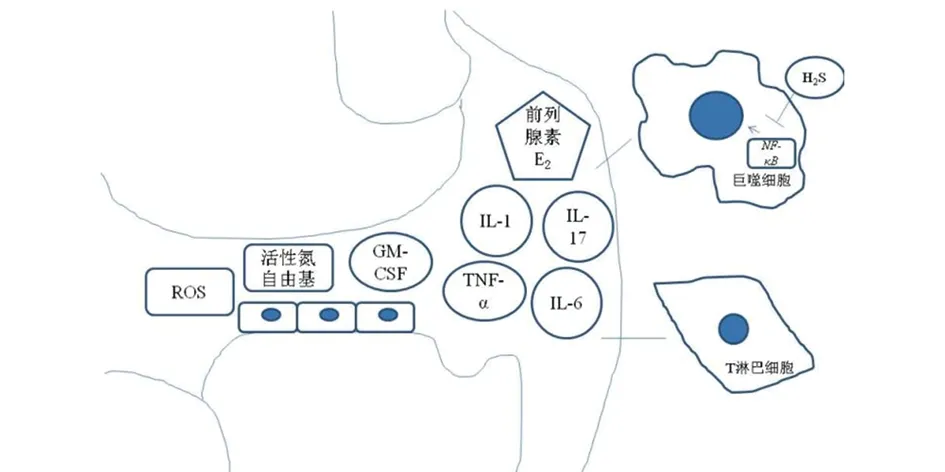
图4 关节炎中重要的致病炎性因子示意图
8 小结与展望
H2S是一种无色、具有典型臭鸡蛋气味的有毒气体,到目前为止,还没有解毒剂可用于对抗H2S毒性[1,31]。越来越多的证据证明,H2S在骨骼系统的生理和病理过程中发挥着重要的作用。已知H2S可以调节骨髓间充质干细胞的功能,确保骨骼代谢的动态平衡。在HHcy、去卵巢和骨折动物模型中,H2S对骨髓间充质干细胞的增殖、分化、功能调节起着至关重要的作用,应用H2S可以预防或逆转病理性骨丢失。机制研究表明,H2S控制着关键的细胞信号通路、蛋白质的巯基化,以及骨骼组织中染色质水平的表观遗传。此外,H2S具有抗炎和诱导受损关节组织修复作用。因此,未来的研究有必要对H2S在骨与关节中的生理和病理作用及其机制进行深入地探索,并努力找到合适的H2S供体以供临床使用,从而使H2S成为一种治疗骨与关节疾病成熟有效的药物。
