一种新型抗酸染色阳性对照在病理诊断中的应用
2022-03-29胡辛兰陈小岩
陈 昕,王 晨,陈 琦,胡辛兰,陈小岩
结核是一种由结核分枝杆菌(mycobacterium tuberculosis, MTB)引起的传染病,近年来其发病率呈增高趋势。常规病理确诊结核病,除了观察其特征性肉芽肿性病理改变外,还需找到结核分枝杆菌。病理科常规开展齐-尼抗酸染色寻找病原菌,由于其染色阳性率低,为确保质量控制,必须建立阳性对照,以确保染色结果的可靠性,然而高质量的阳性对照组织不易获得。笔者尝试用抗酸杆菌培养物和胸腹水的混合团块做成细胞蜡块作为阳性对照,取得良好效果,现介绍如下。
1 材料与方法
1.1 试剂与仪器
1.1.1试剂 10%中性福尔马林,琼脂,抗酸染色试剂(珠海贝索公司),7 mL MGIT液体培养管。
1.1.2仪器 BACTEC MGIT 960 System全自动分枝杆菌检测/药敏系统,Ⅱ级生物安全柜,高压蒸汽灭菌器。恒温培养箱,德国Hettich台式常温/冷冻离心机,日本樱花全封闭自动脱水机,赛默飞包埋机,莱卡切片机。
1.2 方法
1.2.1阳性对照品制备 本院结核培养室收集临床标本,严格按检验规程[1]进行TB菌培养操作。结果判定标准:培养有菌株生长,行抗酸染色,染色阳性则将培养物通过增菌来浓缩集菌,集菌完成后用121 ℃高压锅灭菌30 min,1 800 r/min离心10 min弃上清备用。
1.2.2琼脂的制备 取琼脂粉1.5 g+50 mL蒸馏水放入烧杯中,置于微波炉直接高火加热1 min,沸腾后切忌溢出,取出观察粉末是否完全溶解,如未完全溶解可重复加热1 min,直至完全溶解。取出后立即转移至大离心管,自然冷却后冷藏备用。临用时适量隔热水浴溶解即可。
1.2.3细胞蜡块的制备 (1)选择外观浑浊、有沉淀的恶性肿瘤胸水或腹水标本,4 ℃静置30 min,弃上清液,取50 mL底部沉淀样本注入2~4支离心管中,1 800 r/min离心10 min;弃上清,取沉淀;(2)将各离心管沉淀汇合成1管,用震荡器震荡10~20 s混匀,加抗酸培养阳性菌,再次用震荡器震荡30 s混匀;(3)加入10%中性福尔马林固定静置6~8 h,2 500 r/min离心15 min,弃上清,加溶解后的琼脂2~5滴(琼脂量根据沉淀物多少来定),震荡15 s,再次2 500 r/min离心5 min,弃上清液,取出细胞沉渣,用滤纸包埋,放入包埋盒,常规脱水后包埋备用。
1.2.4抗酸染色 石蜡组织5 μm厚切片,2缸松节油脱蜡至水,每缸10 min,滴加石碳酸复红溶液于切片上,室温染色10~15 min,水洗;沥干水分,滴加酸性乙醇溶液脱色1~2 min,充分水洗;滴加亚甲基蓝溶液染20~30 s,流水冲洗,干燥、透明、封固。
1.2.5结果判定 在淡蓝色背景下,抗酸染色阳性菌呈红色;其他细菌及细胞呈蓝色。400倍镜下连续观察50个视野,未发现抗酸杆菌者,判为阴性;每400倍视野找及1条抗酸杆菌判为阳性。
2 结果
镜下可见抗酸染色阳性菌呈红色,且菌群分布合理,背景淡蓝色且干净清晰,在中倍镜下便可观察到细菌,方便医师阅片,并加快对抗酸染色质量的评估(图1)。
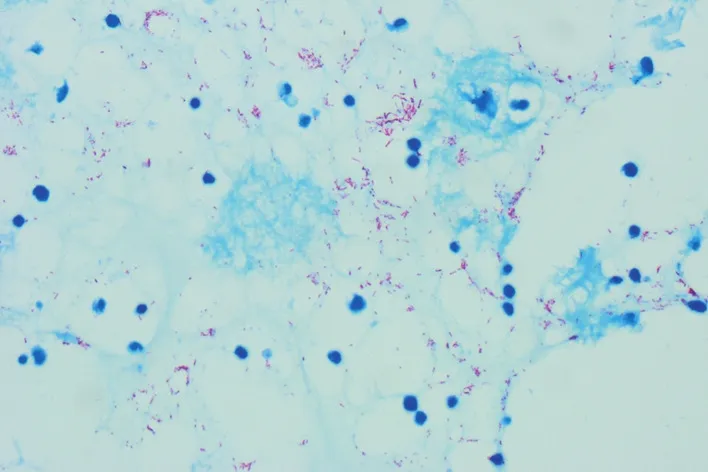
图1 细胞蜡块抗酸染色阳性
3 讨论
结核性病变的确诊依据是查找结核分枝杆菌,抗酸染色因其染色操作简单,特异性好,成本低,至今仍是病理学诊断结核病的首选辅助诊断,病理科常规开展齐-尼抗酸染色寻找病原菌,其原理是在加热条件下使分枝杆菌与石碳酸复红牢固结合形成复合物,酸性乙醇处理不易脱色,经亚甲基蓝复染后,分枝杆菌依然呈红色,突显于蓝色背景中。由于其染色阳性率低,仅达20%~40%[2],为确保染色结果的准确性和可靠性,必须建立阳性对照。然而临床要获取高质量的抗酸染色阳性对照组织非常困难,2015年方伟建等[3]提出符合抗酸阳性蜡块的标准为:抗酸杆菌丰富(杆菌量>10个/HPF),阳性菌分布均匀。但以往我院阳性对照组织常常为小标本类穿刺组织,尤其是肺穿刺标本,组织量小,菌量通常很低,并且分布不均匀,经过常规制片已有损耗,加之后期可能进行免疫组化、特殊染色、分子检测等,还要保障归档蜡块组织的完整性,即使可以当阳性蜡块使用也是为数不多,目前结核病可疑患者日益增多,阳性对照组织已无法满足日常工作需求,甚至用一张阳性对照来完成一批的待检组织染色,导致存在染色条件不一致性,降低染色结果可靠性。抗酸染色的阳性率低,对照片供应不足可能也是造成染色阳性率低的因素之一。因此获取可靠的、来源广泛的高质量抗酸染色阳性对照片显得尤为重要与迫切。
抗酸染色对诊断结核性病变具有局限性,因其除了结核分枝杆菌染色外,其它如牛分枝杆菌、禽分枝杆菌以及麻风杆菌等抗酸染色均呈阳性[4]。因此,抗酸染色阳性也不能明确结核菌感染,还需病理诊断医师仔细观察细菌形态特征,鉴别分枝状菌的形状以及组织细胞的特点,如上皮样组织细胞或泡沫细胞等鉴别,通过结合临床病理诊断提高诊断的准确性与精确性[5]。高质量的抗酸染色对病理诊断尤为重要,而阳性对照则是确保高质量抗酸染色的基础。
笔者为了解决抗酸染色的阳性对照问题,经过反复多次试验,利用恶性胸腹水和琼脂作为黏附基质从而制作抗酸杆菌阳性对照,取得较好的效果,这与2020年叶恩如等[6]报道的试验不同,他们将蛋清作为细胞基质来制作阳性对照,优点在于蛋清易得,缺点在于需要另外购买,且易污染。而本方法具有以下优点:(1)直接利用细胞室现有的恶性胸腹水,而且此类标本大多为渗出液,蛋白定量高,密度大,细胞往往黏附成团,比单纯使用琼脂作为细胞黏附基质制作细胞块,在菌体分布上,菌体包裹的更均匀,不松散,效果更佳。(2)我院有专门的结核菌培养室,有严格的生物安全措施,实验室安全有保障。抗酸杆菌(含MTB和NTM)用BD公司的MGIT960液体培养基培养,周期短,1~2周即可培养获得,要获得大量阳性菌,只要通过延长培养进行增菌即可。浓集菌经高压灭菌后放密封管可以长期备用,为病理科的后续需求提供有力保障。(3)另外,本实验中我们配合使用的是恶性胸腔积液或腹水来制作细胞蜡块。(4)通过反复多次实验,调整琼脂与胸腹水的比例,制成的细胞蜡块阳性菌大多分布均匀,菌量丰富,病理医师在镜下也易判断染色是否成功,减少阅片时间。(5)与以往采用组织蜡块作为对照不同,组织中富含多种细胞,成分较杂,而细胞蜡块里细胞成分简单,且感染阳性比例高,因此镜下更易识别阳性菌。(6)应用此法制作的细胞蜡块,一次制备可以被分割为多个小块蜡块,即可满足阳性对照的需求,又能节约染色试剂,值得推广。当然,本实验仍然有不足之处,如个别分割后的小蜡块存在菌量分布不均匀的情况,在琼脂与胸腹水的比例调整上仍在摸索最佳比例。另外由于细胞蜡块的阳性菌较多,为了防止可能交叉污染待检组织,实验时把阳性质控片放在待检片的右侧,降低操作中污染的风险。
