突变KRAS的互作化学分子研究
2022-03-28徐耀瑜丁嘉颖张雅慧赵启程张成杰司伟杰
*徐耀瑜 丁嘉颖 张雅慧 赵启程 张成杰 司伟杰
(安阳师范学院 化学与化工学院 河南 455000)
引言
癌症发生的主要原因是原癌基因的激活和抑癌基因的失活[1]。至今已观察到许多突变基因,例如RAS原癌基因家族成员——HRAS、KRAS、NRAS。其中KRAS在所有癌症中高频突变,特别是胰腺癌(98%)和结直肠腺癌(45%)[2-3]。KRAS基因编码GTPase(三磷酸鸟苷酶),结合GTP(三磷酸鸟苷),水解其为GDP(二磷酸鸟苷)。生长因子与细胞表面生长因子受体结合后,激活信号诱导GTP与KRAS结合,KRAS成为活化状态,作为分子开关来传递细胞内信号的传递[4]。
结直肠癌中KRAS突变主要为第12(G12D)或13(G13D)位氨基酸的甘氨酸被天冬氨酸取代。该突变位于磷酸结合的效应结合环内,导致了GTP水解速率降低,GTPase交替开关的活性降低,导致KRAS诱导的信号通路改变,促进肿瘤细胞的增殖及转移[5]。KRAS发生G12D突变后,招募结合其他蛋白质因子,建立异常下游通路。通过AAVS1-CRIPR Cas9定点敲入BioID-WT-KRAS和BioID-G12D-KRAS到SW48细胞,建立单基因研究系统。富集生物素化肽段,分析与野生型KRAS和突变型G12D结合的分子。
1.实验部分
(1)实验材料
人SW48细胞培养于RPMI 1640培养基,加入10%胎牛血清,2mM L型谷氨酰胺,100units/mL青霉素以及100μg/mL链霉素。通过AAVS1-CRISPR Cas9定点敲入融合基因BioIDWT-KRAS和BioID-G12D-KRAS的SW48细胞。上述细胞均置于37℃、5% CO2、湿度95%的细胞培养箱培养。
AAVS1-CRISPR Cas9系统包含AAVS1-CRISPR Cas9 clone(SH100),AAVS1 MCS donor cloning vector-Pure(SH200),5’鉴定PCR引物。Lipofectamine 3000(Thermo Fisher),生物素(Sigma),稳定同位素生物素(Iso-Sciences),G蛋白偶联琼脂糖珠(Millipore)。KRAS-4B抗体(3B10-2F2)(Sigma-Aldrich),生物素抗体(A150-109A)(BETHYL laboratories)。
(2)构建KRAS(WT/G12D)SW48细胞
将BioID-WT-KRAS和BioID-G12D-KRAS基因片段分别插入AAVS1 MCS donor cloning vector-Pure(SH200)中。测序验证正确的质粒和AAVS1-CRISPR Cas9 clone(SH100)按1:1比例,使用Lipofectamine 3000转染SW48细胞,1μM puromycin筛选一周,挑选单克隆转至96孔板,继续培养2周。5'PCR扩增,及Western blotting检测BioID-WT-KRAS和BioID-G12D-KRAS的目的条带及整体生物素标记效率,挑选正确插入基因,并且BioID-WT-KRAS和BioID-G12D-KRAS表达水平相同的SW48细胞。
(3)稳定同位素生物素标记BioID-WT-KRAS和BioIDG12D-KRAS细胞
交替标记生物素:
组1,25μM正常生物素培养BioID-WT-KRAS细胞;
组2,25μM稳定同位素生物素培养BioID-G12D-KRAS细胞;
组3,25μM正常生物素培养BioID-G12D-KRAS细胞;
组4,25μM稳定同位素生物素培养BioID-WT-KRAS细胞。
每组培养4份15cm培养皿的细胞,Western blotting验证,取组1与组2的5mg细胞裂解液混合(A),取组3和组4的5mg细胞裂解液混合(B),A、B组均4个重复,胰酶消化,-80℃冻干。
(4)LC-MS/MS检测和分析生物素化肽段
富集A组和B组中的生物素化肽段。Orbitrap Fusion Lumos质谱仪上分析肽段样品,全扫描质谱从m/z350-1,550开始,分辨率为120,000,m/z为200,AGC最大值200,000个离子,占空比为3s,最大离子测试时间设定为60ms~100ms。数据库搜索以1%的错误发现率过滤PSM。统计分析BioID-G12D-KRAS组与BioID-WT-KRAS组,差异倍数2为界限,筛选显著差异。
2.实验结果
(1)BioID-G12D-KRAS与BioID-WT-KRAS肿瘤细胞的构建
将BioID-G12D-KRAS及BioID-WT-KRAS分别插入到SH200载体,转染SW48细胞,挑选单克隆继续培养,5'PCR方法验证,最终挑选出阳性BioID-G12D-KRAS和BioID-WTKRAS的SW48细胞各一株(图1.A)。扩大培养后,更换含50μM生物素的新鲜培养基,继续培养12h,收集细胞裂解液,Western blotting检测,鉴定出BioID-G12D-KRAS和BioID-WT-KRAS的表达水平相同(55kDa),内源性KRAS的表达水平也接近(图1.B)。两类细胞的生物素化蛋白表达水平一致(图1.C)。

图1 表达BioID-G12D-KRAS或BioID-WT-KRAS的SW48细胞
(2)质谱检测及基础数据分析
两种生物素交替标记野生KRAS和G12D突变KRAS的SW48细胞(图2)。Western blotting检测到每组样本中生物素标记情况相同,进行等比例混合样本,富集生物素化肽段(图3)。

图2 生物素标记方法

图3 两种生物素标记后不同SW48细胞的生物素修饰情况
富集的肽段经LC-MS/MS检测产生8个质谱文件,通过组合数据库搜索匹配,肽段定量分析,A组识别2,918个PSM和730个生物素化肽段,去除无法识别二级质谱的肽段,得到117个生物素化肽段(420个PSM)。B组得到716个生物素化肽段(2,632个PSM),去除无法识别到二级质谱的肽段,共识别107个生物素化肽段(353个PSM)。分析过程中,参考SW48细胞的16个天然生物素化蛋白质(PC,HLCS,CTTN,MCCC1,HIST1H2BD,CMA1,PTPRO,LRRCC1,TTC24,CA2,NUDT1,HIVEP1,MAP4,FBF1,ACTB,TXNDC12)。最终筛选出BioID-WT-KRAS细胞中88种生物素化蛋白质,BioID-G12DKRAS细胞中90种生物素化蛋白质。
(3)分析肿瘤结合分子
通过统计学分析,显著性差异的蛋白共13个,其中WTKRAS组中识别到8个生物素化蛋白质(AHNAK2,CYSRT1,ABI1,COL17A1,DSC2,SNAP29,PDLIM5,FAM126B),G12D-KRAS组中筛选出5个相互作用分子(SLC5A3,CBARP,BUB1B-PAK6,TC2N,SHB)(图4.A)。比对这部分数据,筛选出AHNAK2(AHNAK Nucleoprotein 2,AHNAK核蛋白2)仅在WT-KRAS组中被检测到(图4.B),SLC5A3仅在G12D-KRAS组中被生物素化(图4.C)[6]。
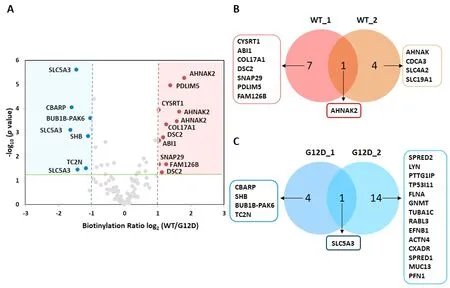
图4 WT-KRAS与G12D-KRAS的结合分子比较
WT-KRAS组识别到AHNAK2的同源蛋白AHNAK,是EGFR的已知相互作用蛋白。AHNAK为700 kDa蛋白质,在多种细胞中表达,在神经母细胞瘤中下调表达,AHNAK2功能未知[7]。WT-KRAS组AHNAK2的生物素化肽段丰度高于G12D-KRAS组,AHNAK2可能与WT-KRAS更稳定结合。SLC5A3(Solute Carrier Family 5 Member 3,溶质载体家族5A3),其家族有12个分子与KRAS存在蛋白相互作用[8],主要功能防止高浓度肌醇在细胞内积聚造成高渗透压,导致细胞功能受损。该分子赖氨酸残基占全序列的4.3%,本次检测到2个生物素化标记位点,占全部32个赖氨酸残基的1/16。G12D组SLC5A3的K4位生物素修饰为WT-KRAS组2倍以上。
3.实验讨论
KRAS作为重要信号转导的高度调节性分子,自身结构改变,影响其与KRAS结合分子的相互作用,触发多样性的下游信号。发生突变的KRAS调控着大部分肿瘤的发生,其中第12氨基酸突变占所有KRAS突变的90%左右。本研究主要通过比较G12D突变与野生型KRAS于结合蛋白的差异,指出G12D突变后导致信号通路改变的关键分子,为潜在药物靶点研究提供线索。
我们利用特异识别生物素化位点[9],依据生物素酶标记生物素于近距蛋白(小于10nm)赖氨酸残基的原理,针对G12D突变型和野生KRAS进行了肿瘤互作化学分子研究。
(1)首先构建了包含BioID的亲本和突变KRAS融合基因的SW48细胞,且表达融合蛋白水平一致。两组细胞背景一致时,二者不同的生物学特性,理论上由KRAS突变造成[10]。为简化分析,本部分采用两种生物素进行标记。考虑可能具体标记效率不一致,每种生物素分别标记两种细胞,最后综合定量分析出,BioID-WT-KRAS细胞中88种可能结合蛋白质,BioID-G12D-KRAS细胞中有90种潜在结合分子。
(2)又分析发现,G12D-KRAS有19种结合蛋白质(SLC 5A3,ACTN4,BUB1B-PAK6,CBARP,CXADR,EFNB1,FLNA,GNMT,LYN,MUC13,PFN1,PTTG1IP,RABL3,SHB,SPRED1,SPRED2,TC2N,TR53I11,TUBA1C),WTKRAS识别12种互作分子(AHNAK2,ABI1,AHNAK,COL17A1,CYSRT1,DSC2,FAM126B,PDLIM5,SLC19A1,SLC4A2,SNAP29,CDCA3)。生物素化AHNAK2只在WTKRAS细胞中被检测,生物素化SLC5A3仅在G12D-KRAS细胞内被识别。
AHNAK2和SLC5A3将作为潜在的肿瘤互作化学分子,在后续进行更多的研究,为我们深入认识KRAS,研制KRAS靶向药物提供前期工作基础。
