植物乳杆菌和短乳杆菌复合添加对高丹草青贮效果的影响
2022-03-28王小利韩永芬孟军江
付 薇, 陈 伟, 周 丽, 蔡 璐, 王小利, 韩永芬*, 孟军江
(1.贵州省草业研究所, 贵州 贵阳 550006;2.贵州金农富平生态农牧科技有限公司, 贵州 松桃 554100;3.贵州省生物技术研究所, 贵州 贵阳 550006)
高丹草是禾本科(Gramineae)一年生C4饲草,鲜草产量高,再生能力强、抗倒伏、营养品质佳、适口性好[1-2]。高丹草夏季生长旺盛,南方气候多雨湿润不宜干草加工。青贮调制不仅可以最大程度保留其营养成分[3],还可有效解决南方草料季节性供应不均衡问题。尤思涵等[3]、张欢等[4]开展了高丹草与不同牧草适宜混贮比例研究,白春生等[1]研究了不同施氮量和留茬高度对高丹草青贮发酵的影响,但不同乳酸菌类型复合添加对高丹草青贮品质的影响研究国内外并不多见。
植物乳杆菌和短乳杆菌是较为常见的青贮发酵乳酸菌,前者属于同型发酵乳酸菌,能快速提升乳酸含量降低pH值,减少青贮发酵过程中的营养损失[5],后者属于异型发酵乳酸菌,青贮时产生大量乙酸,有效抑制开窖后酵母菌、霉菌等有害微生物生长,较好防止青贮有氧腐败变质[6]。国内有关二者按不同比例混合添加对高丹草青贮开窖前后营养成分、微生物变化规律、有氧稳定性影响的深入研究较少。项目组利用前期从青贮玉米中筛选获得的2株植物乳杆菌和短乳杆菌制作复合乳酸菌剂,研究该复合乳酸菌不同添加比例对高丹草青贮发酵效果和有氧稳定性的影响,为优良乳酸菌筛选利用和高丹草青贮调制技术研发提供科学依据与技术支撑。
1 材料与方法
1.1 试验材料
青贮原料为‘蜀草1号’高丹草,于2019年4月16日播种于贵州省草业研究所松桃县高产饲草基地,种植面积为2 hm2,种植行距为50 cm×20 cm,2019年8月3日蜡熟初期收割,营养成分见表1。供试菌株植物乳杆菌LP06和短乳杆菌LBR02部分生理生化特性见表2。

表1 青贮原料营养成分和微生物数量Table 1 Nutritional composition and microbial quantity of silage materials
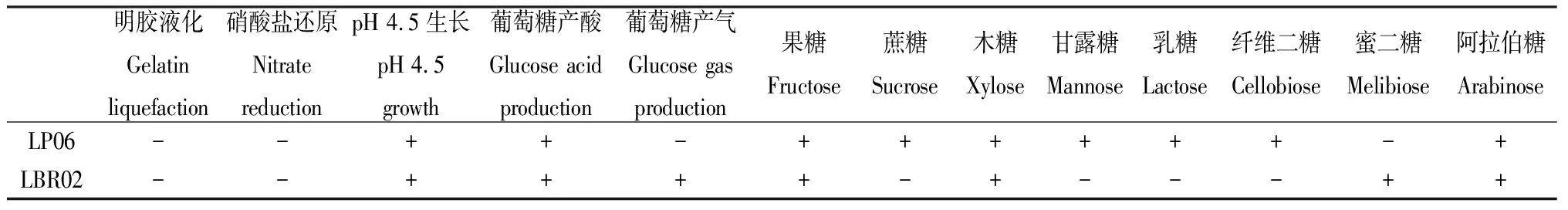
表2 菌株LP06和LBR02部分生理生化特性Table 2 Some physiological and biochemical characteristics of LP06 and LBR02
1.2 试验方法
将高丹草晾晒至水分含量在60%~70%,切碎至3~5 cm长度,装入聚乙烯袋(塑料袋规格为600 mm×500 mm),每袋1 500 g。真空密封机抽气密封,每个处理3个重复,常温贮藏60 d。设置8个添加处理(每个处理乳酸菌添加总量约5.0×106cfu·mL-1):1.CK(对照,无乳酸菌添加);2.LP06(LP06∶LBR02=1∶0);3.LBR02(LP06∶LBR02=0∶1);4.F-1(LP06∶LBR02=4∶1);5.F-2(LP06∶LBR02=3∶2);6.F-3(LP06∶LBR02=2∶3);7.F-4(LP06∶LBR02=1∶4);8.F-5(LP06∶LBR02=1∶1)。将2种菌种分别活化后接入液体乳酸细菌培养基(De-man rogosasharpe,MRS),37℃培养72 h,用蒸馏水调整至菌落总数1.0×106cfu·mL-1,按5 mL·kg-1的总剂量混合各乳酸菌组合,10倍无菌蒸馏水稀释后均匀喷洒至高丹草原料上,以等体积无菌蒸馏水作为对照。
1.3 测定指标及方法
1.3.1发酵品质测定 发酵第60 d测定青贮pH值、氨态氮(Ammonium nitrogen,NH3-N)、乳酸、乙酸含量。开窖后第6 d再次测定pH。pH采用酸度计(PHS-25)测定,NH3-N含量采用苯酚-次氯酸钠比色法分析[8],乳酸、乙酸含量采用高效液相色谱法分析[8]。
1.3.2常见营养成分测定 发酵第60 d测定干物质(Dry matter,DM)、粗蛋白质(Crude protein,CP)、可溶性碳水化合物(Water-soluble carbohydrates,WSC)、酸性洗涤纤维(Acid detergent fiber,ADF)、中性洗涤纤维(Neutral detergent fiber,NDF)含量。开窖后第6 d测定青贮DM,CP,WSC含量。DM含量采用烘干重量法测定[9],CP含量采用凯氏定氮法测定[9],WSC含量采用蒽酮-硫酸比色法测定[9],ADF和NDF含量采用范氏(VanSoest)洗涤纤维法测定[10]。
1.3.3微生物数量及多样性测定 发酵第60 d和开窖第6 d分别测定乳酸菌、酵母菌、霉菌数量。称取20 g样品于180 mL无菌生理盐水(0.85%NaCl)中,4℃下振荡1 h后制备系列梯度稀释液(10-7~100)[7]。各微生物均采用菌落计数法计数,将稀释液涂布于MRS培养基,于37℃下恒温厌氧培养72 h,统计乳酸菌菌落数。在马铃薯葡萄糖培养基上涂布稀释液,25℃下恒温有氧培养72 h后统计酵母菌菌落数。于马丁培养基上涂布稀释液,25℃下恒温有氧培养72 h,统计霉菌菌落数。
1.3.4有氧稳定性测定 有氧稳定性是指青贮饲料在开窖后随着pH、温度升高依然保持新鲜、气味酸香的持续时间[11]。将温度计插入样品中,每隔2 h记录青贮几何中心温度,有氧稳定性以中心温度不高于环境温度2℃所持续的时间表示。
1.4 数据统计
使用Excel 2007软件对基础数据进行整理。采用SPSS v18.0统计软件进行单因子方差分析,并用邓肯氏(Duncan)法进行组间差异显著性分析,P<0.05代表差异显著。根据试验数据分析结果,采用模糊数学隶属函数法对青贮60 d、开窖后有氧稳定性、开窖第6 d的测定指标进行综合评价[12],计算公式如下:
式中:Uxi(+)为各指标正相关隶属函数值,Uxi(-)为各指标负相关隶属函数值,Xi为某指标测定值,Xmin和Xmax分别为某指标所有测定值中的最小值和最大值。以全部指标隶属函数值平均值大小进行排名。
2 结果与分析
2.1 高丹草青贮60 d各处理发酵品质比较和主要微生物数量变化
不同菌剂添加比例对高丹草青贮60 d发酵品质的影响如表3所示。青贮60 d后,全部处理pH值下降至4.1以下。LP06,F-1,F-2处理NH3-N含量显著低于CK(P<0.05)。LP06和F-1处理乳酸含量最高,分别为4.23%,4.40%。青贮60 d后,乙酸含量随着短乳杆菌添加比例的增加而增加。
不同菌剂添加比例对高丹草青贮60 d微生物数量的影响如表3所示。各处理乳酸菌数量显著高于CK(P<0.05),其中LP06,F-5处理乳酸菌数量较高(>8.00 lg cfu·g-1FM)。F-3处理酵母菌数量最低,各处理均未检测到霉菌。
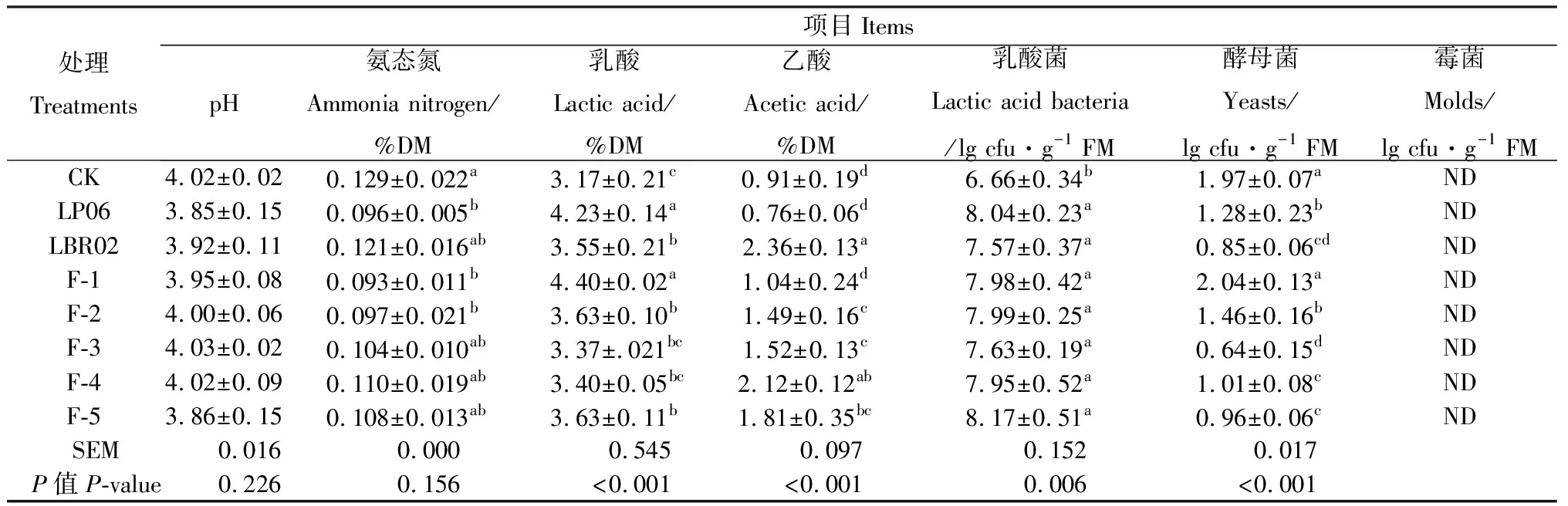
表3 不同菌剂添加比例对高丹草青贮60 d发酵品质和主要微生物数量的影响Table 3 Effects of mixing ratio of additive ingredients onfermentation quality andmajor microbial quantity of Sorghum hybrid Sudan grassafter 60 days silage
2.2 高丹草青贮60 d各处理营养成分比较
不同菌剂添加比例对高丹草青贮60 d营养成分的影响如表4所示。CP损耗整体随着植物乳杆菌添加比例的增加而降低。CK处理WSC营养损失最少,含量为4.15%,显著高于其它处理(P<0.05)。
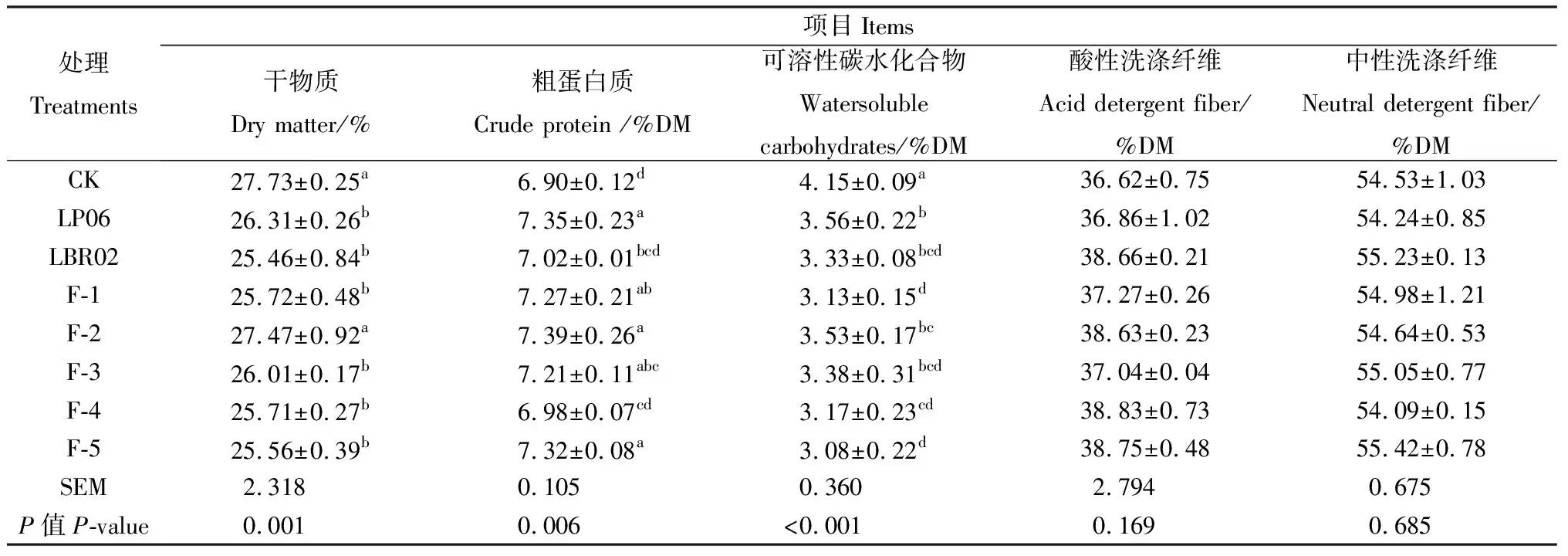
表4 不同菌剂添加比例对高丹草青贮60 d营养成分的影响Table 4 Effects of mixing ratio of additive ingredients on nutritional components of sorghum hybrid sudan grass after 60 days silage
2.3 高丹草青贮开窖后各处理有氧腐败抑制效果比较
不同菌剂添加比例对高丹草青贮开窖后有氧腐败抑制效果的影响如表5所示。开窖第6 d,CK,LP06和F-1处理pH值出现了较大幅度上升,LBR02,F-3,F-4,F-5处理pH稳定在4.3以下。LBR02,F-4,F-5处理DM含量略有上升。CK处理WSC损失幅度最大,为33.49%,F-5处理损失幅度最小,为16.23%,全部短乳杆菌添加处理的WSC含量高于植物乳杆菌LP06单独添加。LBR02,F-4和F-3有氧稳定性分别达192.33 h,184.37 h和179.06 h,显著高于其它处理(P<0.05)。各处理青贮饲料乳酸菌数量显著高于CK(P<0.05)。随着短乳杆菌添加量增加,青贮酵母菌数量逐步降低,LBR02,F-3,F-4和F-5处理未检测出霉菌。
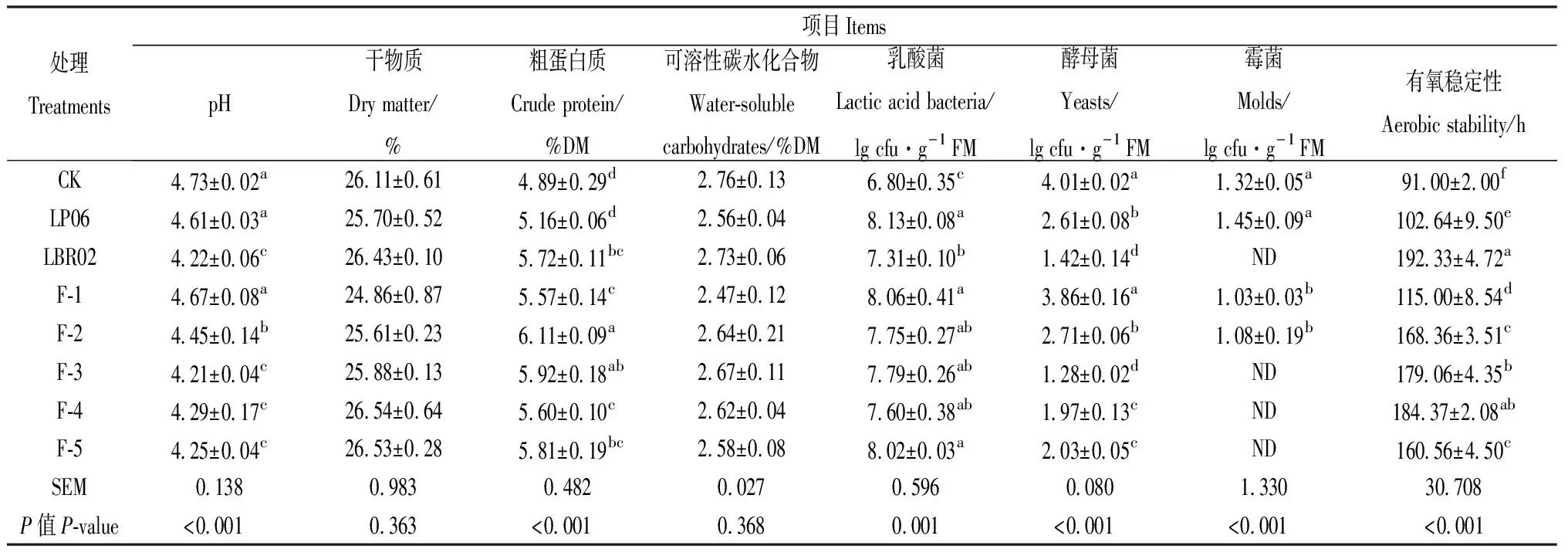
表5 各处理有氧稳定性及开窖6 d后pH值、营养成分、主要微生物数量比较Table 5 Comparison of aerobic stability,pH value,nutritional components and major microbial quantity of each treatment after 6 days cellar opening
2.4 各处理青贮效果综合评价
为综合评价各处理对高丹草青贮品质及有氧稳定性的影响,本研究利用隶属函数法对8个处理青贮60 d和开窖6 d两个试验阶段的指标进行综合评价,其中乳酸、乙酸、DM,CP,WSC,乳酸菌含量为6个正向指标,pH,NH3-N,NDF,ADF,酵母菌、霉菌含量为6个负向指标。根据6个正向指标和6个负向指标的平均隶属函数值对8个处理进行综合价值评定,平均值越高表明该处理综合应用价值越高,从高到低依次为:F-3(0.63)>F-5(0.61)>LBR02(0.58)=F-2(0.58)>F-4(0.57)>LP06(0.56)>F-1(0.40)>CK(0.30)。
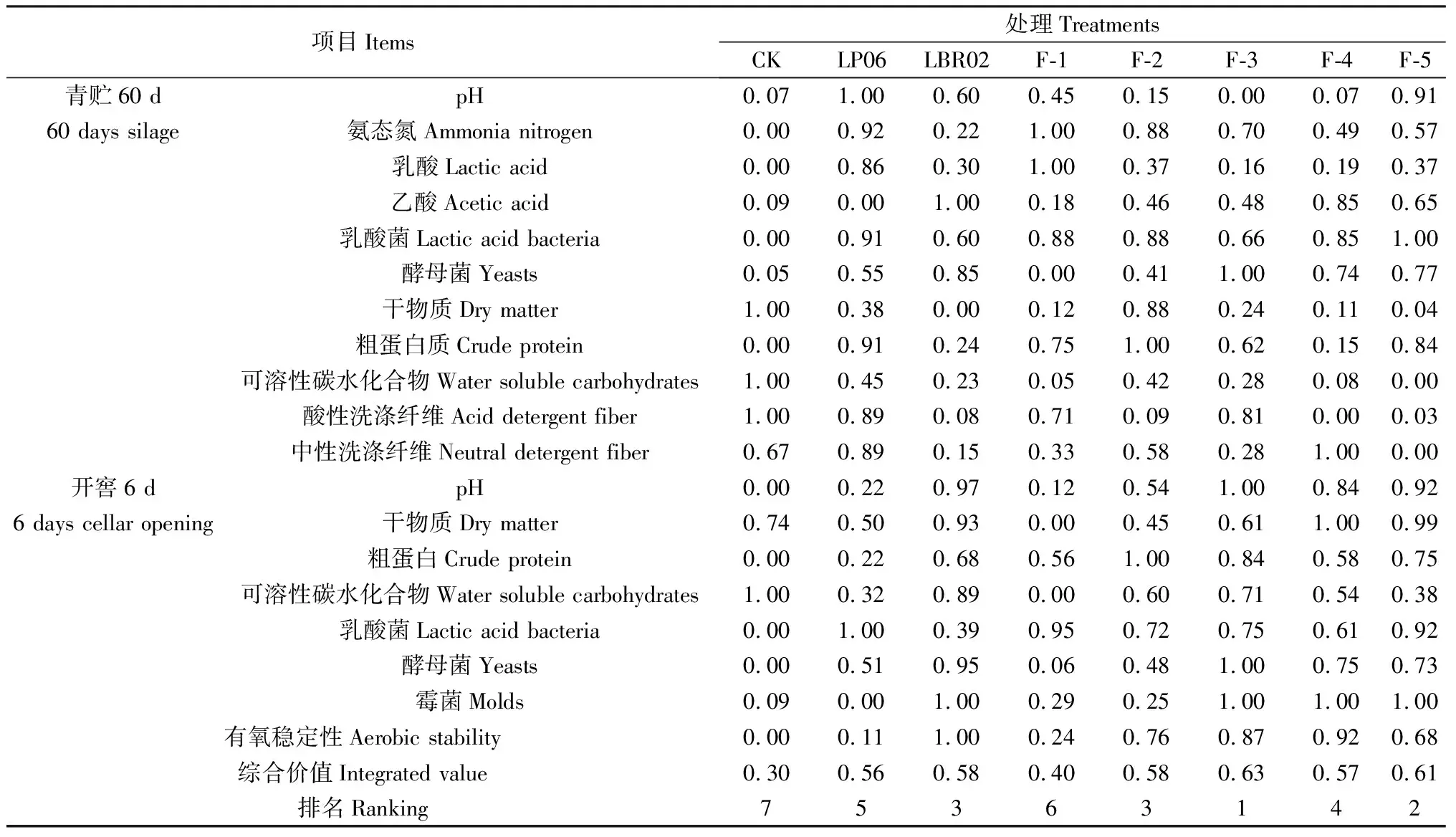
表6 不同菌剂添加比例对高丹草青贮效果的综合评价Table 6 Comprehensive evaluation ofmixing ratio of additive ingredients on sorghum hybrid sudan grass silage effects
3 讨论
3.1 乳酸菌添加比例对高丹草青贮发酵品质的影响
饲草通过青贮发酵能够快速降低pH,减少有害菌活动代谢,降低营养损耗,因此pH值的大小可以体现饲料品质。本研究中,全部处理发酵60 d后的pH值均低于4.1,pH整体随着同型发酵乳酸菌比例增加而降低,进一步表明在青贮中加入同型发酵乳酸菌更有利于加快青贮进程[13-14]。青贮发酵过程中,蛋白被多种厌氧微生物消耗代谢转化成NH3-N和胺类物质,因此NH3-N含量可间接反映出青贮饲料中蛋白质营养消耗情况[15]。青贮60 d,LP06,F-1和F-2处理NH3-N含量较低,推测可能是3组处理植物乳杆菌添加比例较高,发酵前期能快速主导发酵进程形成良好的厌氧酸性环境抑制了有害微生物对蛋白质的分解所致。研究指出,同、异型乳酸菌单独添加或复合添加,均提高青贮中的乳酸含量[16-17],各处理乳酸含量均高于CK,随着植物乳杆菌添加比例增加,乳酸含量也呈增加趋势,该结果与pH试验结果相吻合,进一步体现了同型发酵乳酸菌在增加体系内乳酸含量方面的优势。
3.2 乳酸菌添加比例对高丹草青贮营养成分和主要微生物的影响
CP是评价青贮饲料营养成分的重要指标,蛋白质降解影响氮的利用率,从而影响饲料营养成分。CP含量整体随着植物乳杆菌添加比例增加而增加,可能是植物乳杆菌发酵前期代谢活动强于短乳杆菌,添加比例越高越易较早形成酸性环境,一定程度上抑制了蛋白质分解酶的作用所致[18]。青贮后全部处理组WSC含量较低,可能是WSC被添加的乳酸菌作为碳源营养来源大量利用,造成WSC含量的显著降低。
青贮过程是一个复杂的微生物代谢过程,而乳酸菌则是决定青贮发酵成功与否的重要微生物。青贮60 d后,7组乳酸菌添加处理的乳酸菌数量较高,进一步证实在发酵过程中额外添加乳酸菌制剂可以加速发酵进程。酵母菌数量随着短乳杆菌添加比例增加而显著降低,短乳杆菌异型发酵生成乙酸,乙酸对酵母菌和霉菌有较强抑制作用,在抑制好氧微生物生长、防止青贮饲料腐败方面有积极作用[13,19]。
3.3 乳酸菌添加比例对高丹草青贮有氧腐败抑制效果的影响
开窖第6 d,随着短乳杆菌添加比例增加,DM含量略微有所上升,可能是有氧腐败和物质损耗相对较少,DM含量因青贮渗出液的流失短暂增加所致。开窖有氧暴露后,酵母菌、霉菌逐步活跃,乳酸、CP,WSC等物质被这些好氧微生物快速繁殖利用,CK和植物乳杆菌高比例添加组(LP06,F-1,F-2)因乙酸含量较低,好氧微生物生长抑制作用弱,营养物质被迅速代谢消耗,更易发生变质腐败[20]。随着短乳杆菌比例的增加,有氧稳定性显著增加,以短乳杆菌LBR02单独添加表现最为突出,有氧稳定性比植物乳杆菌LP06单独添加高出89.69 h,由此尽管植物乳杆菌具有较快的发酵特性,发酵过程中在降低NH3-N含量、减少CP损失方面具有优势,但对青贮开窖后有氧腐败抑制效果不显著[21-22]。
4 结论
青贮60 d时,增加植物乳杆菌LP06的添加比例可以降低高丹草NH3-N含量、减少CP损失、增加乳酸菌数量;开窖有氧暴露后,增加青贮饲料中短乳杆菌LBR02的添加比例,可以有效抑制好氧微生物生长、防止青贮饲料腐败变质。综合分析,植物乳杆菌LP06和短乳杆菌LBR02以2∶3比例混合添加,高丹草青贮效果综合表现最优。
