外泌体功能化串晶结构纤维膜的制备及其成骨分化性能
2022-03-28刘来俊李超婧晋巧巧谢千阳李佩伦王富军
张 宇, 刘来俊, 李超婧, 晋巧巧, 谢千阳, 李佩伦, 王富军, 王 璐
(1. 东华大学 纺织面料技术教育部重点实验室, 上海 201620; 2. 东华大学 纺织学院, 上海 201620; 3. 上海交通大学 口腔医学院, 上海 200011; 4. 上海交通大学医学院附属第九人民医院 牙体牙髓科, 上海 200011; 5. 上海交通大学医学院附属第九人民医院 口腔外科, 上海 200011; 6. 上海交通大学医学院附属第九人民医院 口腔正畸科, 上海 200011)
牙周疾病是一种流行率非常高的慢性疾病,如不及时治疗,可能造成牙槽骨等牙周组织破坏甚至牙齿脱落[1]。引导骨再生(GBR)是牙槽骨修复最常用的策略之一,将GBR膜置于软组织和骨缺损之间,阻止结缔组织细胞和上皮细胞迁移到缺损处,同时使祖细胞重新定殖并形成新的骨组织[2]。在矿化过程中,健康的细胞外基质保持理想的机械结构,并为成骨细胞的迁移、黏附、增殖和分化提供大量的生化成分[3]。在GBR膜的众多制备方法中,静电纺丝法应用较为广泛,其制备的纳米纤维支架具有高孔隙率、高比表面积和低刚度等优势,能够很好地模拟细胞外基质结构[4]。静电纺丝纤维的表面拓扑结构修饰已被证实具有促进骨再生的效果,其对细胞分化的调节主要取决于表面粗糙度的变化[5]。串晶(SK)结构可采用溶剂诱导结晶法制备而得,其由纳米纤维和垂直于纤维轴向的周期性片晶结构共同组成,可以显著提高纤维的表面粗糙度,通过影响蛋白吸附、调控各种细胞活动,从而更好地模拟天然胶原纤维的分层纳米结构来指导宿主细胞并调节骨再生[6-7]。
增强GBR膜的骨再生效果除了可对其结构修饰外,还可以将生物活性物质结合到支架中,进一步加速移植物与宿主组织的骨整合。研究表明,间充质干细胞(MSCs)衍生的外泌体在体内外成骨过程中起着至关重要的作用,可通过传递脱氧核糖核酸(DNA)、核糖核酸(RNA)和肽等直接调节成骨细胞的分化[8]。Liu等[9]的研究表明,骨髓间充质干细胞衍生的外泌体(BMSC-Exo)可促进骨桥蛋白和骨钙素基因表达,M2型巨噬细胞极化以及转化生长因子-β1的表达,从而实现牙周炎大鼠牙周组织修复和再生。与生长因子、干细胞等相比,外泌体可最大限度地减少对生物活性诱导分子的需求,有效避免毒性和免疫原性问题[10-11]。基于外泌体的治疗主要通过静脉注射[12],这导致外泌体在体内半衰期极短[13]。此外,对于牙槽骨的修复,直接注射也不利于外泌体在近中根部位的良好累积[14]。相较于在悬浮培养基中提供外泌体,将外泌体直接固定在移植物表面可更好地促进MSCs生长和成骨分化[15]。Zha等[16]构建了工程化的小鼠成软骨细胞系衍生外泌体,通过特定的外泌体锚定肽充当柔性接头,将其与3D打印聚己内酯(PCL)多孔支架结合作为成骨基质,从而诱导MSCs的成骨分化并可控地释放基因以重塑血管系统。可见,将外泌体与支架相结合有利于其在缺损部位进行可持续和稳定的治疗。
PCL是一种具有良好生物相容性的可降解聚合物,由于具有优异的力学性能和可加工性能已被广泛用作骨组织修复材料,利用静电纺丝技术可以快速方便地制备PCL纳米纤维膜[17]。纳米尺度的β-磷酸三钙(β-TCP)由于其优异的生物相容性和骨传导活性可以改善PCL疏水性、细胞亲和力差和骨传导活性低等不足[18-19]。基于以上分析,本文通过静电纺丝技术制备了PCL/β-TCP有机/无机复合纳米纤维膜,并通过溶剂诱导结晶法制备出串晶结构进一步增加其粗糙度;为提高纤维膜对细胞的亲和力以及对外泌体的附着力,对串晶纤维膜进行聚多巴胺(PDA)改性;最终创建了一个外泌体功能化的串晶纳米纤维膜,以期促进干细胞在体外的成骨分化。
1 试验部分
1.1 试验材料与仪器
聚己内酯(PCL,数均分子量为80 000 g/mol)、胰酶、双抗、地塞米松、抗坏血酸、β-甘油磷酸钠和细胞培养基(DMEM),美国Sigma-Aldrich公司;β-磷酸三钙(β-TCP,粒径≤200 nm),百灵威科技有限公司;三氯甲烷(CF,纯度≥99.0%)、N,N-二甲基甲酰胺(DMF,纯度≥99.5%)、三(羟甲基)氨基甲烷(Tris,纯度≥99.5%)、盐酸(HCl,纯度为36.0%~38.0%)、十二烷基苯磺酸钠(SDS,纯度≥83.0%)和磷酸盐缓冲液(PBS)配制所需原料KCl、NaCl、Na2HPO4·12H2O和KH2PO4,国药集团化学试剂有限公司;乙酸戊酯(纯度约为99.0%),上海阿拉丁生化科技股份有限公司;盐酸多巴胺(数均分子量为189.64 g/mol),北京Solarbio公司;TritonX-100,上海翊圣生物科技有限公司;胎牛血清蛋白(BSA)、BCA蛋白质定量检测试剂盒,上海生工生物工程有限公司;大鼠骨髓间充质干细胞(rBMSCs)、完全培养基,中国科学院上海细胞库;去外泌体胎牛血清,上海逍鹏生物科技有限公司;碱性磷酸酶(AKP)试剂盒、BCIP/NBT碱性磷酸酶染色试剂盒,南京建成科技有限公司。
TL-Pro-BM型静电纺丝机,深圳通力微纳科技;SU8010型场发射扫描电子显微镜(FE-SEM)、JEM-2100F型场发射透射电子显微镜(FE-TEM),日本日立公司;NEXUS-670型傅里叶变换红外光谱仪(FT-IR),美国Thermo Fisher公司;OCA 20型接触角测试仪,德国Dataphysics公司;Axioskop 2 plus型光学显微镜,上海欧波同仪器有限公司;Zetaview纳米颗粒跟踪分析仪,德国Particle Metrix公司。
1.2 串晶纳米纤维膜制备
1.2.1 串晶纳米纤维膜制备工艺
首先,将PCL颗粒加入至CF和DMF(二者体积比为3∶1)中配制成质量浓度为0.12 g/mL的PCL溶液;向PCL溶液中加入β-TCP(占PCL质量的5%),超声波处理1 h使β-TCP充分分散;在磁力搅拌下形成均匀混合的纺丝液。将上述纺丝液转移至装有19G针头的10 mL注射器中在静电纺丝机上进行纺丝。纺丝电压为15 kV,推注速度为1.2 mL/h,纺丝距离为15 cm。将所得静电纺丝纤维膜置于37 ℃真空干燥箱中干燥24 h以充分去除残留有机溶剂,将该纤维膜记为PT5。
然后,采用溶剂诱导结晶法在纳米纤维表面制备串晶结构。将PCL颗粒溶于乙酸戊酯中配制0.01 g/mL的PCL稀溶液,在60 ℃温度下磁力搅拌2 h,冷却至室温后滴加于PT5纤维膜上过夜使溶剂自然挥发,得到具有串晶结构的纤维膜,记为PT5SK。
最后,将制备的PT5和PT5SK静电纺纤维膜分别浸入2 mg/mL的盐酸多巴胺和10 mmol/L Tris-HCl(pH值为8.5)中,并在37 ℃和60 r/min摇床中孵育12 h;之后将纤维膜用去离子水超声波清洗多次至水不变色,然后于37 ℃真空干燥24 h,所得样品分别记为PT5/PDA和PT5SK/PDA。
1.2.2 结构与性能表征
将真空干燥后的纤维膜喷射铂金后,采用场发射扫描电子显微镜对其表观形貌进行观察,并用Image J软件测量纤维的直径。
通过傅里叶红外光谱仪测试纤维膜的特征化学基团,分辨率为2 cm-1,波数范围为4 000~400 cm-1。
采用接触角测试仪测量纤维膜的水接触角以评价其表面润湿性。液滴体积为2 μL,每种样品测量3次,取平均值。
对纤维膜的蛋白吸附能力进行评价。首先,将PT5、PT5SK、PT5/PDA和PT5SK/PDA纤维膜裁剪成直径为14 mm的圆形并置于24孔板中,用PBS清洗3次,加入1 mg/mL BSA溶液在37 ℃恒温摇床中以30 r/min孵育12 h。然后吸除多余液体,并用PBS清洗多余BSA溶液,每孔加入1 mL 1% SDS溶液孵育4 h,将样品上吸附的蛋白剥离,采用BCA蛋白质定量检测试剂盒定量测量上清液中BSA的浓度。
1.3 rBMSCs外泌体制备
1.3.1 rBMSCs外泌体分离方法
选用第4代rBMSCs在完全培养基中培养至80%融合度时,用PBS清洗旧的生长培养基,然后更换为无外泌体的成骨分化培养基(向DMEM中加入体积分数为10%的去外泌体胎牛血清,体积分数为1%的双抗,50 μmol/L抗坏血酸,10 mmol/L β-甘油磷酸钠和100 nmol/L地塞米松),置于37 ℃、5% CO2的细胞培养箱中培养。48 h后收集成骨分化培养基上清液,-80 ℃下保存直至外泌体分离,所得外泌体记为BMSC-Exo。
采用超滤结合分子排阻色谱方法从细胞上清液中提取外泌体。首先,向100 ku超滤管中加入细胞上清液,离心10 min弃废液,重复上述操作直至无法继续浓缩为止。用0.1 mol/L PBS冲洗凝胶排阻柱,待凝胶排阻柱平衡好后,向每根柱中加入1 mL预处理好的细胞上清液。样品全部进入填料后,添加0.1 mol/L PBS进行洗脱,收集对应的外泌体馏分。将收集到的外泌体转移至100 ku超滤管,离心15 min浓缩至200 μL左右,吹打均匀后将外泌体全部吸出用于后续试验及鉴定。
1.3.2 浓度与结构表征
采用BCA定量试剂盒对分离的外泌体浓度进行测量。
使用场发射透射电子显微镜(FE-TEM)观察外泌体的形态。将重悬于PBS中的BMSC-Exo包埋在碳涂覆的铜网上,并在室温下干燥10 min,随后用1%磷钨酸染色,在80 kV下拍摄FE-TEM照片。
采用ZetaView测量所提取的外泌体颗粒浓度,并通过纳米颗粒跟踪分析(NTA)测量其粒径分布情况。
1.4 外泌体功能化串晶纳米纤维膜制备
1.4.1 外泌体功能化串晶纳米纤维膜制备工艺
将PT5SK/PDA纤维膜裁剪成直径为14 mm的圆形并置于24孔板中,放入酒精熏缸中过夜灭菌,负载外泌体前用PBS清洗样品3次。将重悬于PBS中的BMSC-Exo滴加至PT5SK/PDA纤维膜上,每个样品的外泌体负载量约为10 μg,于4 ℃下孵育24 h,所得样品记为PT5SK/PDA-Exo。
1.4.2 rBMSCs成骨分化表征
为评估PT5、PT5SK、PT5/PDA、PT5SK/PDA和PT5SK/PDA-Exo促进干细胞体外成骨分化的能力,对培养在纤维膜上的rBMSCs的碱性磷酸酶(ALP)活性进行表征。选用第4代rBMSCs以2×104个/孔的密度种植在灭菌的PT5、PT5SK、PT5/PDA、PT5SK/PDA和PT5SK/PDA-Exo样品表面,每种样品设置3个平行样。完全培养基培养48 h后更换为成骨诱导培养基(向完全培养基中加入50 μmol/L抗坏血酸、10 mmol/L β-甘油磷酸钠和100 nmol/L地塞米松),培养至成骨诱导7和14 d,每48 h更换新鲜培养基。
通过对ALP染色定性评价其活性。首先,吸出培养基用PBS清洗3次后,加入4%多聚甲醛,在4 ℃下固定3 h,用PBS清洗3次去除多余固定液。然后采用BCIP/NBT碱性磷酸酶染色试剂盒对各纤维膜进行染色。采用数码相机和光学显微镜分别拍摄纤维膜的宏观和微观染色情况。
测试ALP活力定量评价其活性。吸除24孔板内的培养基,用PBS清洗3次后加入0.5%的TritonX-100裂解液,置于4 ℃下孵育过夜。次日,取出上清液并以2 000 r/min离心5 min,用离心后新的上清液来测定ALP的活性及总蛋白浓度。根据AKP试剂盒和BCA蛋白质定量检测试剂盒对各样品的ALP活性进行定量测试。
1.5 统计学分析
试验得到的各数值均以平均值±标准差(SD)表示,通过单因素方差分析(ANOVA)进行统计分析。显著性差异水平*** 表示P<0.001;** 表示P<0.01;*表示P<0.05。
2 结果与讨论
2.1 改性PCL/β-TCP串晶纳米纤维膜
2.1.1 微观形貌分析
静电纺丝PCL纳米纤维膜具有优异的力学性能和高比表面积的固有优势,可以很好地模拟天然细胞外基质结构,将β-TCP无机材料引入可降解聚合物中可进一步实现快速矿化和良好的骨再生[20]。图1示出PT5、PT5SK、PT5/PDA和PT5SK/PDA纤维膜的微观形貌。由图1(a)可知,通过静电纺丝法可获得表面平滑、随机分布且均匀连续的纳米纤维,纤维直径为(624.48±194.92) nm。由图1(b)可知,经PCL串晶溶液孵育后,PT5纤维表面形成了垂直于纤维轴向的串晶结构,使纤维膜的表面粗糙度增加,从而有利于MSCs的募集和成骨分化。为提高纤维膜对细胞的亲和力以及对外泌体的附着力,对PT5和PT5SK进行PDA改性。从图1(c)和(d)可看出,PDA改性后PT5和PT5SK纤维膜表面存在由多巴胺氧化自聚合产生的PDA颗粒,PT5SK/PDA的串晶结构在PDA改性后仍然存在且未被PDA覆盖,这说明PDA功能化不影响串晶纤维膜的形貌。

图1 PDA改性前后PT5和PT5SK纤维膜的SEM照片Fig.1 SEM images of PT5 and PT5SK fibrous membranes before and after PDA modification
2.1.2 化学结构分析

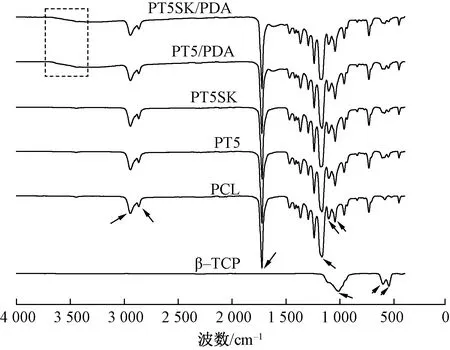
图2 β-TCP、PCL、PT5、PT5/PDA、 PT5SK和PT5SK/PDA的红外光谱图Fig.2 FT-IR spectra of β-TCP, PCL, PT5, PT5/PDA, PT5SK and PT5SK/PDA
2.1.3 表面浸润性分析
PT5、PT5SK、PT5/PDA及PT5SK/PDA的表面浸润性评价结果如图3所示。由于PCL的疏水性,PT5和PT5SK纤维膜均表现出疏水性,水接触角分别为(134.4±2.69)°和(126.6±1.45)°。串晶结构的形成使PT5SK的接触角有所降低,这可能是由于串晶的存在使纤维膜的孔径增加,从而有利于水分子的渗入。改性引入的PDA使PT5和PT5SK纤维膜的亲水性得到极大的提高,接触角分别降低至(104.9±1.17)°和(95.7±0.39)°。这是由于PDA中存在邻苯二酚、氨基等亲水性基团[25],使得改性后纤维膜的表面浸润性显著改善。PT5SK/PDA纤维膜由于拓扑结构和PDA修饰的双重作用,相比其他3组具有最优的表面浸润性(P<0.001),有利于改善纤维膜的生物相容性以及细胞的黏附和增殖。尽管PCL/β-TCP纤维表面的串晶结构已被证实具有促进成骨分化的作用,但PCL仍因其疏水性和缺乏活性官能团削弱了生物矿化的效果。而PDA修饰则可以弥补这一不足,赋予材料良好的亲水性、细胞相容性和成骨活性[26]。
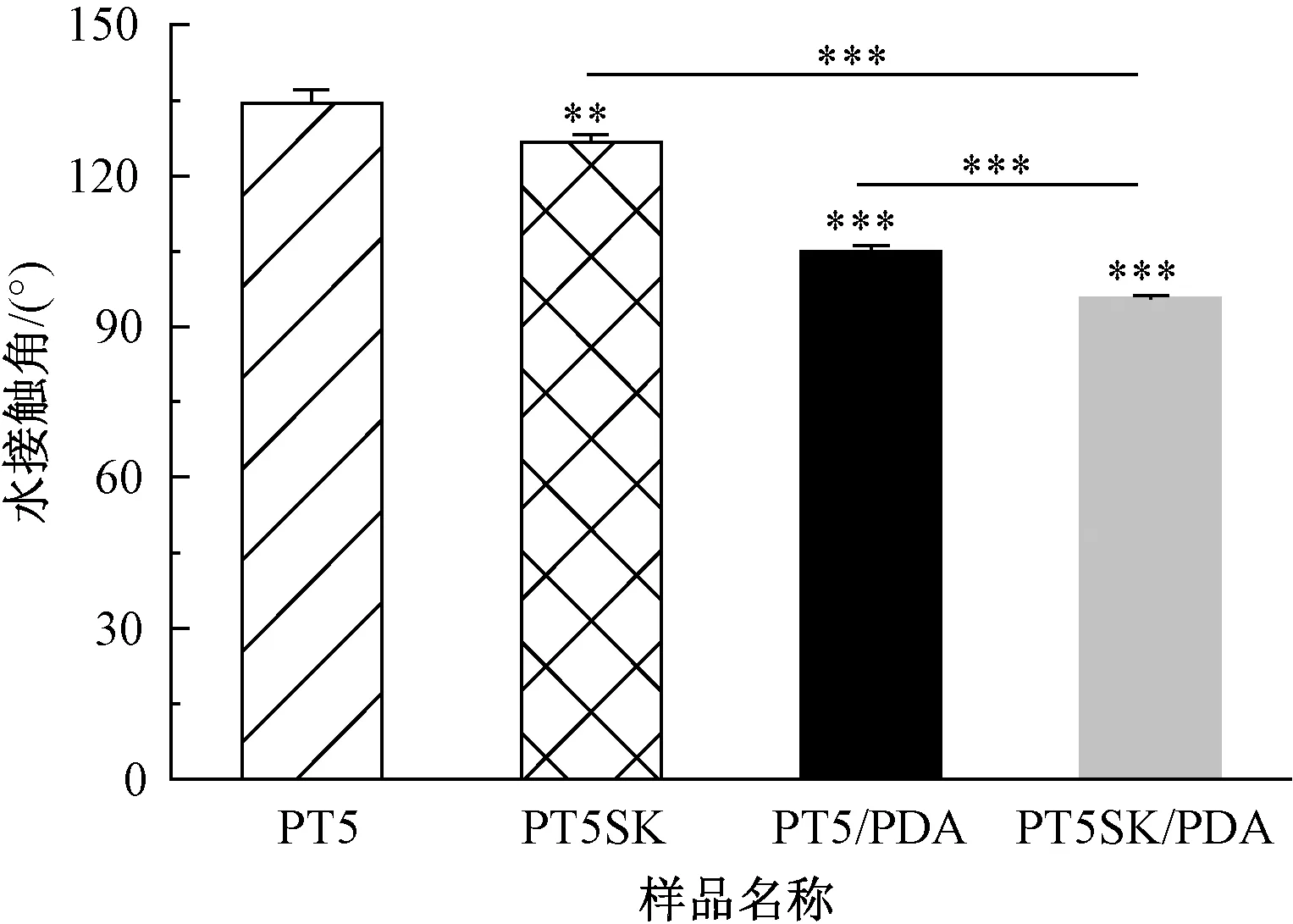
图3 PDA改性前后PT5和PT5SK纤维膜的水接触角Fig.3 Water contact angles of PT5 and PT5SK fibrous membranes before and after PDA modification
2.1.4 蛋白吸附分析
生物材料表面的蛋白吸附是决定其生物相容性的一个重要因素,细胞在材料表面的附着、迁移和生长是由蛋白质介导的,通常与Integrin β1和Vinculin等细胞黏附相关蛋白有关,因此,吸附的蛋白量增加有利于提高细胞在支架表面的快速黏附和铺展[25,27]。为评价支架的生物学特性,研究了纳米纤维膜的微观拓扑结构和表面化学性能对蛋白吸附性能的影响。PT5、PT5SK、PT5/PDA、PT5SK/PDA纤维膜的蛋白吸附情况如图4所示。
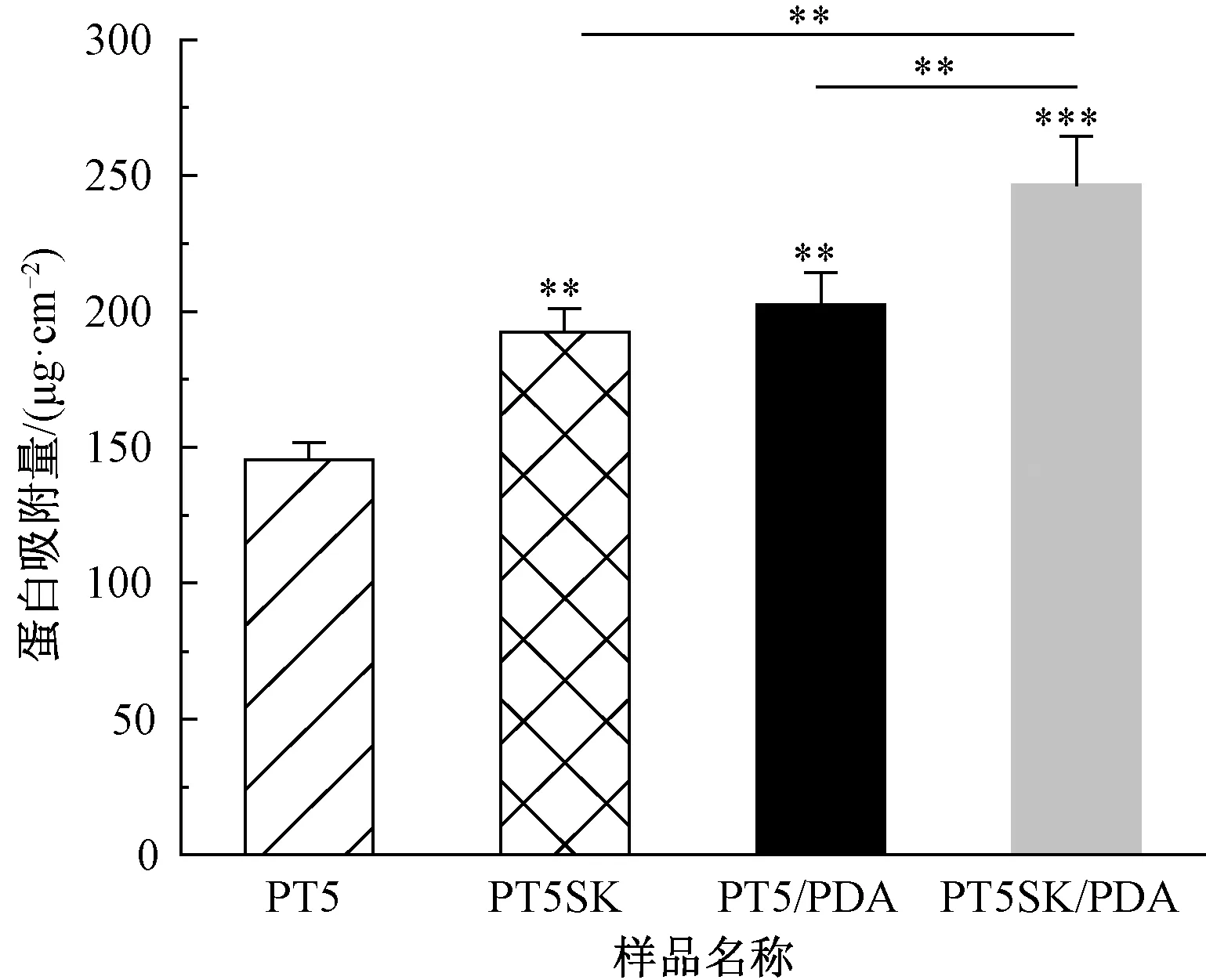
图4 PT5、PT5SK 、PT5/PDA、PT5SK/PDA 纤维膜的蛋白吸附情况Fig.4 Protein adsorption of PT5, PT5SK, PT5/PDA and PT5SK/PDA fibrous membranes
由图4可知,相比于PT5纤维膜的平滑纤维,PT5SK的蛋白吸附量显著增加(P<0.05),主要是因为串晶结构的存在能够提高材料的比表面积和表面粗糙度,从而提高对蛋白质的吸附效率,而且亲水性的增加也促进了蛋白吸附。材料的表面润湿性在蛋白吸附中起着重要作用[28],PDA改性后的纤维膜由于亲水性显著增加,蛋白吸附量也相应增加,整体趋势与表面浸润性的趋势一致。更重要的是,PDA层可以作为表面功能化的辅助平台,将各种类型的生物活性因子固定在基材上,从而赋予材料卓越的性能[29]。外泌体是一种具有双层膜结构的细胞外囊泡,蛋白吸附的增加也有利于提高纤维膜对外泌体的吸附能力并长时间保持稳定的附着。
2.2 外泌体功能化串晶纳米纤维膜
2.2.1 外泌体结构分析
对提取的外泌体进行表征,结果如图5所示。从FE-TEM照片可以看出,BMSC-Exo表现为杯状囊泡,具有清晰的双层膜结构。NTA结果表明,外泌体颗粒平均粒径为142.4 nm,粒径主峰为126.7 nm。以上结果初步证实了细胞上清液提取物是纳米级外泌体。
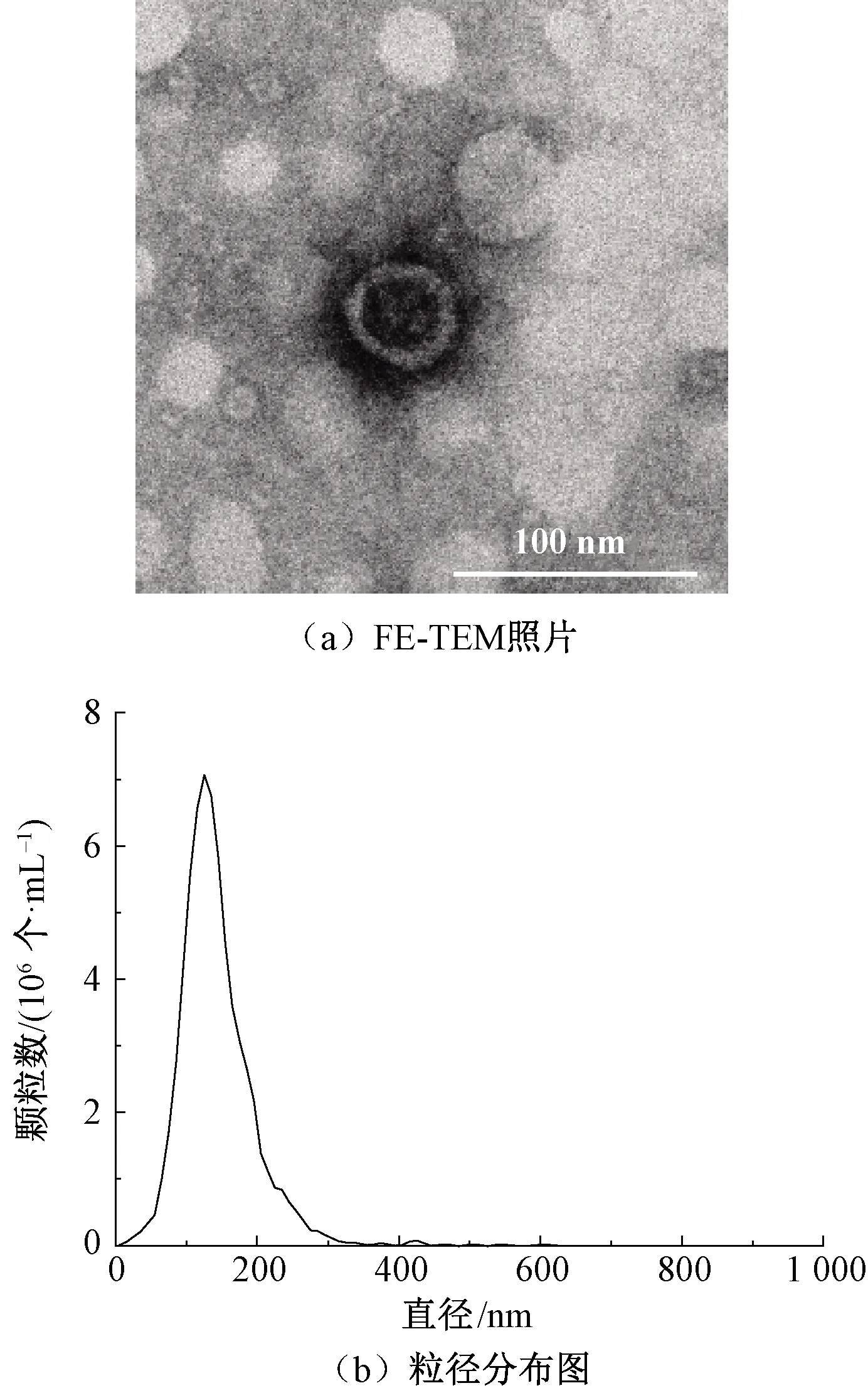
图5 BMSC-Exo的FE-TEM照片和粒径分布图Fig.5 FE-TEM image (a) and particle size distribution (b) of BMSC-Exo
2.2.2 成骨分化分析
ALP是成骨分化早期的标志物,通过染色和定量可对rBMSCs的体外成骨分化情况进行评价。rBMSCs在纤维膜上成骨诱导7和14 d的ALP染色和定量结果如图6、7所示。诱导7 d时,PT5和PT5SK纤维膜上细胞数量较少,且ALP染色较浅,经过PDA改性后的PT5/PDA和PT5SK/PDA的ALP染色面积有所增加、蓝紫色加深,且二者存在显著性差异(P<0.01);BMSC-Exo的加入显著提高了ALP活性(P<0.001),诱导14 d时,细胞数量增加并且颜色变深,负载了外泌体的PT5SK/PDA-Exo仍表现出最深的染色以及最高的ALP活力(P<0.001)。串晶结构和PDA改性使得纤维膜表面粗糙度和表面浸润性增加,从而有利于蛋白吸附、细胞生长和成骨矿化基质的形成。外泌体功能化后,ALP活性进一步增加,这归因于其自身的骨诱导作用。外泌体中富含的microRNA等物质可通过丝裂原活化蛋白激酶、Wnt等信号通路促进成骨相关基因的表达[30],因此,拓扑结构、PDA改性以及外泌体3个因素共同促进了rBMSCs在纤维膜表面的成骨分化。此外,外泌体可以在体内缺血或坏死微环境中起到减少细胞凋亡、趋化和增殖的作用,同时募集MSCs并促进其增殖和成骨分化,促进血管形成[31],这也有利于其在体内复杂的环境中实现综合的牙周组织再生效果。
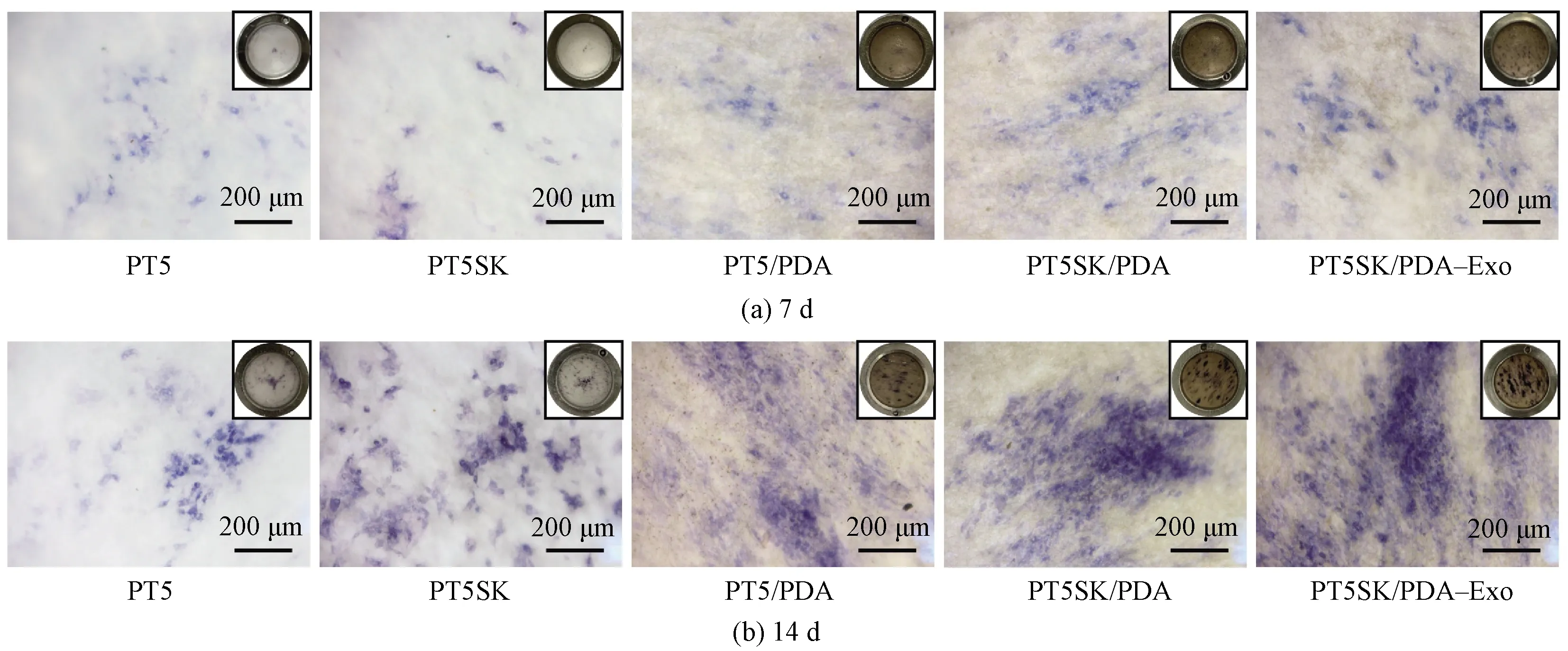
图6 rBMSCs在纤维膜上成骨诱导7和14 d的ALP染色图Fig.6 ALP staining of rBMSCs osteogenic on fibrous membranes at 7 d and 14 d
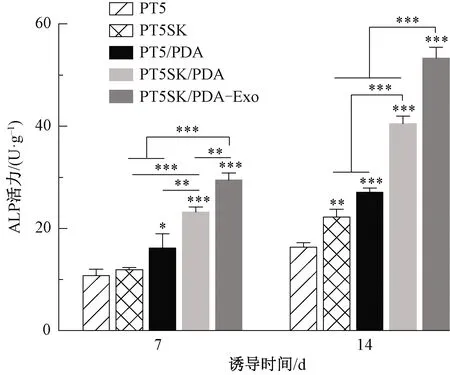
图7 rBMSCs在纤维膜上成骨诱导7和14 d的ALP活力Fig.7 ALP activity of rBMSCs osteogenic on fibrous membranes at 7 d and 14 d
3 结 论
本文通过静电纺丝法制备了聚己内酯/β-磷酸三钙(PCL/β-TCP)复合纳米纤维膜,采用溶剂诱导结晶法成功制备出串晶结构。对PCL/β-TCP串晶纤维膜进行聚多巴胺(PDA)修饰,PCL/β-TCP/PDA串晶纤维膜表面浸润性和蛋白吸附能力显著提高。外泌体通过PDA的黏附作用负载于纤维膜上,该功能化纤维膜显示出最利于大鼠骨髓间充质干细胞(rBMSCs)成骨分化的特性,显著促进碱性磷酸酶(ALP)活性的增加,有望应用于体内加速牙槽骨愈合。
