超声辅助提取金花茶叶多酚的工艺优化及其抗氧化活性研究
2022-03-27陈铁杨胡文忠侯梦阳陈雁王佳宇闫丽娜
陈铁杨,胡文忠,侯梦阳,陈雁,王佳宇,闫丽娜
(1.大连工业大学 食品学院,辽宁 大连 116034;2.大连民族大学 生命科学学院,辽宁 大连 116600;3.大连理工大学生命科学与技术学院,辽宁 大连 116024)
金花茶[Camellia petelotii(Merrill)Sealy],为山茶科山茶属植物,主要分布于广西防城港市,为国家一级保护植物,是一种具有开发利用价值的特有珍稀植物资源,具有独特的观赏价值、经济价值和药用价值[1-3]。金花茶含有多酚、多糖、总皂苷等成分以及锗、锌、硒等能够维持机体健康的微量元素。研究表明,金花茶花朵具有抗抑郁、抗肿瘤、抗氧化、降血脂和保护心脑血管等作用[4-7]。金花茶叶片用作茶饮,可起到清热解毒、利咽止痛、利尿消肿和增强体质等保健功效[8-9]。近年来金花茶被逐渐应用于食品、化妆品等功能性健康产品的开发,但是金花茶叶并未得到科学合理的开发利用。
植物多酚是植物体内的次级代谢产物,具有抗氧化、抗肿瘤、抑菌和增强免疫力等多种生物活性,已广泛应用于食品、保健、生物医药等领域[10-11]。酚类物质的传统提取方法包括热水浸提法、回流提取法等,但是存在提取效率不高、提取时间长和步骤复杂等问题[12-13]。超声波辅助法的提取效果较为理想,可以大大缩短提取时间、提高提取效率、降低成本消耗和保护天然活性成分功效,是一种常应用于天然产物活性成分领域的提取方法[14-16]。
目前针对金花茶叶多酚的提取工艺研究未见报道,本研究采用超声波辅助法提取金花茶叶多酚,并通过正交试验对金花茶叶多酚的提取工艺进行优化,同时对金花茶叶多酚提取物的体外抗氧化活性进行评价,以期为金花茶叶多酚的开发利用提供科学参考。
1 材料与方法
1.1 材料与试剂
金花茶叶:采摘于广西防城港市;没食子酸(标准品)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氨-二-(3-乙基-苯并噻-6-磺酸)二胺盐[2,2-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid,ABTS)]、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox):上海源叶科技有限公司;无水乙醇、无水碳酸钠(均为分析纯):天津科密欧试剂有限公司;总抗氧化能力检测试剂盒:苏州科铭有限公司;福林酚试剂(均为分析纯):北京索莱宝有限公司。
1.2 仪器与设备
DHG-250电热恒温干燥箱:杰瑞尔电器公司;DW-160中药粉碎机:永康市铂欧五金有限公司;FA1204B分析天平:瑞士METTLER TOLEDO公司;KQ-320E超声波清洗器:昆山超声仪器公司;SHZ-Ⅱ循环水式多用真空泵:河南艾瑞德设备公司;HH-S8电热恒温水浴锅:上海森信仪器公司;Multiskan GO酶标仪:美国THERMO SCIENTFIC公司;RE-201D旋转蒸发仪:上海亚荣仪器公司。
1.3 试验方法
1.3.1 金花茶叶多酚的制备
将新鲜采摘的金花茶叶洗净,在60℃下烘干,粉碎,过60目筛后装入密封袋中,避光保存,备用。准确称取1.0 g粉末,按预定的乙醇浓度、料液比、提取温度和提取时间在超声波清洗器中进行多酚提取(固定功率为100 W,固定频率为40 kHz),合并提取液,过滤,得到金花茶叶多酚提取溶液。
1.3.2 金花茶叶多酚含量的测定
没食子酸标准曲线的建立参考Hao等[17]的报道,并略加修改。首先配制40 μg/mL~120 μg/mL没食子酸工作液,分别吸取0.25 mL不同浓度的没食子酸工作液于试管内,向试管内加入1.25 mL的福林酚试剂(用去离子水稀释10倍),摇匀。25℃避光反应3 min,接着加入1.0 mL的7.5%碳酸钠溶液,在45℃水浴锅中加热60 min,于765 nm处下测定吸光度,得线性回归方程为 y=0.092 1x+0.197 9(R2=0.999 6)。
金花茶叶多酚提取量计算公式如下。

式中:C 为多酚质量浓度,mg/mL;V 为体积,mL;n为稀释倍数;W为样品质量,g。
1.3.3 单因素试验
准确称取1.0 g金花茶叶粉末,采用超声辅助法进行多酚提取,考察乙醇浓度(40%、50%、60%、70%、80%、90%)、提取时间(10、20、30、40、50、60 min)、提取温度(25、35、45、55、65、75 ℃)和料液比[1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)]对金花茶叶多酚提取量的影响。
1.3.4 正交试验设计
在单因素试验的基础上,采用正交试验考察乙醇浓度、提取时间、提取温度和料液比对金花茶叶多酚提取量的影响,相应因素水平见表1。
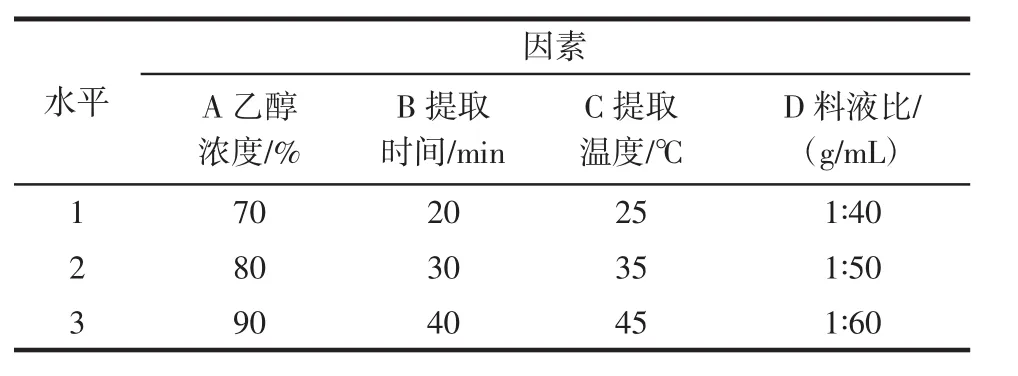
表1 正交试验因素水平Table 1 Factors and levels of orthogonal experiment
1.3.5 抗氧化活性试验
1.3.5.1 DPPH自由基清除能力测定
参考Hou等[18]测定方法并略加修改。现配浓度为0.5 mmol/L的DPPH-无水乙醇溶液,备用。分别吸取240 μL不同浓度样品溶液,加入60 μL DPPH-无水乙醇溶液,摇匀,于酶标仪25℃孵育30 min,在517 nm处测定样品溶液吸光度A1。按照相同方法,吸取样品溶液和无水乙醇,测定吸光度A2;吸取无水乙醇和DPPH溶液,测定吸光度A0。以Trolox溶液作为阳性对照。DPPH自由基清除率计算公式如下。

1.3.5.2 ABTS+自由基清除能力测定
参考Shen等[19]测定方法并略加修改。使用蒸馏水配制50 mL 7 mmol/L ABTS和50 mL 2.45 mmol/L过硫酸钾溶液,混匀,室温下避光反应16 h,得到ABTS母液。蒸馏水稀释ABTS工作液,使其在734 nm处吸光值稳定在0.7±0.02范围内,即制备得到ABTS工作液。
分别吸取50μL不同浓度的样品溶液,加入200μL ABTS工作液,摇匀,于酶标仪37℃孵育10 min,在734 nm处测定吸光度A1。按照相同方法,吸取样品溶液和蒸馏水,测定吸光度A2;吸取蒸馏水和ABTS工作液,测定吸光度A0。以Trolox溶液作为阳性对照。ABTS+自由基清除率计算公式如下。

1.3.5.3 总抗氧化能力测定
总抗氧化能力采用总抗氧化能力检测试剂盒进行测定。
1.4 数据处理
每组试验重复3次,试验结果使用Excel 2010、SPSS 19.0、Origin 2018等软件进行分析和图形绘制。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇浓度对金花茶叶多酚提取量的影响
乙醇浓度对金花茶叶多酚提取量的影响见图1。

图1 乙醇浓度对金花茶叶多酚提取量的影响Fig.1 Effect of ethanol concentration on extraction yield of polyphenols from Camellia petelotii leaves
由图1可知,乙醇浓度40%~80%时,多酚提取量在不断提高,而且呈现较快的增长速度,当乙醇浓度80%时,多酚提取量最高,达到167.50 mg/g,随后下降。原因可能是乙醇浓度过高时,多酚与溶剂的极性相差很大,蛋白质变性沉淀,同时会有大量脂溶性、醇溶性物质溶解,导致酚类化合物的溶解度降低[20-22]。因此,选择最佳乙醇浓度为80%进行后续试验。
2.1.2 提取时间对金花茶叶多酚提取量的影响
提取时间对金花茶叶多酚提取量的影响见图2。
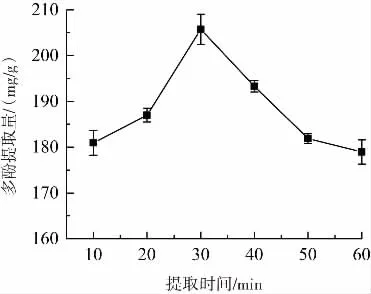
图2 提取时间对金花茶叶多酚提取量的影响Fig.2 Effect of extraction time on extraction yield of polyphenols from Camellia petelotii leaves
由图2可知,提取时间由10min增加至30min时,多酚提取量在不断提高,当提取时间为30 min时,多酚提取量最高,达到205.70 mg/g,继续延长提取时间,提取量呈下降趋势。原因可能是在一定的提取时间内,随着提取时间的延长,多酚会通过超声波空化效应和机械效应不断溶出。提取时间过长时,会使多酚被逐渐分解和多糖、皂苷等杂质溶出,导致多酚提取量下降[23-25]。因此,选择最佳提取时间为30 min进行后续试验。
2.1.3 提取温度对金花茶叶多酚提取量的影响
提取温度对金花茶叶多酚提取量的影响见图3。

图3 提取温度对金花茶叶多酚提取量的影响Fig.3 Effect of extraction temperature on extraction yield of polyphenols from Camellia petelotii leaves
由图3可知,提取温度由25℃升高至35℃时,多酚提取量不断提高,当提取温度达到35℃时,多酚提取量最高,达到214.74 mg/g,随后开始明显下降。原因可能是金花茶叶对于温度特别敏感,随着体系温度升高,会提高分子的扩散能力,加大分子的运动速率,加速多酚的溶出,提高多酚提取量。当提取温度继续升高时,超声波热效应会使多酚结构被破坏和其他杂质溶出,多酚物质无法继续溶出,而且酚类结构对高温比较敏感,最终导致多酚提取量下降[26-28]。因此,选择最佳提取温度为35℃进行后续试验。
2.1.4 料液比对金花茶叶多酚提取量的影响
料液比对金花茶叶多酚提取量的影响见图4。
由图 4 可知,料液比由 1∶10(g/mL)增加至 1∶50(g/mL)时,多酚提取量随之提高,当料液比为1∶50(g/mL)时,提取量达到最高,为281.33 mg/g,随后开始下降。原因可能是料液比过小时,提取溶剂与样品接触不完全因而提取量很低,不断增加料液比后,多酚物质会逐渐溶出。但是继续增加料液比,其他杂质溶出量会增加,而且增加浓缩多酚的时间,造成资源浪费和成本增加[29-31]。因此,选择最佳料液比为 1∶50(g/mL)进行后续试验。

图4 料液比对金花茶叶多酚提取量的影响Fig.4 Effect of material-to-liquid ratio on extraction yield of polyphenols from Camellia petelotii leaves
2.2 正交试验结果
正交试验结果见表2。

表2 正交试验结果Table 2 The results of orthogonal experiment
由表2可知,影响提取量的主次顺序为A(乙醇浓度)>D(料液比)>C(提取温度)>B(提取时间),结果表明乙醇浓度是最显著的影响因素,提取时间对金花茶叶多酚提取量影响较小。正交试验优化金花茶叶多酚提取量的最佳提取工艺参数组合为A3B2C2D2,即乙醇浓度90%、提取时间30 min、提取温度35℃、料液比1∶50(g/mL)。在此工艺条件下进行验证试验,重复3组试验,得到金花茶叶多酚提取量为295.82 mg/g。
2.3 抗氧化活性测定结果
2.3.1 金花茶叶多酚对DPPH自由基清除能力的影响
金花茶叶多酚对DPPH自由基清除能力的影响见图5。
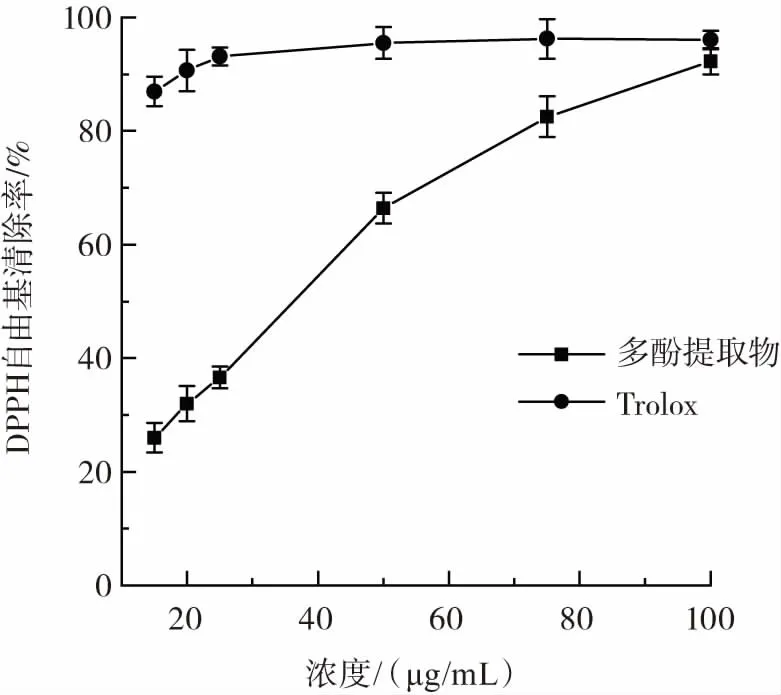
图5 金花茶叶多酚对DPPH自由基清除能力的影响Fig.5 Effects of Camellia petelotii leaves polyphenols on the scavenging ability of DPPH free radicals
由图5可知,在15 μg/mL~100 μg/mL浓度范围内,金花茶叶多酚和Trolox溶液对DPPH自由基具有一定的清除能力,并且清除率随浓度的增加而提高,金花茶叶多酚清除率从25.98%上升至92.27%,呈现出良好的线性关系。Trolox清除率基本保持在96.25%,随着质量浓度的增加,金花茶叶多酚的清除率逐步接近Trolox溶液,却略低于Trolox溶液清除率,其IC50值为0.030 9 mg/mL,表明Trolox溶液的DPPH自由基清除能力高于金花茶叶多酚。
2.3.2 金花茶叶多酚对ABTS+自由基清除能力的影响
金花茶叶多酚对ABTS+自由基清除能力的影响见图6。

图6 金花茶叶多酚对ABTS+自由基清除能力的影响Fig.6 Effects of Camellia petelotii leaves polyphenols on the scavenging ability of ABTS+free radicals
由图6可知,在15 μg/mL~100 μg/mL浓度范围内,金花茶叶多酚和Trolox溶液对ABTS+自由基均具有较好的清除能力,清除率随浓度的增加而增强,金花茶叶多酚清除率从23.04%升高至78.85%,浓度和清除率呈现正相关线性关系,但是明显低于Trolox溶液的清除率,其IC50值为0.043 4 mg/mL。
2.3.3 金花茶叶多酚对总抗氧化能力的影响
金花茶叶多酚对总抗氧化能力的影响见图7。

图7 金花茶叶多酚对总抗氧化能力的影响Fig.7 Effect of Camellia petelotii leaves polyphenols on total antioxidant capacity
由图7可知,在0.4 mg/mL~2.4 mg/mL浓度范围内,多酚提取物总抗氧化能力随着样品浓度的增加而增强,浓度与总抗氧化能力表现出正相关性,并不断接近Trolox溶液的总抗氧化能力,但一直低于Trolox溶液的总抗氧化能力。金花茶叶多酚提取物浓度为2.4 mg/mL时,其总抗氧化能力为0.82 mmol/L,表明其具有较好的总抗氧化能力。
3 结论
本试验通过正交试验优化得到金花茶叶多酚最佳提取工艺条件为乙醇浓度90%,提取时间30 min,提取温度35℃,料液比1∶50(g/mL),在此条件下多酚提取量达295.82 mg/g。DPPH、ABTS+自由基清除能力及总抗氧化能力试验结果表明,金花茶叶多酚提取物具有一定的抗氧化能力,其IC50值分别为0.030 9、0.043 4 mg/mL,总抗氧化能力为0.82 mmol/L。本试验可为进一步提高金花茶叶资源的有效开发利用提供科学依据。
