miR-9介导HIF-1α通路对妊娠滋养细胞氧化应激损伤的影响
2022-03-27金良怡尹智华
金良怡 尹智华


【摘要】 目的:探討miR-9介导缺氧诱导因子-1α(HIF-1α)通路对妊娠滋养细胞氧化应激损伤的影响。方法:对数生长期的JEG-3细胞随机分为对照组、miR-NC组与miR-9组,miR-NC组与miR-9组转染终浓度为100 nmol/L的miR-NC与miR-9 mimics,对照组转染等体积的磷酸盐缓冲液。采用MTT法检测细胞增殖,Annexin V/FITC检测细胞凋亡,Transwell小室实验检测细胞侵袭,酶联免疫法检测氧化应激损伤指标,蛋白质印迹法检测HIF-1α蛋白表达。结果:转染后24、36 h,miR-9组细胞侵袭指数与细胞增殖指数均明显较对照组与miR-NC组低(P<0.05),细胞凋亡指数均高于对照组与miR-NC组(P<0.05)。转染后24、36 h,miR-9组的SOD含量均高于对照组与miR-NC组(P<0.05),MDA含量、HIF-1α蛋白相对表达水平均低于对照组与miR-NC组(P<0.05)。结论:miR-9在妊娠滋养细胞的高表达能抑制HIF-1α的表达,维持氧化应激处于平衡状态,从而促进细胞凋亡,抑制细胞增殖与侵袭。
【关键词】 miR-9 妊娠滋养细胞 缺氧诱导因子-1α 氧化应激 细胞凋亡 细胞增殖
Effects of miR-9-mediated HIF-1α Pathway on Oxidative Stress Damage of Gestational Trophoblasts/JIN Liangyi, YIN Zhihua. //Medical Innovation of China, 2022, 19(02): 0-027
[Abstract] Objective: To investigate the effects of miR-9-mediated Hypoxia-inducible factor-1α (HIF-1α) pathway on the oxidative stress damage of gestational trophoblasts. Method: JEG-3 cells in logarithmic growth phase were randomly divided into three groups-control group, miR-NC group and miR-9 group, miR-NC group and miR-9 group were transfected with miR-NC and miR-9 mimics at final concentration of 100 nmol/L, the control group were transfected with equal volume of phosphate buffer. MTT method were used to detect cell proliferation, Annexin V/FITC were to detect cell apoptosis, Transwell chamber were to detect cell invasion, enzyme-linked immunoassay were to detect oxidative stress damage indicators, Western blotting were to detect HIF-1α protein expression. Result: At 24 h and 36 h after transfection, the cell proliferation index and cell invasion index of the miR-9 group were lower than those of the the control group and miR-NC group (P<0.05), and the apoptosis index were higher than those of the the control group and miR-NC group (P<0.05). At 24 h and 36 h after transfection, the SOD content of miR-9 group were higher than those of the control group and miR-NC group (P<0.05), MDA content and relative expression levels of HIF-1α protein were lower than those of the control group and miR-NC group (P<0.05). Conclusion: The high expression of miR-9 in gestational trophoblasts can inhibit the expression of HIF-1α, maintain oxidative stress in balanced state, promote cell apoptosis, inhibit cell proliferation and invasion.
[Key words] miR-9 Gestational trophoblast Hypoxia-inducible factor-1α Oxidative stress Apoptosis Cell proliferation
First-author’s address: Shenyang Women’s and Children’s Hospital, Shenyang 110011, China
doi:10.3969/j.issn.1674-4985.2022.02.006
胎盘是联系胎儿和母体的纽带,有免疫屏障、物质转运、内分泌等多种功能。滋养细胞可参与人类胎盘的形成,能分泌一些血管舒缩物质、胎盘激素、酶和体液因子,通过旁分泌、自分泌等途径调节着胎盘的血液循环[1]。妊娠滋养细胞的氧化应激损伤可参与对母体免疫损害或病原体入侵的监视活动,对胎儿-胎盘血管张力产生不良影响,也可影响该部位的血管渗透压[2-3]。miRNA是内源性非编码小分子RNA,能通过靶向调控mRNA的表达,从而参与调控机体细胞的生物学功能,对于滋养细胞的增殖、凋亡、生长等方面均有重要的调控作用[4]。miR-9被认为是一种能够促进多种肿瘤发生发展的重要的原癌microRNA,能抑制心肌氧化损伤,促进心肌细胞增殖,也能促进肿瘤细胞增殖与肿瘤血管生成[5-6]。缺氧诱导因子-1α(HIF-1α)是哺乳动物和人体内的核转录因子,可介导肿瘤细胞的运动与生长[7]。HIF-1α可参与调节细胞PI3K/AKT/FRAP途径,从而调节细胞增殖与凋亡[8-9]。本文具体探讨了miR-9介导HIF-1α通路对妊娠滋养细胞氧化应激损伤的影响,希望能够揭示miR-9介导在妊娠滋养细胞的分子作用机制。现报道如下。
1 材料与方法
1.1 材料 本研究在2018年1月-2020年12月进行。JEG-3绒毛膜癌细胞购自中国科学院上海细胞生物所,低糖DMEM培养液、0.25%胰蛋白酶、胎牛血清购自美国Gibco公司,AnnexinV-FITC/PI细胞凋亡双染试剂盒购自美国BD公司,SDS-PAGE蛋白上样缓冲液、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术公司,Western blot检测一抗购自美国Sigma公司,miR-9 mimics(模拟物)、miR-NC购自德国吉玛公司、TRIzol提取试剂购自北京康为世纪生物科技公司、PCR检测试剂盒购自上海雅吉生物公司,脂质体转染试剂、MTT检测试剂盒购自美国Invitrogen公司。
1.2 细胞分组与转染 对数生长期的JEG-3细胞随机分为对照组、miR-NC组与miR-9组,miR-NC组与miR-9组转染终浓度为100 nmol/L的miR-NC与miR-9 mimics,对照组转染等体积的磷酸盐缓冲液,转染后6 h进行换液培养。
1.3 MTT法检测细胞增殖 取对数生长期细胞,培养24 h后进行转染,转染后培养24、36 h弃去上清,加入终浓度0.5 g/L MTT 100 μL,继续培养4 h,将上清液弃除,加入150 μL DMSO后震荡,时间为10 min,在490 nm下测定吸光度,从而计算细胞增殖指数。
1.4 Annexin V/FITC检测细胞凋亡 采用胰酶消化细胞,1 000 r/min离心5 min,弃上清,用400 μL Annexin V/FITC结合液悬浮细胞,调整细胞浓度为1×109个/L。加入5 μL Annexin V/FITC染色液与10 μL PI染色液,避光孵育15 min,采用FACS Calibur流式细胞仪检测细胞凋亡指数。
1.5 细胞侵袭 取基质胶100 μL,将其均匀覆盖于Transwell的小室底部,调整细胞浓度后加入至Transwell上室中,并在下室中加入培养基,之后行固定、染色,在显微镜下拍照、计数,计算细胞侵袭指数。
1.6 氧化应激损伤指标测定 收集细胞,1 000 r/min离心5 min,弃上清,重悬于0.5 mL缓冲液中,超声破碎细胞,采用酶联免疫法检测上清SOD和MDA水平。
1.7 蛋白质印迹法检测HIF-1α蛋白表达 提取各组细胞总蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,半干法转移到PVDF膜上,5%脱脂奶粉封闭2 h,加入一抗(HIF-1α,1︰1 000;β-actin,1︰2 000)4 ℃孵育过夜,二抗(1︰2 000)室温孵育1 h,加入化学发光增强试剂,曝光显影后采用图像分析系统进行分析。上述实验都重复3次。
1.8 统计学处理 SPSS 23.00软件,计量数据用(x±s)表示,两两对比为LSD-t检验,多组间使用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
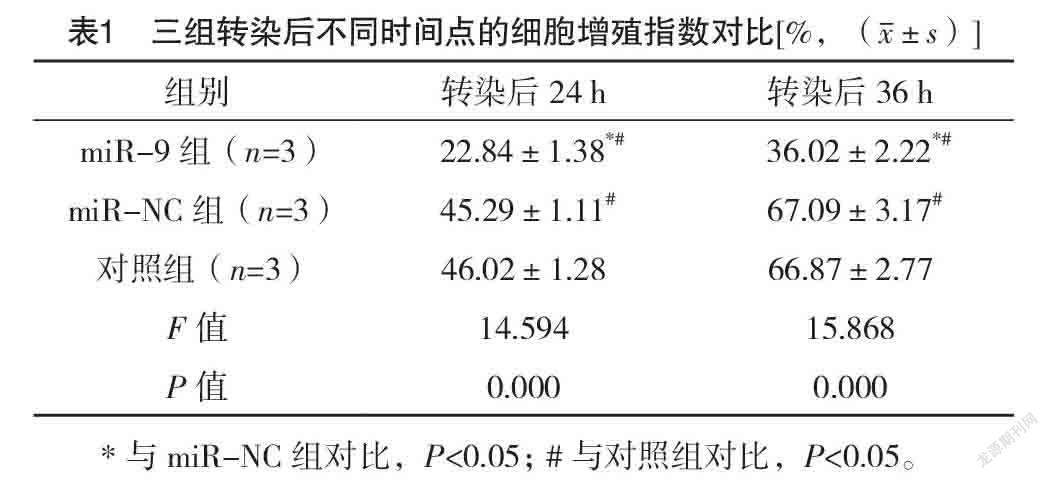
2.1 三组转染后不同时间点的细胞增殖指数对
比 转染后24、36 h,三组细胞增殖指数比较,差异均有统计学意义(P<0.05);转染后24、36 h,miR-9组的细胞增殖指数均较对照组、miR-NC组低(P<0.05)。见表1。
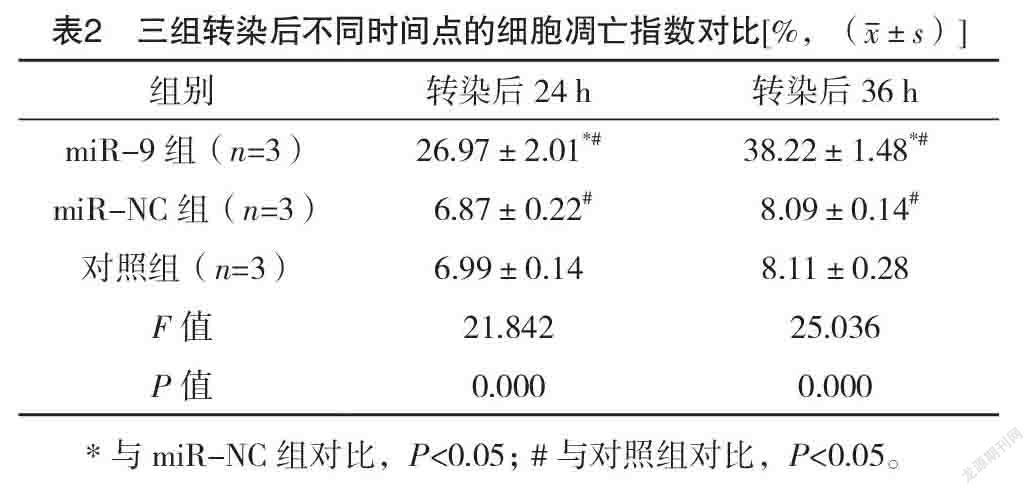
2.2 三組转染后不同时间点的细胞凋亡指数对
比 转染后24、36 h,三组细胞凋亡指数比较,差异均有统计学意义(P<0.05);转染后24、36 h,miR-9组的细胞凋亡指数均高于对照组与miR-NC组(P<0.05)。见表2。
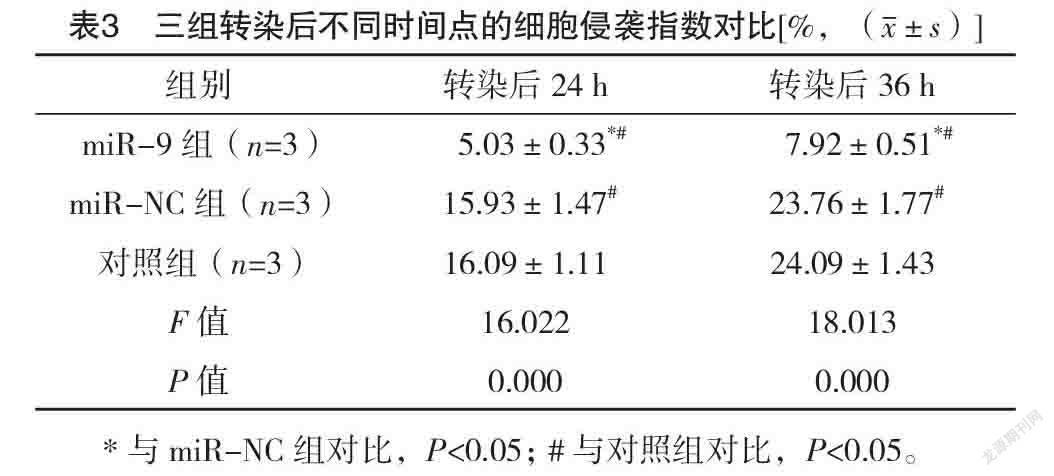
2.3 三组转染后不同时间点的细胞侵袭指数对
比 转染后24、36 h,三组细胞侵袭指数比较,差异均有统计学意义(P<0.05);转染后24、36 h,miR-9组的细胞侵袭指数均明显较对照组与miR-NC组低(P<0.05)。见表3。
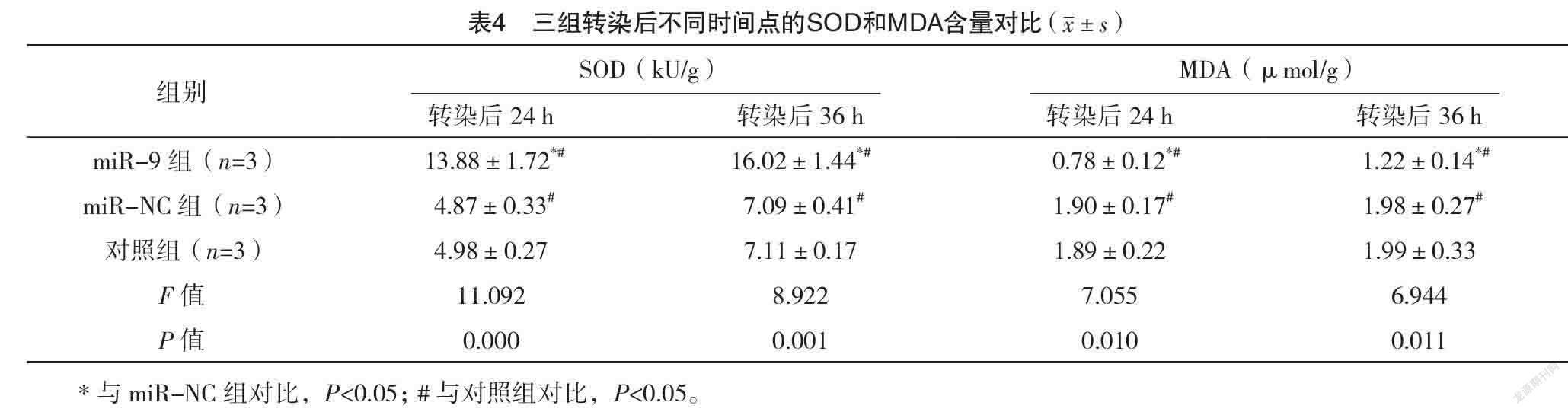
2.4 三组转染后不同时间点的SOD和MDA含量对比 转染后24、36 h,三组SOD和MDA比较,差异均有统计学意义(P<0.05);转染后24、36 h,miR-9组的SOD含量均明显较对照组与miR-NC组高(P<0.05),MDA含量均低于对照组与miR-NC组(P<0.05)。见表4。
2.5 三组转染后不同时间点的HIF-1α蛋白相对表达水平对比 转染后24、36 h,三组HIF-1α蛋白相对表达水平比较,差异均有统计学意义(P<0.05);转染后24、36 h,miR-9组的HIF-1α蛋白相对表达水平均明显较对照组与miR-NC组低(P<0.05)。见图1与表5。
3 讨论
胎儿-胎盘循环具有血流量大、缺少自主神经支配、低血流阻力等特点,主要靠血管活性物质来维持其循环状态。当机体缺乏葡萄糖、脂质过度负荷、病毒感染、分泌蛋白合成增加等均可影响机体的氧化应激状态,有可能导致应激损伤,从而诱发细胞功能受损疾病的发生[10-11]。miR-9在不同的组织部位具有不同的表达谱,在免疫反应、炎性反应、病毒感染等多种疾病中有重要作用。有研究认为miR-9能通过作用于不同靶向基因参与恶性肿瘤的发生及发展过程,miR-9可通过靶向下调促癌基因的编导,从而促进恶性肿瘤细胞的生长及侵袭[12-13]。本研究显示转染后24、36 h,miR-9组的细胞增殖、侵袭指数均低于对照组与miR-NC组(P<0.05),表明miR-9在妊娠滋養细胞的高表达能抑制细胞增殖与侵袭。
microRNA是由23个核苷酸组成的非编码单链RNA分子,可参与机体的多个生命过程中。胎盘作为母婴物质交换界面的同时也是内分泌器官,可通过妊娠滋养细胞发生重要作用。miRNA与妊娠滋养行疾病的发生及发展显著相关[14-15]。本研究显示转染后24、36 h,miR-9组的细胞凋亡指数均高于对照组与miR-NC组(P<0.05),表明miR-9在妊娠滋养细胞的高表达能促进细胞凋亡。
氧化应激在妊娠糖尿病与妊娠高血压发病中发挥关键作用,和正常妊娠相比,妊娠糖尿病与妊娠高血压孕妇的胎盘中抗氧化酶减少与脂质过氧化物增加[16]。正常情况下,机体内活性氧的产生和清除处于动态平衡状态,内外在各种因素的刺激可导致活性氧大量生成,可超过抗氧化系统的清除能力,造成机出现氧化应激状态,从而导致病理损伤[17]。本研究显示转染后24、36 h,miR-9组的SOD含量均高于对照组与miR-NC组(P<0.05),MDA含量均低于对照组与miR-NC组(P<0.05),表明miR-9在妊娠滋养细胞的高表达能改善氧化应激状态。SOD是体内抗氧化防御系统的主要防线,SOD水平下降可诱发MDA的产生,而后者对细胞有毒性作用,可间接反映氧自由基的存在及对细胞的损伤程度,从而影响细胞增殖与凋亡[18-19]。
HIF-1α是HIF-1特有的活性亚单位,对HIF-1的活性发挥决定性作用。肿瘤细胞中的HIF-1α活性增加,表明肿瘤细胞的增殖与侵袭水平增加[20]。miR-9可通过靶向调控HIF-1α发挥对细胞各项生命活动的调节作用[21]。本研究显示转染后24、36 h,miR-9组的HIF-1α蛋白相对表达水平均低于对照组与miR-NC组(P<0.05),表明miR-9在妊娠滋养细胞的高表达能抑制HIF-1α的表达。不过本研究并未明确HIF-1α是否为miR-9的下游靶基因,后续还需要进行深入分析。
综上所述,miR-9在妊娠滋养细胞的高表达能抑制HIF-1α的表达,维持氧化应激处于平衡状态,从而促进细胞凋亡,抑制细胞增殖与侵袭。
参考文献
[1]张静,王光允,张秀梅,等.妊娠高血压疾病与血管细胞粘附因子相关性的研究[J].临床和实验医学杂志,2015,14(15):1267-1269.
[2]吴琪瑞,王艳华,柴丽芬,等.circRNA RBM39与miR-5088-5p在缺氧诱导的滋养细胞自噬中的作用[J].实用医学杂志,2020,36(5):570-574.
[3] DE SOUZA M G,DE JESUS S F,SANTOS E M,et al.Radiation Therapy Reduced Blood Levels of LDH, HIF-1α, and miR-210 in OSCC[J].Mol Genet Genomic Med,2020,26(1):433-442.
[4] LIU Z Z,TIAN Y F,WU H,et al.LncRNA H19 promotes glioma angiogenesis through miR-138/HIF-1α/VEGF axis[J].Neoplasma,2020,67(1):111-118.
[5] YU M,OZAKI T,SUN D,et al.HIF-1α-dependent miR-424 induction confers cisplatin resistance on bladder cancer cells through down-regulation of pro-apoptotic UNC5B and SIRT4[J].
J Exp Clin Cancer Res,2020,39(1):108.
[6] ZHANG H,LIU X,YANG F,et al.Overexpression of HIF-1α protects PC12 cells against OGD/R-evoked injury by reducing miR-134 expression[J].Cell Cycle,2020,19(9):990-999.
[7] WANG H,ZHAO Y,LUO R,et al.A positive feedback self-regulatory loop between miR-210 and HIF-1α mediated by CPEB2 is involved in trophoblast syncytialization: implication of trophoblast malfunction in preeclampsia[J].Cell Cycle,2020,102(3):560-570.
[8] WANG X,LI L,ZHAO K,et al.A novel LncRNA HITT forms a regulatory loop with HIF-1α to modulate angiogenesis and tumor growth[J].Clin Exp Pharmacol Physiol,2020,27(4):1431-1446.
[9]高艳,杨洋,延佳佳,等.miR-18a对人滋养细胞中再生蛋白1
表达的影响[J].山西医科大学学报,2019,50(6):758-761.
[10]潘平山,覃嘉怡.胎盘循环与胎儿生长受限的研究进展[J/OL].实用妇科内分泌杂志(电子版),2018,5(20):13-14.
[11]杨娟,谢莹莺.miR-182调控HIF-2α通路对低氧诱导子痫前期滋养细胞侵袭的影响[J].安徽医科大学学报,2020,55(6):876-881.
[12]张丽华.miR-181a和GATA6在妊娠滋养细胞疾病中的表达及临床意义[J].河北医药,2020,42(9):1315-1319.
[13]陈芳荣,龚护民,郑林媚.长链非编码RNA MALAT1与微小核糖核酸-146a相互作用对子痫前期滋养细胞功能的影响[J].海南医学院学报,2020,26(12):915-920.
[14]李想.受孕激素调控的miR-31在乳腺发育中的功能与分子机制[D].北京:中国农业大学,2017.
[15]张婧怡,冯玲,贾静,等.miRNA-101通过调控胎盘滋养细胞功能参与妊娠期糖尿病的发病[J].现代妇产科进展,2019,28(7):518-522.
[16]许凡萍,汪启兵,刘艳玲,等.氧化应激与妊娠疾病的相关性研究[J].生命的化学,2016,36(6):929-933.
[17] ZHU L,MU J,WU Y,et al.Role of HIF-1α in Cold Ischemia Injury of Rat Donor Heart Via the miR-21/PDCD4 Pathway[J].Cell Death Differ,2020,52(1):383-391.
[18]刘慧敏,李筱薇,李会芳.妊娠期糖尿病发病与妊娠期氧化应激强度的相关性以及还原性谷胱氨肽的治疗效果[J].中国妇幼保健,2019,34(8):1734-1737.
[19]张晨晨,韦有恒,丰有吉,等.妊娠期糖尿病患者氧化应激水平变化及临床意义[J].现代生物医学进展,2019,19(1):52-57.
[20] HAN N,XU H,YU N,et al.MiR-203a-3p inhibits retinal angiogenesis and alleviates proliferative diabetic retinopathy in oxygen-induced retinopathy (OIR) rat model via targeting VEGFA and HIF-1α[J].Pathol Oncol Res,2020,47(1):85-94.
[21] KARSHOVSKA E,WEI Y,SUBRAMANIAN P,et al.HIF-1α (Hypoxia-Inducible Factor-1α) Promotes Macrophage Necroptosis by Regulating miR-210 and miR-383[J].Arterioscler Thromb Vasc Biol,2020,40(3):583-596.
(收稿日期:2021-05-26) (本文編辑:张爽)
