基于模型构建的中考化学工艺流程解题策略
2022-03-27李鹏


摘 要:化学工艺流程题成为近年来中考命题的热点,借助基于反应线、除杂线、分离线的解题模型构建,将整个流程分为原料处理,反应、除杂、分离和产物生成三个部分知识点,化繁为简,问题就迎刃而解.
关键词:工艺流程;模型构建;解题策略;化学中考
中图分类号:G632 文献标识码:A 文章编号:1008-0333(2022)05-0135-03
收稿日期:2021-11-15
作者简介:李鹏,男,福建省仙游人,硕士,中学二级教师,从事中学化学教学研究.
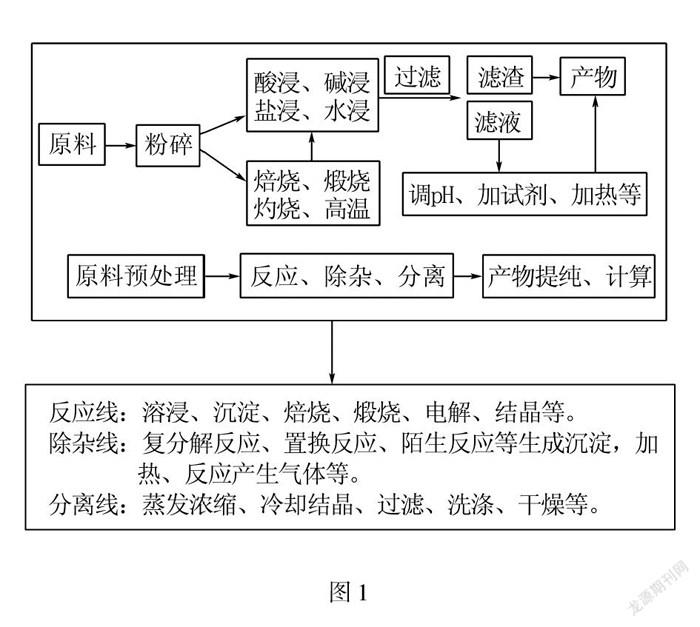
1 模型构建
《普通高中化学课程标准(2017年版)》提出化学的学科核心素养,是学生通过学科学习而逐步形成的正确价值理念、必备品格和关键能力,化学学科核心素养包括“宏观辨识与微观探析”,“变化观念与平衡思想”,“证据推理与模型认知”,“科学探究与创新意识”,“科学态度与社会责任”5个方面,其中“证据推理与模型认知”要求学生通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律.为了与高中的新课程标准变化相互衔接,近年来各地中考试题中考查学生信息获取和解决实际问题能力的化学工艺流程图题型频繁出现,重点考查的是学生能够将学到的知识运用到具体的工艺流程中,学生不仅要掌握本学科综合知识还需要学生的解决实际化学问题的能力,而且设计比较新颖,所以该题型逐渐成为各地中考的必考题,但是学生在解题的过程缺乏解题的策略而导致失分,学生仅凭掌握的零散知识点去解题往往会事倍功半,如再碰到陌生情境就更加束手無策.本文通过构建化学工艺流程题模型,着重构建反应线、除杂线、分离线为基础的化学工艺流程题解题模型如图1所示,学生通过建立该题型的认知模型,就能应用模型解答此类题型中的设问,做到举一反三,事半功倍.
2 解题策略
2.1 原料处理环节粉粹的目的是增大反应物的接触面积,加快反应速率以及提高原料利用率.
2.2 反应、除杂和分离环节.
2.2.1 反应线,见表1.
2.2.2 除杂线:
分析产物的组成,通过元素守恒进行判断,把难溶性杂质进行过滤以滤渣形式除去,而可溶性杂质可以利用复分解反应,题目所给的反应信息生成沉淀、气体等进行转化除杂,涉及到的比较多的操作名称为过滤,玻璃仪器为烧杯,漏斗,玻璃棒.
2.2.3 分离线,见表2.
3 例题解析
例1 (2020年广州 节选)某工厂生产硼砂产生的固体废料,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2O3等,其中MgCO3质量分数为63%.回收镁的工艺流程如图2所示.
(1)“酸浸”时MgCO3发生反应的化学方程式为_________.
(2)“调pH”前滤液I的pH_________7(填“>”或“<”).
(3)滤液Ⅲ中可回收的主要物质_________(填化学式).
(4)已知固体废料质量为m,理论上可生产
Mg(OH)2的质量为_________.
本题是2020年的广州中考试题,是由2009年的广东高考题经过改编而成,在情境设置和能力要求的考查水平对于初三学生来讲已经属于较难题型,但是考生可以利用工艺流程题的解题模型把本题分逐一分割为三部分的知识点,化整为零,轻松解题.首先“酸浸”为原料处理环节,MgCO3与过量的H2SO4发生反应,初中已有的能与酸反应的有碱,部分符合复分解反应规律的盐和金属氧化物,本题干中MgCO3、CaCO3、SiO2、Al2O3和Fe2O3都可以与
H2SO4反应,学生可以轻松写出MgCO3与硫酸的化学方程式;酸浸时H2SO4要过量,自然容易得出滤液的pH<7.其次酸浸之后是反应、除杂和分离环节,本题的主要反应为复分解反应,分离的主要操作是过滤,滤液I中的溶质有过量的H2SO4、MgSO4、Al2(SO4)3和
Fe2(SO4)3,加入NaOH后H2SO4先和NaOH反应产生H2O和Na2SO4;Al2(SO4)3和
Fe2(SO4)3和NaOH发生复分解反应产生氢氧化铝沉淀、氢氧化铁沉淀和Na2SO4;然后是MgSO4和NaOH反应产生氢氧化镁沉淀和Na2SO4,所以滤液Ⅲ中可回收的主要物质是Na2SO4.第四小题的计算要考虑元素守恒,碳酸镁中的镁元素全部转化为Mg(OH)2固体废料中MgCO3质量分数为63%;根据质量守恒定律,设可生产Mg(OH)2的质量为x,则:
MgCO3 ~ Mg(OH)2
8458
63%·mx
8458=63%·mx
解得x=58×63%·m84=0.435m.
答案:
(1)MgCO3+H2SO4MgSO4+H2O+CO2↑
(2) <
(3) Na2SO4
(4) 0.435m
例2 (2020年江西) 2019年诺贝尔化学奖授予对锂离子电池研究作出贡献的三位科学家.图是从钴酸锂废极片[主要成分为钴酸锂(LiCoO2)]中回收得到Co2O3和Li2CO3的一种工艺流程.
(1)操作1中,粉碎废极片的目的是_________;
(2)实验室中完成操作2时,需用到的玻璃仪器是_________(填一种即可);
(3)操作4中,在高温条件下,CoC2O4在空气中反应生成Co2O3和二氧化碳,化学方程式为_________;
(4)操作5中,Li2CO3晶体用热水洗涤比用冷水洗涤损耗更少,说明Li2CO3的溶解度随温度升高而_________.
本题考查的是废弃锂离子电池中锂的回收,是基于真实情境的工艺流程题,近年来在高考的考试中也是考查的重点,借助工艺流程图的模型,第一小题出于原料处理环节的粉粹,目的是可以增大反应物之间的接触面积,使反应更充分,属于标准答题模式;第二小题是除杂分离环节常用到的过过滤操作达到固液分离的目的,需要用到的玻璃仪器是:烧杯、漏斗、玻璃棒;第三小题出现了焙烧专业工艺名称,根据解题策略中焙烧是物料与空气发生化学反应,所以在书写化学反应方程式的时候,反应物必须要有氧气,再根据题意不难得出在高温条件下,该反应的化学方程式为:
4CoC2O4+3O2高温2Co2O3+8CO2
操作5中,Li2CO3晶体用热水洗涤比用冷水洗涤损耗更少,说明Li2CO3晶体在热水中溶解度较大,故Li2CO3的溶解度随温度升高而减小.
答案:
(1)增大反应物之间的接触面积,使反应更充分
(2)烧杯(或漏斗、玻璃棒)
(3) 4CoC2O4+3O2高温2Co2O3+8CO2
(4) 减小
参考文献:
[1] 中华人民共和国教育部.普通高中化学课程标准(2017年版)[M].北京:人民教育出版社,2018.
[2] 黎志辉.高考化学工艺流程题的解题策略之思路研究[J].数理化解题研究,2020(07):94-95.
[责任编辑:季春阳]
