雌激素在大豆体内富集特点研究
2022-03-26张春玉姜福佳于丽静
张春玉,姜福佳,刘 东,李 季,于丽静,耿 敏
(1.长春职业技术学院食品与生物学院,吉林 长春 130033;2.吉林工商学院粮食学院,吉林 长春 130507)
随着工业的快速发展,大量有机化合物和工业“三废”等有毒、有害污染物排放到环境中,特别随着动物避孕药等畜牧业用药在饲料中使用频率的增加,含有过量雌激素的动物粪便和尿液不断排放到土壤和水体.由于雌激素具有生物蓄积时间长、自然条件下难降解的特点,因此雌激素污染问题随之而来,雌激素污染带来的食品安全问题也逐步引起人们的关注[1-3].雌激素属于内分泌干扰物,不易被降解,它能严重干扰人类正常内分泌物质的形成及代谢等过程,危害人类健康[4-6].大量雌激素污染物通过吸附—解吸、迁移、转化等途径在土壤和水体中富集[7-9],再经过动、植物食物链进行人体,已经成为威胁人类健康的重大问题[10].雌二醇(Estradiol,E2)是活性最高、干扰作用最大的环境雌激素[3];而乙炔雌二醇(Ethinylestradiol,EE2)是一种人工合成的雌激素,其在雌激素类污染物中具有十倍的毒性效力[11].研究[12]表明,雌激素进入环境后并不会产生明显的生物效应,未见有植物根部出现中毒、植株枯萎死亡和产量降低等的研究报道;然而雌激素可由被污染的土壤中进入植物体内并进行富集[13-14],人类可能通过食用这些受污染的植物而受到危害,造成严重的食品安全问题.
为了证实雌激素对农作物,特别是对重要的粮食作物和油料作物——大豆是否存在生长抑制或体内富集等潜在危害,本文以E2和EE2为主要研究对象,通过水培大豆实验,研究了雌激素对大豆萌发过程中下胚轴生长的影响,并分析了大豆的根、茎叶、果实对E2和EE2的吸收、富集特点.
1 材料与方法
1.1 化学试剂
E2和EE2购自Sigma-aldrich(西格玛奥德里奇,上海)贸易有限公司;提取溶剂使用分析纯氯仿(北京化工);色谱纯乙腈购于Themo Fisher Scientific(赛默飞巴尔科技)公司;超纯水(Ultrapure water,18.2 MΩcm-1) ,用于高效液相色谱(HPLC)分析.
1.2 实验仪器
电子天平(杭州万特衡器有限公司),离心机(Avanti JXN-26,BECKMAN COULTER和Centrifuge 5430 R,Eppendorf),真空干燥机BZF-30,高效液相色谱(HPLC)仪(Waters e2695),检测器为UV(2988 Waters Detector),色谱柱为C18柱(粒径5 μm,4.6 mm×150 mm),气相色谱-联用质谱仪(Agilent 7890A/5975C).
1.3 大豆处理实验
1.3.1 豆芽的培养与雌激素处理
取适量健康的大豆(和平1号)置于洁净托盘中,加入少量双蒸水,用纱布覆盖保持潮湿,在25℃培养箱中暗培养3 d,期间每天更换3次水.待大豆发出芽体,选取大小一致的豆芽30株,用浮漂将豆芽固定,向豆芽根部加入双蒸水并没过根部,避免将豆芽全部浸泡.随机将30株大豆芽分为5组,即E2浓度分别为0(对照组)及0.002,0.01,0.02,0.05 mmol/L处理组,每组6株豆芽.上述豆芽室温条件下连续处理5 d.
1.3.2 大豆植株的雌激素处理
于6月下旬,从大田中选取整株长势一致、刚刚长出细小豆荚的大豆植株(和平1号),根部用水洗涤并将大豆植株移栽于水培箱中,用Hoagland 营养液缓苗培养3 d.选择生长一致的大豆植株24株,随机分为6组,分别是对照组(不添加E2和EE2);E2组(E2浓度分别为0.002,0.01,0.02,0.05 mmol/L);EE2组(EE2浓度为0.05 mmol/L),每组大豆植株4株.每天更换处理液,定时补充蒸发的水分,处理期间注意避雨.连续处理10 d后收取大豆材料进行实验.
1.4 大豆样品雌激素提取
制备豆芽样品[15]:从处理液中取出萌发5 d的豆芽,用双蒸水进行充分清洗,测量豆芽长度并提取雌激素.雌激素提取方法为:用研磨器将整棵豆芽充分研磨混匀,称取1 g样品放入10 mL 离心管中,加入1 mL ddH2O混匀;再加入1 mL氯仿,摇床振摇20 min,4 000 r/min离心10 min;吸取下相(氯仿相)500 μL,13 000 r/min离心10 min;再取下相300 μL进行真空干燥,4℃冰箱保存、待测.
制备大豆植株样品:将整棵大豆植株用双蒸水充分清洗,去除表面杂质后,用滤纸干燥.分别剪取豆荚、茎叶和根部,进行雌激素提取,方法同上.
1.5 雌激素HPLC检测
利用HPLC(Waters e2695) 检测雌激素.检测器为UV(2988 Waters Detector).色谱柱为C18柱(粒径5 μm,4.6 mm×150 mm,Waters).液相色谱分离条件为:以V(乙腈)∶V(水)= 50 ∶ 50作为流动相,流速为1.0 mL/min,λ=225 nm,进样量为5 μL,柱温为27℃.每个实验、对照均重复4次.
2 结果与分析
2.1 E2和EE2的HPLC检测
利用高效液相色谱仪对0.1 mmol/L E2和 EE2的标准品进行分析和检测,HPLC检测结果见图1.由图1可见,E2和EE2分别在4.1 min和5.1 min出现了两个色谱峰,峰型尖锐对称、无拖尾现象,说明建立了E2和 EE2的良好检测条件.

图1 0.1 mmol/L E2和EE2标准品HPLC谱图
2.2 E2对豆芽下胚轴生长的影响
不同浓度E2处理下,培养5 d后豆芽的生长变化情况如图2a所示.对照组经过5 d的培养,豆芽下胚轴的长度由最初的平均3.5 cm伸长到17.8 cm,并生长出10余根根毛,根毛较长;E2处理下,大豆下胚轴的伸长生长受到了不同程度的抑制,同时根毛的数量也发生了显著的变化.
0.002 mmol/L E2处理下,豆芽下胚轴的伸长生长受到了轻微的抑制,与对照相比,下胚轴长度降低了9.0%;根毛的数量也有所减少且根毛的长度缩短.0.01 mmol/L和0.02 mmol/L E2的处理下,豆芽下胚轴的伸长生长进一步受到抑制,平均长度为14.1 mm和12.6 mm,与对照相比,下胚轴长度降低了20.8%和29.2%;根部的根毛仅长出1~4根,长度极短.随着E2浓度的进一步增加,0.05 mmol/L E2处理下,豆芽下胚轴的伸长受到严重抑制,长度仅为9.8mm,生长速度下降了 44.9%;根部未见根毛生成.E2处理浓度的升高不仅加剧了对豆芽下胚轴伸长生长的抑制,而且对根毛的产生和伸长长度也出现了显著的抑制(见图2b).
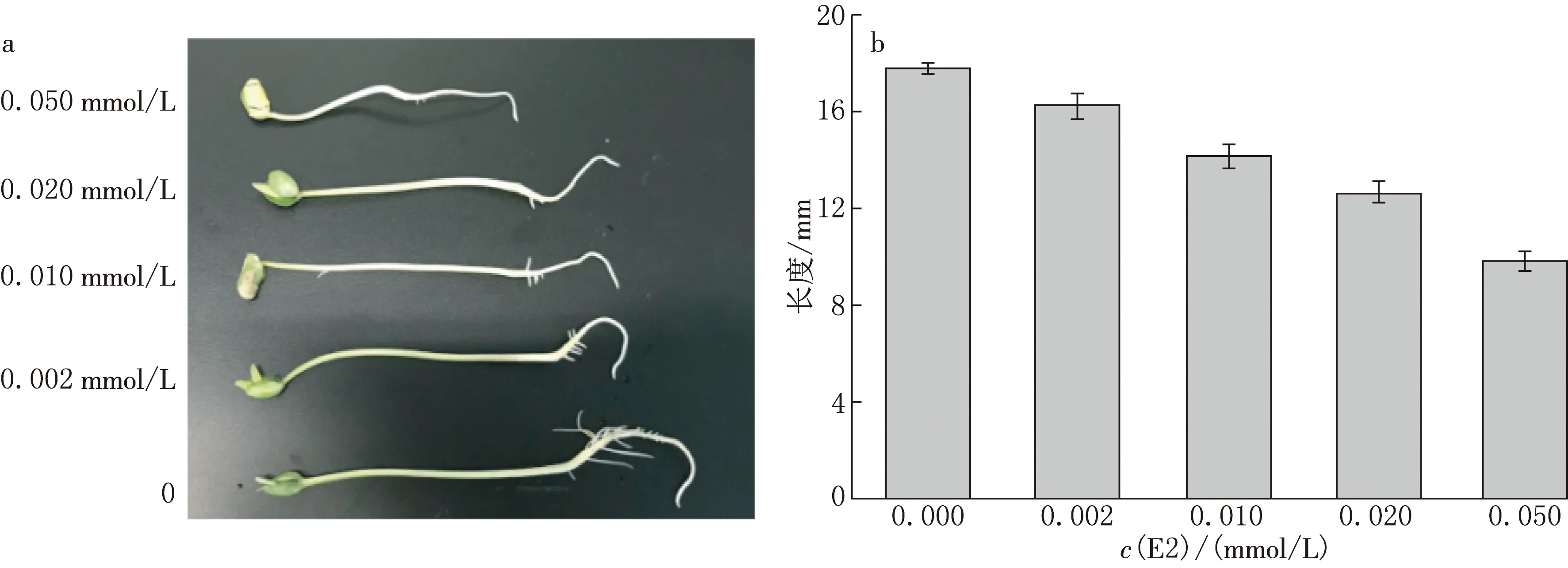
a不同浓度E2处理下豆芽下胚轴的变化;b不同浓度E2处理对豆芽下胚轴伸长生长的影响
2.3 大豆芽中E2含量分析
利用HPLC检测大豆芽在不同浓度E2处理下E2含量变化的情况,结果见图3.由图3可见,低浓度E2(0.002 mmol/L)处理下,大豆幼苗中在4.1 min处没有吸收峰出现;当E2浓度≥0.01 mmol/L时,随着E2浓度的升高,大豆芽对E2的富集随之增加,说明高浓度的E2会造成豆芽体内E2的富集,这可能也是造成大豆芽下胚轴伸长生长受阻的主要原因.

图3 不同浓度E2处理下大豆幼苗中E2含量的HPLC
2.4 大豆根系中E2含量分析
不同E2处理下大豆根部E2含量的HPLC检测结果见图4.由图4可见,不同浓度E2处理的大豆根部在4.1 min均出现肩峰,肩峰数值较低.根据植物根系对有机物吸收的特点,推测这种现象可能是由于根部对E2仅仅是吸附作用而不是富集作用.

图4 不同浓度E2处理下大豆根系中E2含量的HPLC
2.5 大豆果实中E2含量分析
对不同浓度E2处理液中生长的大豆果实进行HPLC检测,结果见图5.由图5可见,在不同浓度E2的培养环境中,所有参与检测的大豆果实中均可检测到E2,而且果实中E2的含量随着处理液中E2浓度的升高而增加.这一结果说明E2能够在大豆果实中进行富集,并随着环境中E2浓度的升高,富集程度呈现剂量依赖关系.这一现象的出现可能是由于大豆果实中油脂含量较高,而雌激素为脂溶性物质,因此能够在大豆果实中富集.
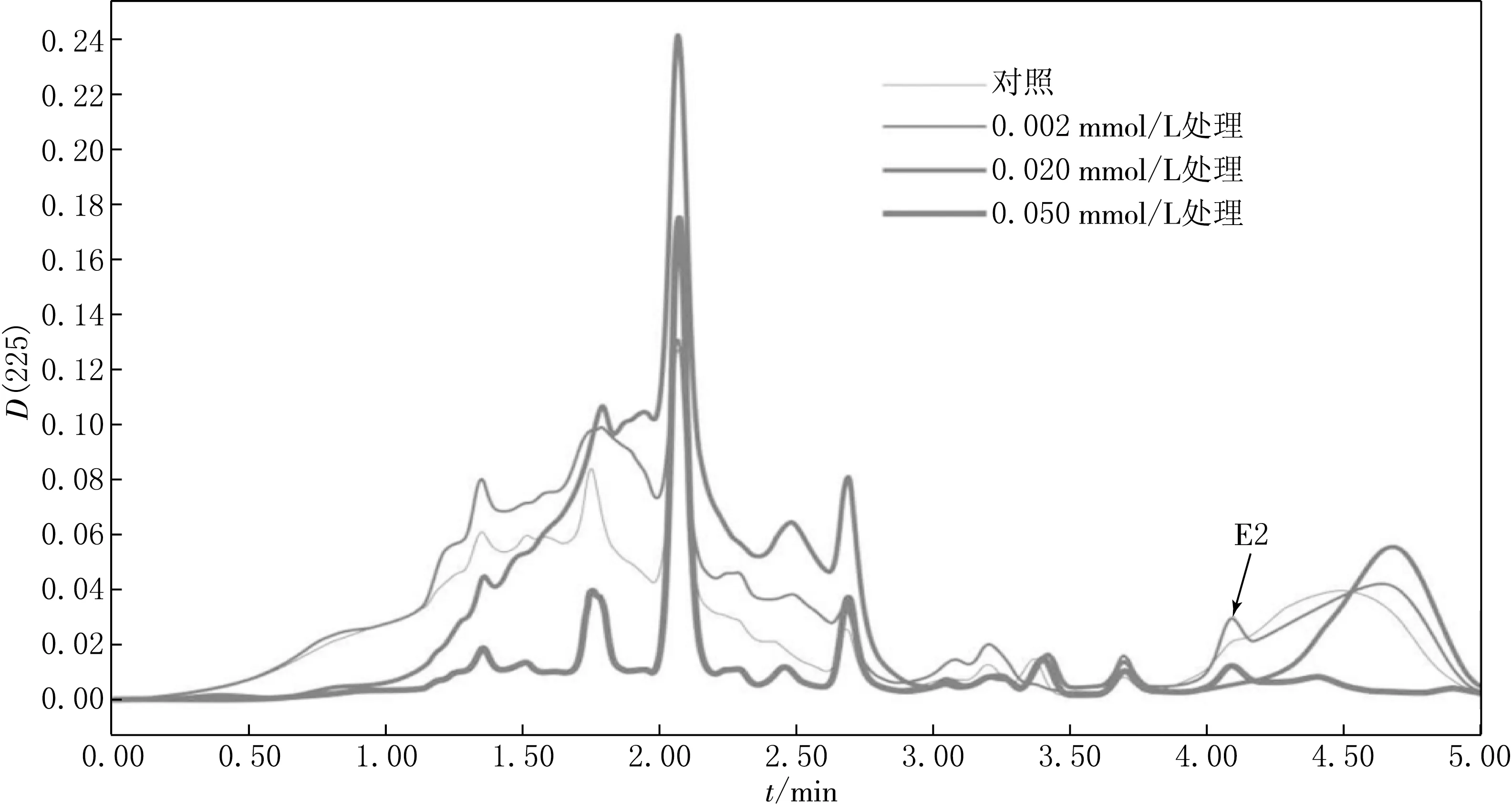
图5 不同浓度E2处理下大豆果实中E2含量的HPLC
2.6 大豆茎叶中E2含量分析
大豆茎叶中E2含量的HPLC检测结果见图6.由图6可见,茎叶样品在4.1 min处未发现E2的吸收峰,说明E2不能在大豆的茎叶中富集.

图6 不同浓度E2处理下大豆茎叶中E2含量的HPLC
2.7 大豆根部EE2含量分析
大豆根部EE2富集情况的HPLC检测结果见图7.由图7可见,浓度为0.05 mmol/L的EE2处理10 d后,与对照组相比,大豆根部在5.1 min处出现一个小吸收峰,表明EE2在大豆根部有一定程度的积累.
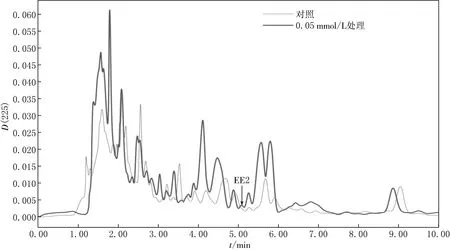
图7 不同浓度EE2处理下大豆根系中EE2含量的HPLC
2.8 大豆果实中EE2含量分析
大豆果实中EE2富集情况的HPLC检测结果见图8.由图8可见,经过0.05 mmol/L浓度的EE2培养后,相对于对照组大豆果实在5.1 min处出现一个吸收峰,说明在该浓度条件下,EE2可在大豆果实中富集.
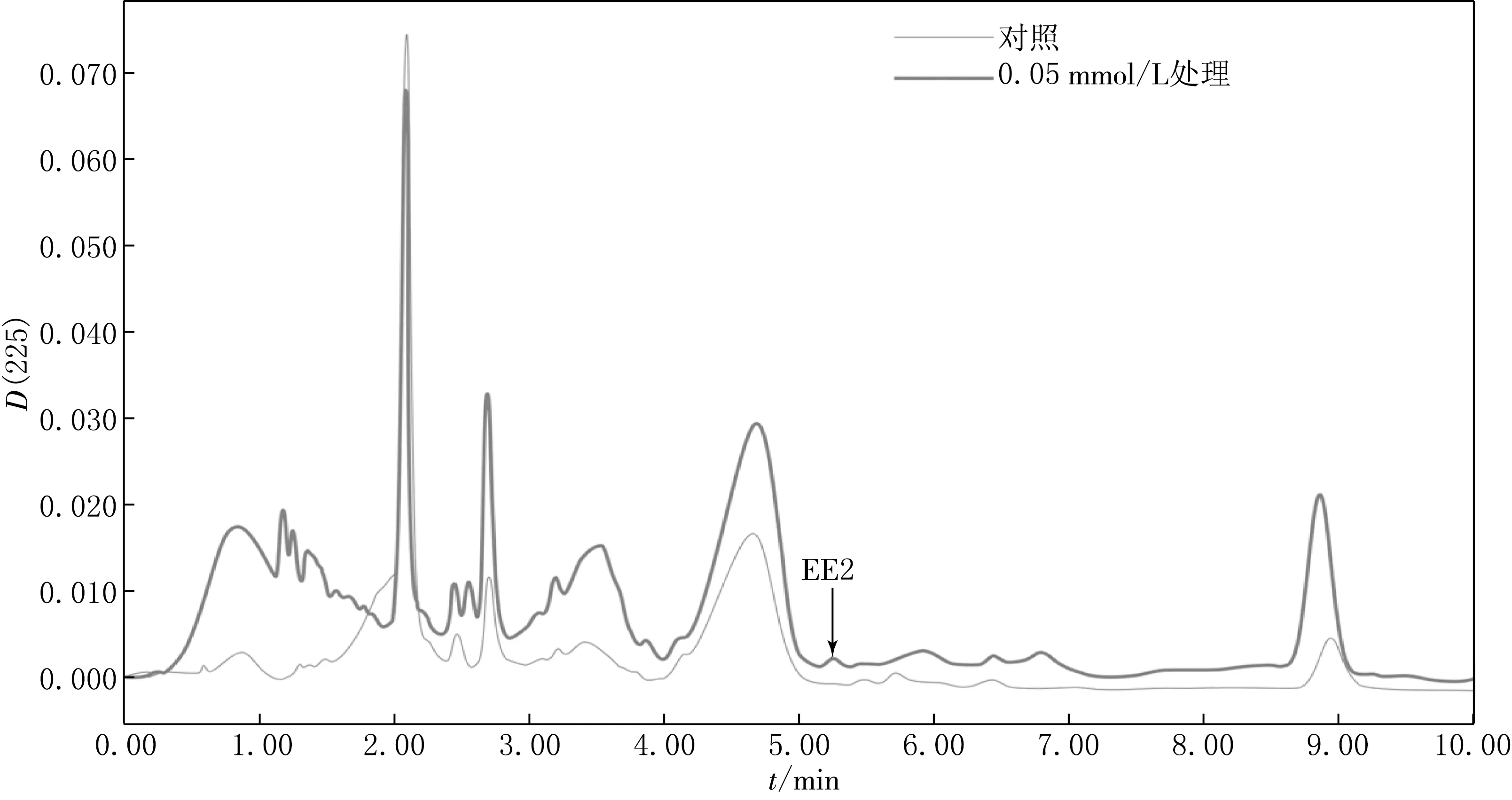
图8 不同浓度EE2处理下大豆果实中EE2含量的HPLC
2.9 EE2在大豆茎叶中的富集情况
大豆茎叶中EE2富集情况的HPLC检测结果见图9.由图9可见,经过浓度为0.05 mmol/L的EE2培养,与对照组相比,处理组的大豆茎叶在5.1 min处并没有吸收峰出现,表明EE2在大豆茎叶中不能富集.
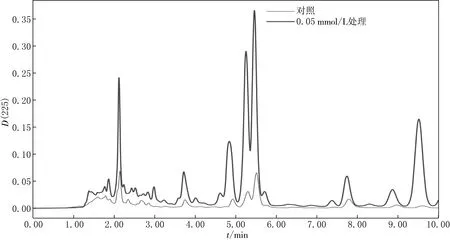
图9 不同浓度EE2处理下大豆茎叶中EE2含量的HPLC
3 讨论
3.1 E2对大豆萌发具有抑制作用
本文的研究结果表明,大豆在萌发过程中随着E2处理浓度由0.002 mmol/L逐步升高到0.05 mmol/L,对大豆生长的抑制作用呈现逐渐增强的趋势.无论是低浓度的E2还是高浓度的E2均对大豆下胚轴的伸长生长起到了抑制作用,且随着E2处理浓度的升高,下胚轴生长受到的抑制作用越强;同时根毛的数量和长度也随E2处理浓度的升高而减少,0.05 mmol/L E2处理时,没有根毛生长.HPLC分析结果表明,大豆芽对E2的富集随着处理液浓度的升高而增加,E2在大豆芽的富集是抑制大豆萌发过程中下胚轴延伸和根毛生成的主要原因.
3.2 雌激素在大豆体内的富集特点
本文的研究结果表明,E2和EE2在大豆植株各部分的富集作用存在差异.大豆根系仅在高浓度(0.05 mmol/L)雌激素作用下才能检测出来,且含量较低,说明根系对雌激素具有吸附和吸收的特点,并不在根系中富集.对于大豆果实而言,无论是E2还是EE2在果实中的含量均随外界雌激素的增加而增加,说明果实是雌激素积累的主要部位.在各浓度E2和EE2对大豆茎叶的处理下,通过HPLC法在茎叶中均未检测出雌激素的存在,表明E2和EE2不能在大豆的茎叶中富集,茎叶只是起到了运输的作用.由于大豆的可食用部分主要是果实,因此果实中E2和EE2的富集现象表明,环境中的雌激素会产生食品安全风险,从而对人类健康造成危害.
4 结论
通过本文研究可以证实:E2对大豆下胚轴的延伸和根系形成具有抑制作用,且抑制作用随E2处理浓度的升高而增强.E2和EE2在大豆根、茎叶和果实的富集特点不同,主要富集在大豆果实中,这说明环境中的雌激素可以通过大豆进入食物链,从而对人体健康造成潜在的威胁,环境中雌激素的危害应该受到广泛的关注.
