以凝固型发酵乳为样本探究pH对大肠菌群的影响
2022-03-24李玉平孙丛丛
◎ 李玉平,李 鹏,孙丛丛,凌 森
(河北三元食品有限公司,河北 石家庄 050700)
溶液的pH值等于溶液中氢离子浓度的负对数,代表了溶液的酸碱度。pH值是影响微生物生长的一个关键因素,微生物会因细胞内蛋白质的变性和核酸的变异出现生物活性下降的现象;当pH有所改变时,营养物质会因受到影响而发生改变,导致营养物质的有效利用率降低,微生物的生长速度随之下降[1]。不同微生物适宜生存的pH环境不同,在温度、水分等条件适宜的情况下,菌体内酶的活性在最适pH或最适pH区间时最高,生长速度也最快,环境的pH发生变化会在一定程度上影响微生物的生长速度,在一定pH区间外微生物会受到损伤而死亡[1]。
大肠菌群(Coliforms)一般指一群在特定培养条件下能够发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽孢杆菌[2]。该菌群与人们的生活息息相关,常出现在粪便和被粪便污染的地带。大肠菌群计数是评价食品卫生状况的重要指标之一,在食品卫生方面中得到广泛使用[3]。大肠菌群含量的高低不仅可以反映食品被粪便污染的程度,还可以直接影响食品的储存期、口感和人体健康。大肠菌群是条件性致病菌,其较强的产毒能力决定了其具有较低的感染剂量,感染大肠菌群后的中毒反应有发热、呕吐、腹泻和腹痛等。一直以来人们都在不断关注着影响大肠菌群检测结果准确性的因素及注意事项,持续探究着大肠菌群的生存特点。为了得到更加准确的大肠菌群计数结果,首先要熟练掌握国家检验标准,从方法的适用性、培养基及试剂的灭菌要求、使用温度和使用量、操作步骤(样品稀释、接种时间、培养温度和时间)、平板计数和证实试验到结果报告等每个环节都要严格按照标准要求进行。在研究大肠杆菌的生存特点时发现,在不同的极端环境下,大肠杆菌会产生不同的应激机制,有针对性地对抗高压、低温、高热和高酸等压力带来的威胁。近几年有不少学者对大肠杆菌的耐酸性进行了研究,不同的酸性条件下大肠杆菌的生长情况也不尽相同。
李小媚等[4]研究表明,pH值为5.0~7.0时,大肠杆菌(0157:H7)可以良好地生长;pH值为2.0~4.0时,大肠杆菌(0157:H7)的生长受到了抑制;当pH值<2.0时,大肠杆菌(0157:H7)几乎被全部杀死。另外,当环境中的pH值不同时,大肠杆菌(0157:H7)所呈现出来的形态也有所不同,当环境的pH值降低时细胞由长杆状变成短杆状或椭圆状,由此可见大肠杆菌(0157:H7)对酸的耐受性较强,可以很好地对抗酸性环境对其生长的影响。这一特性使得酸性果汁、乳制品等酸性或发酵食品极易被大肠杆菌污染,同时也反映出了在对食品进行大肠菌群计数检验过程中,pH是影响检测结果的重要因素之一[5]。为探究不同pH值对大肠菌群生长的影响,本试验以凝固型发酵乳为样本,采用平板计数的方法,分别对存放前后的已接种等量大肠埃希氏菌的不同pH值的样本稀释液进行大肠菌群计数。通过比较存放前后大肠菌群含量的变化来判定pH对大肠菌群生长的影响[6]。
1 材料与方法
1.1 仪器与设备
灭菌吸管、直径为90 mm的无菌平皿、无菌锥形瓶、试管和水浴锅,上海新苗医疗器械制造有限公司;(36±1)℃电热恒温培养箱,DNP-9272BS-Ⅲ,上海新苗医疗器械制造有限公司;pH计,DELTA320,梅特勒托利多有限公司;电子天平,T1000,常熟市双杰测试仪器厂;高压灭菌器,YXQ-100A,上海博讯实业有限公司。
1.2 试剂
0.85%无菌生理盐水、1 mol·L-1NaOH 溶液、1 mol·L-1HCl溶液,均为自制。
1.3 培养基
本次试验使用的培养基均按照《食品安全国家标准食品微生物学检验培养基和试剂的质量要求》(GB 4789.28—2013)的要求进行质量验收,且验收合格的商品化脱水合成培养基。
结晶紫中性红胆盐琼脂(VRBA):严格按照培养基标签上的方法进行配制,临用前制备。
煌绿乳糖胆盐(BGLB)肉汤:严格按照培养基标签上的方法进行配制,分装至放有倒置玻璃小导管的试管中,每管10 mL,121℃条件下高压灭菌15 min。
1.4 试验方法
1.4.1 菌悬液
本次试验使用的是从美国典型菌株保藏中心购入的大肠埃希氏菌,菌悬液由储备菌株在BHI(非选择性肉汤)中培养过夜后制得[7]。
1.4.2 样品稀释
无菌条件下,准确称量50 g样本于装有50 mL无菌生理盐水的容器中,充分混匀,共制备6份,对稀释液分别编号为S0、S1、S2、S3、S4和S5,用1 mol·L-1NaOH 溶液和 1 mol·L-1HCl溶液调节各稀释液的pH值,测得各稀释液的pH值依次为4.4(未调pH)、2.0、3.0、4.4(未调pH)、5.3和6.8。
1.4.3 大肠菌群计数
(1)对S0(未接种)进行大肠菌群计数测试。用无菌吸管吸取S0稀释液于2个无菌培养皿中,每皿2 mL,此接种量相当于1 mL样本原液,记为100;同样量取2 mL S0稀释液至装有8 mL无菌生理盐水的试管中,振荡均匀,用无菌吸管量取上述匀液至2个无菌平皿,每皿1 mL,此接种量相当于0.1 mL样本原液,记为10-1。另取1 mL无菌生理盐水至无菌培养皿中,作为空白对照。
(2)对S1~S5(接种)进行大肠菌群计数测试。向稀释液S1、S2、S3、S4和S5中分别加入ATCC 25922大肠埃希氏菌的工作菌悬液1 mL,振荡均匀,用无菌吸管吸取各个已接种的稀释液,分别接种至2个无菌平皿,每皿2 mL,记为100;量取2 mL各稀释液于盛有8 mL无菌生理盐水的试管中,充分混匀,记为10-1;用无菌吸管量取10-1匀液1 mL于盛有9 mL生理盐水的试管中(吸管尖端不要触及稀释液面),充分混匀,制成10-2的样品匀液。按前面的操作,制成10倍递增系列稀释液。每个稀释度,换用1支无菌吸管。取多个连续稀释度,每个稀释度接种2个无菌平皿,每皿1 mL。
(3)向所有平皿中倒入46 ℃左右的结晶紫中性红胆盐琼脂,每皿需倒15~20 mL。顺时针摇晃平皿,使培养基和接种的样液混合充分,放置一段时间,至琼脂完全凝固后,倒入3~4 mL VRBA覆盖整个平板。完全凝固后,将平皿倒置,在(36±1)℃条件下培养18~24 h。
(4)接种完成后,将稀释液S1~S5放置6.5 ℃环境中存放1 d,重复上述操作。
(5)培养结束后,严格按照《食品安全国家标准食品微生物学检验大肠菌群计数》(GB 4789.3—2016)9.3的规定,计数典型和可疑菌落数。典型菌落是紫红色,有红色的胆盐沉淀环在其周围。严格按照《食品安全国家标准食品微生物学检验大肠菌群计数》(GB 4789.3—2016)9.4证实试验的规定,从VRBA平板上取10个典型单个菌落,转种于BGLB肉汤试管内,于(36±1)℃条件下培养24~48 h,结果BGLB肉汤管均有气体产生。
2 结果与分析
试样S0(未接种)的计数结果为<1 CFU·g-1,说明样本没有被大肠菌群污染;分别对S1~S55个试样的各稀释度平板进行大肠菌群计数,结果见图1。
从图1可以看出,试样的pH值为4.4~6.8时,存放前后大肠菌群数量没有明显变化,数量级不变,由此可见,大肠菌群有较强的耐酸性;试样的pH值=3时,存放前后大肠菌群含量由7.8×106CFU·g-1减少至1.3×104CFU·g-1,pH值的降低明显影响了大肠菌群的生物活性;试样的pH值<3时,存放后大肠菌群几乎全部死亡,含量由7.5×106CFU·g-1减少至0,大肠菌群在酸性较高的环境下受到严重损伤而死亡。综上,本次试验结果表明,当大肠菌群含量较大时,不同的pH值对大肠菌群有不同程度的影响,pH值在4.4~6.8时对大肠菌群没有明显抑制性;pH值≤3时对大肠菌群有显著抑制性。
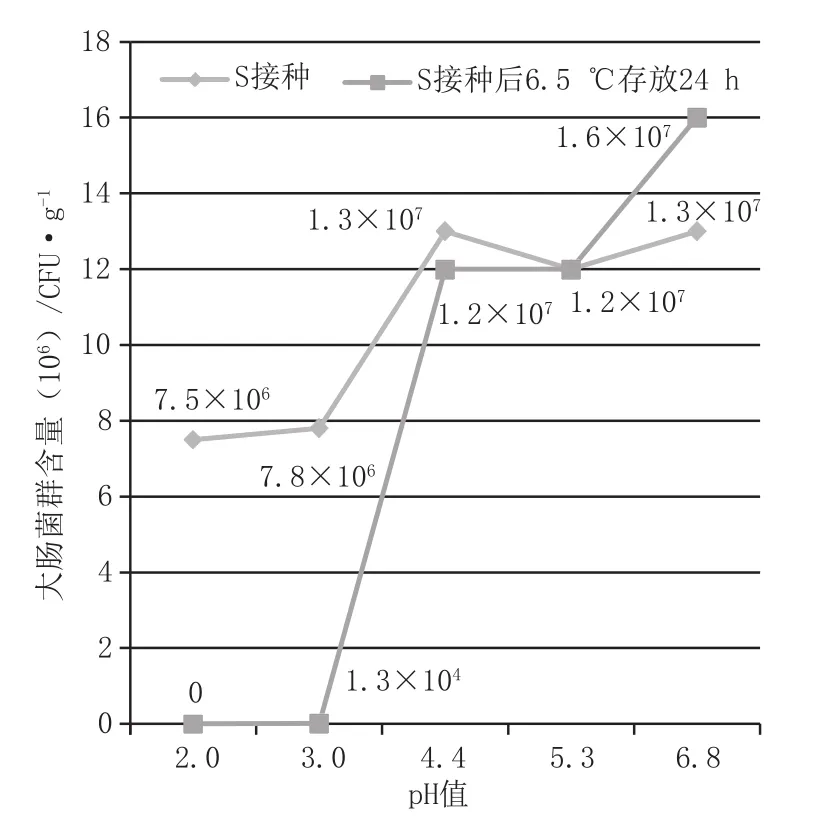
图1 试样S1~S5存放前后大肠菌群含量变化趋势图
3 结论
大肠菌群对酸有较强的耐受性,在pH值≤3的条件下受到显著抑制。大肠菌群计数是评价食品卫生污染状况的重要指标,为了准确得到食品中大肠菌群的含量,检测过程应注意培养基以及样品匀液的pH值,调节pH值至国家标准要求的范围。另外,产品在存放过程中pH值的变化也会对大肠菌群的含量有影响,因此要注意检测的及时性。
