青蒿琥酯对急性髓系白血病细胞株MV4-11增殖凋亡的调控作用
2022-03-24赵小强吴雅莉张曼程英英杨海平
赵小强,吴雅莉,张曼,程英英,杨海平
[河南科技大学第一附属医院(河南科技大学临床医学院)血液内科,河南洛阳 471000]
急性髓系白血病(acute myeloid leukemia,AML)是一种血液系统恶性肿瘤,占急性白血病的20%~25%,是由骨髓造血前体细胞的分化受阻和恶性克隆引起的过度增殖从而导致的骨髓衰竭,具有恶性增殖、克隆进化、遗传异质性等特征[1-2]。目前,AML的临床治疗主要是化疗及自体和异基因造血干细胞移植,但多数患者治疗缓解后出现复发、耐药,仅有40%~45%的年轻患者和不足10%的老年患者生存期超过5年[3]。因此,亟需开发新型、低毒和高效的药物治疗AML。青蒿素是从中药青蒿(菊科植物黄花蒿Artemisid annuaL.的全草)中提取的一种含过氧基团的倍半萜内酯,青蒿琥酯(artesunate)是其衍生物。青蒿琥酯具有抗疟、抗感染、抗血管生成、抗脓毒症、免疫调节及抗肿瘤等功效[4]。近年研究显示,青蒿琥酯对乳腺癌、卵巢癌、子宫内膜癌、肝癌及淋巴瘤具有抑制作用[5-9]。既往体外、体内实验研究均显示,青蒿琥酯对白血病细胞系及小鼠移植瘤具有明显抑制作用[10]。本研究以AML细胞株MV4-11为实验对象,探讨青蒿琥酯的治疗作用及机制,以期为青蒿琥酯相关药物的研发及AML的临床治疗提供参考,现将研究结果报道如下。
1 材料与方法
1.1 细胞株人AML细胞株MV4-11,购自中国科学院(上海)细胞库。细胞以含10%胎牛血清、1%青霉素-链霉素的IMDM培养液在37℃、5%CO2恒温培养箱中培养。1周2次半换液传代培养。
1.2 药物、试剂与仪器注射用青蒿琥酯(广西桂林南药股份有限公司生产,国药准字H20133237);复合物C(美国Sigma公司);四甲基偶氮唑盐(MTT)(美国Sigma公司);膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒(上海翌圣生物科技有限公司);引物(由上海生工生物工程股份有限公司合成);兔抗人腺苷酸活化蛋白激酶(AMPK)抗体、磷酸化腺苷酸活化蛋白激酶(p-AMPK)抗体、哺乳动物雷帕霉素靶蛋白(mTOR)和磷酸化的哺乳动物雷帕霉素靶蛋白(pmTOR)抗体(美国Upstate公司);兔抗人B淋巴细胞瘤-2基因(Bcl-2)抗体、Bcl-2相关X蛋白(Bax)抗体和β-actin抗体(美国Santa Cruz公司);山羊抗兔辣根过氧化物酶(HRP)标记的免疫球蛋白(IgG)(英国Abcam公司)。酶标仪(美国BioTek公司);流式细胞仪(美国BD公司);荧光定量PCR仪、蛋白凝胶电泳仪(美国Bio-Rad公司)。
1.3 观察指标与方法
1.3.1 MTT法检测细胞增殖能力取对数生长期MV4-11细胞,以1×105个/mL的细胞密度接种于96孔板,每孔180μL。加入不同浓度青蒿琥酯(0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0μg/mL)20μL,对照组加入等体积培养液,每组设置3个复孔。培养24、48、72 h后,每孔加入MTT(5 mg/mL)20μL,孵育4 h。终止培养,每孔加入DMSO 150μL,微振荡10 min。应用酶标仪检测各孔490 nm波长的吸光度(OD)值。实验重复3次。计算细胞增殖抑制率,细胞增殖抑制率(%)=(对照组OD值-实验组OD值)/对照组OD值×100%。采用Graphpad Prism 7.0软件计算半数抑制浓度(IC50)。选择作用48 h的IC50作为后续实验的干预浓度。设置对照组、青蒿琥酯组、复合物C组和青蒿琥酯+复合物C组,青蒿琥酯组、复合物C组分别加入1.58μg/mL青蒿琥酯、50μmol/L复合物C,青蒿琥酯+复合物C组先后加入1.58μg/mL青蒿琥酯和50μmol/L复合物C,对照组加入等体积细胞培养液,均作用48 h,按照上述MTT法检测细胞存活率,细胞存活率(%)=实验组OD值/对照组OD值×100%。
1.3.2 流式细胞仪检测细胞周期与凋亡收集对照组、青蒿琥酯组、复合物C组和青蒿琥酯+复合物C组细胞。以1 000 r/min(离心半径10 cm)离心5 min,弃上清,收集细胞沉淀;用预冷1×PBS(4℃)洗涤2次,加入预冷体积分数75%乙醇,4℃固定18 h,离心弃上清;PBS洗涤3次,加入RNA酶(Rnase)PI染色液37℃避光染色30 min。上流式细胞仪检测,Modfit软件分析细胞周期。实验重复3次。
收集各组细胞,以2 000 r/min(离心半径15 cm)离心5 min,用预冷1×PBS(4℃)重悬细胞,以2 000 r/min离心5 min,洗涤细胞2次;加入300μL的1×Binding Buffer悬浮细胞,加入5μL的Annexin V-FITC避光室温孵育15 min;上机前5 min加入5μL的PI避光染色标记,上流式细胞仪检测,CellQuest软件分析细胞凋亡。实验重复3次。
1.3.3 定量聚合酶链反应(qPCR)法检测细胞Bcl-2、Bax mRNA水平收集各组细胞,PBS清洗细胞2次,TRIzol试剂提取总RNA,超微量分光光度计测定其浓度及OD(260 nm)/OD(280 nm)。反转录反应体系:5×Mix 4μL,RNA 1μg,加DEPCH2O至20μL。反转录反应程序:25℃,10 min;42℃,30 min;85℃,5 min。反转录产物稀释到1 mL。按照PCR试剂盒配制反应体系后进行反应,反应程序:95℃预变性60 s;95℃,15 s;60℃,15 s;72℃,45 s,共循环40次。待测基因qPCR引物使用Primer 3.0设计,序列见表1。采用2-△△CT法计算目的基因mRNA相对表达水平。

表1 qPCR引物序列Table 1 Primer sequence for qPCR assay
1.3.4 蛋白免疫印迹(Western Blot)法检测细胞AMPK通路相关蛋白的表达收集各组细胞,PBS清洗2次,提取总蛋白,用二喹啉甲酸(BCA)蛋白定量试剂盒定量,蛋白变性;10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,用湿式转膜仪将其转移到聚偏氟乙烯(PVDF)膜上;加入50 g/L脱脂牛奶室温封闭1 h后,分别加入一抗 稀 释 液AMPK(1∶500)、p-AMPK(1∶200)、
mTOR(1∶500)、p-mTOR(1∶200)、Bcl-2(1∶200)、Bax(1∶200)、β-actin(1∶1 000)4℃孵育过夜,TBST洗膜10 min×3次;再用HRP标记的二抗(1∶2 000稀释)室温孵育1 h,TBST洗膜10 min×3次;用电化学发光(ECL)法于暗室中显影,应用ImageJ软件分析蛋白条带。以目的蛋白条带灰度值/内参β-actin蛋白条带灰度值的比值,作为目的蛋白相对表达水平。
1.4 统计方法采用SPSS 24.0统计软件进行数据分析,所有实验数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 青蒿琥酯对MV4-11细胞生长的抑制作用图1结果显示:1.0、2.0、3.0、4.0μg/mL青蒿琥酯处理24、48、72 h后,MV4-11细胞生长受到抑制,随着青蒿琥酯浓度升高、作用时间延长,细胞增殖抑制率逐渐升高。青蒿琥酯作用48、72 h对MV4-11细胞的IC50分别为1.58、1.39μg/mL。后续实验选取1.58μg/mL青蒿琥酯进行干预。
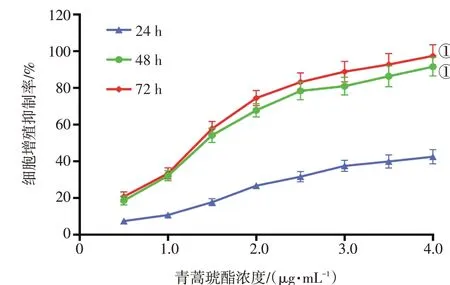
图1 青蒿琥酯对MV4-11细胞生长的抑制作用Figure 1 Inhibition of artesunate on growth of MV4-11 cells
2.2 各组MV4-11细胞存活率比较表2显示:细胞存活率组间比较,差异有统计学意义(P<0.05)。与对照组比较,青蒿琥酯组细胞存活率降低,复合物C组细胞存活率升高(P<0.05);与青蒿琥酯组比较,复合物C组、青蒿琥酯+复合物C组细胞存活率升高(P<0.05);与复合物C组比较,青蒿琥酯+复合物C组细胞存活率降低(P<0.05)。
表2 各组MV4-11细胞存活率比较Table 2 Comparison of MV4-11 cell survival rate among various groups (±s;n=3)

表2 各组MV4-11细胞存活率比较Table 2 Comparison of MV4-11 cell survival rate among various groups (±s;n=3)
①P<0.05,与对照组比较;②P<0.05,与青蒿琥酯组比较;③P<0.05,与复合物C组比较
细胞存活率/%100 51.67±2.84①131.24±2.36①②98.26±1.76②③578.322<0.001组别对照组青蒿琥酯组复合物C组青蒿琥酯+复合物C组F值P值
2.3 各组MV4-11细胞周期比较表3结果显示:G0/G1期、S期与G2/M期细胞组间比较,差异有统计学意义(P<0.05)。与对照组比较,青蒿琥酯组G0/G1期、G2/M期细胞增加,S期细胞减少(P<0.05),复合物C组G0/G1期、G2/M期细胞减少,S期细胞增加(P<0.05);与青蒿琥酯组比较,复合物C组、青蒿琥酯+复合物C组G0/G1、G2/M期细胞期细胞减少,S期细胞增加(P<0.05);与复合物C组比较,青蒿琥酯+复合物C组G0/G1期、G2/M期细胞增加,S期细胞减少(P<0.05)。
表3 各组MV4-11细胞周期比较Table 3 Comparison of MV4-11 cell cycle in various groups (±s,%;n=3)

表3 各组MV4-11细胞周期比较Table 3 Comparison of MV4-11 cell cycle in various groups (±s,%;n=3)
①P<0.05,与对照组比较;②P<0.05,与青蒿琥酯组比较;③P<0.05,与复合物C组比较
G2/M期33.21±1.36 37.68±1.79①21.95±1.47①②32.14±2.32②③245.989<0.001组别对照组青蒿琥酯组复合物C组青蒿琥酯+复合物C组F值P值G0/G1期28.96±1.24 53.47±3.76①18.58±1.52①②31.24±1.85②③98.535<0.001 S期37.83±1.98 8.85±0.76①59.47±2.37①②36.62±2.07②③358.705<0.001
2.4 各组MV4-11细胞凋亡率比较表4、图2显示:细胞凋亡率组间比较,差异有统计学意义(P<0.05)。与对照组比较,青蒿琥酯组细胞凋亡率升高,复合物C组细胞凋亡率降低(P<0.05);与青蒿琥酯组比较,复合物C组、青蒿琥酯+复合物C组细胞凋亡率降低(P<0.05);与复合物C组比较,青蒿琥酯+复合物C组细胞凋亡率升高(P<0.05)。
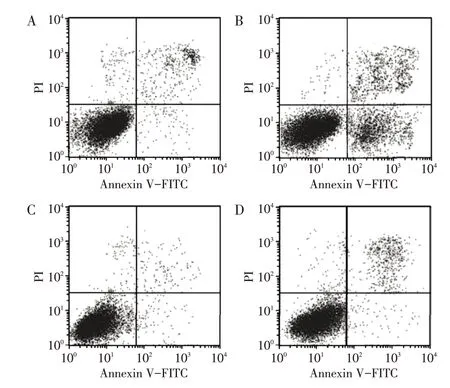
图2 各组MV4-11细胞凋亡流式散点图Figure 2 Flow cytometry scatter diagram of apoptosis of MV4-11 cells in various groups
表4 各组MV4-11细胞凋亡率比较Table 4 Comparison of apoptosis rate of MV4-11 cells in various groups (±s;n=3)

表4 各组MV4-11细胞凋亡率比较Table 4 Comparison of apoptosis rate of MV4-11 cells in various groups (±s;n=3)
①P<0.05,与对照组比较;②P<0.05,与青蒿琥酯组比较;③P<0.05,与复合物C组比较
细胞凋亡率/%6.24±1.43 47.89±1.52①1.31±0.86①②7.43±1.25②③841.861<0.001组别对照组青蒿琥酯组复合物C组青蒿琥酯+复合物C组F值P值
2.5 各组MV4-11细胞中Bcl-2、Bax mRNA水平比较表5结果显示:各组细胞Bcl-2、Bax mRNA相对表达量组间比较,差异有统计学意义(P<0.05)。与对照组比较,青蒿琥酯组Bax mRNA相对表达量升高,Bcl-2 mRNA相对表达量降低(均P<0.05),复合物C组Bax mRNA相对表达量降低,Bcl-2 mRNA相对表达量升高(均P<0.05);与青蒿琥酯组比较,复合物C组、青蒿琥酯+复合物C组Bax mRNA相对表达量降低,Bcl-2 mRNA相对表达量升高(均P<0.05);与复合物C组比较,青蒿琥酯+复合物C组Bax mRNA相对表达量升高,Bcl-2 mRNA相对表达量降低(均P<0.05)。
表5 各组MV4-11细胞Bcl-2、Bax mRNA水平比较Table 5 Comparison of Bcl-2 and Bax mRNA levels in MV4-11 cells in various groups (±s;n=3)
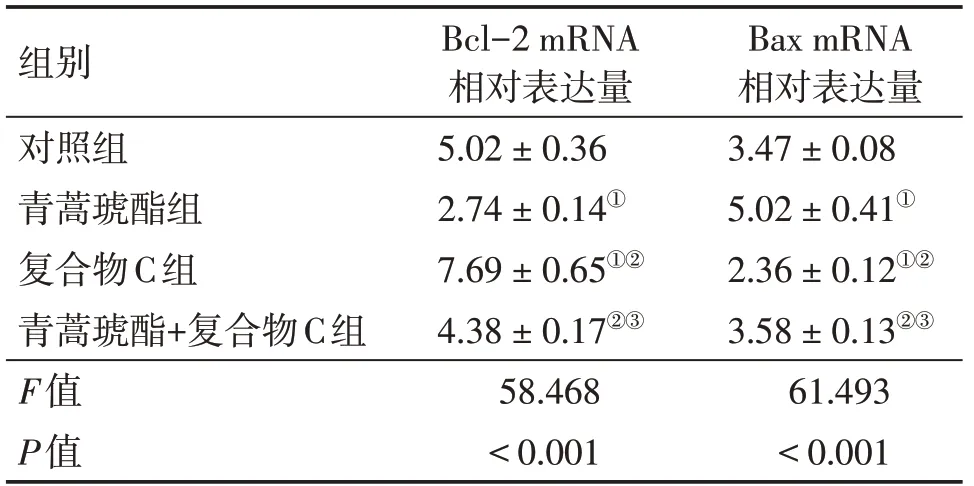
表5 各组MV4-11细胞Bcl-2、Bax mRNA水平比较Table 5 Comparison of Bcl-2 and Bax mRNA levels in MV4-11 cells in various groups (±s;n=3)
①P<0.05,与对照组比较;②P<0.05,与青蒿琥酯组比较;③P<0.05,与复合物C组比较
Bax mRNA相对表达量3.47±0.08 5.02±0.41①2.36±0.12①②3.58±0.13②③61.493<0.001组别对照组青蒿琥酯组复合物C组青蒿琥酯+复合物C组F值P值Bcl-2 mRNA相对表达量5.02±0.36 2.74±0.14①7.69±0.65①②4.38±0.17②③58.468<0.001
2.6 各组MV4-11细胞AMPK信号通路相关蛋白表达水平比较表6、图3结果显示:各组细胞p-AMPK、p-mTOR、Bcl-2、Bax蛋白表达水平组间比较,差异有统计学意义(均P<0.05)。与对照组比较,青蒿琥酯组p-AMPK、Bax蛋白表达上调,p-mTOR、Bcl-2蛋白表达下调(均P<0.05),复合物C组p-AMPK、Bax蛋白表达下调,p-mTOR、Bcl-2蛋白表达上调(均P<0.05),青蒿琥酯+复合物C组p-AMPK蛋白表达上调,p-mTOR蛋白表达下调(均P<0.05);与青蒿琥酯组比较,复合物C组、青蒿琥酯+复合物C组p-AMPK、Bax蛋白表达下调,p-mTOR、Bcl-2蛋白表达上调(均P<0.05);与复合物C组比较,青蒿琥酯+复合物C组p-AMPK、Bax蛋白表达上调,p-mTOR、Bcl-2蛋白表达下调(均P<0.05);AMPK、mTOR蛋白表达各组组间比较,差异无统计学意义(P>0.05)。

图3 各组MV4-11细胞AMPK通路相关蛋白电泳条带比较Figure 3 Comparison of electrophoretic band size of AMPK pathway-related proteins in various groups
表6 各组MV4-11细胞AMPK通路相关蛋白表达水平比较Table 6 Comparison of expression levels of AMPK pathway-related proteins in MV4-11 cells in various groups (±s;n=3)

表6 各组MV4-11细胞AMPK通路相关蛋白表达水平比较Table 6 Comparison of expression levels of AMPK pathway-related proteins in MV4-11 cells in various groups (±s;n=3)
①P<0.05,与对照组比较;②P<0.05,与青蒿琥酯组比较;③P<0.05,与复合物C组比较
组别对照组青蒿琥酯组复合物C组青蒿琥酯+复合物C组F值P值Bax蛋白相对表达量0.72±0.04 1.04±0.03①0.63±0.03①②0.80±0.07②③44.759<0.001 p-AMPK蛋白相对表达量0.83±0.03 1.02±0.02①0.32±0.02①②0.94±0.04①②③360.333<0.001 AMPK蛋白相对表达量1.16±0.12 1.15±0.05 1.10±0.11 1.09±0.15 0.287 0..77 p-mTOR蛋白相对表达量0.98±0.06 0.49±0.07①1.13±0.01①②0.71±0.07①②③71.769<0.001 mTOR蛋白相对表达量1.28±0.11 1.04±0.18 1.17±0.09 1.22±0.12 1.891 0.21 Bcl-2蛋白相对表达量0.72±0.09 0.48±0.02①0.97±0.12①②0.61±0.06②③43.094<0.001
3 讨论
据统计,全球范围内白血病死亡率位于恶性肿瘤中前10位,急性髓系白血病(AML)的成人发病率最高,儿童位居第二,占儿童白血病死亡率50%以上[11]。AML的发病机制主要是造血干细胞或髓系造血祖细胞分化受阻导致幼稚造血细胞恶性增生,未成熟的髓细胞增殖失控、分化障碍、凋亡受阻,大量蓄积于骨髓及其他造血组织,抑制骨髓的正常造血功能。临床表现为贫血、发热、出血、白细胞减少导致的感染以及肝脾淋巴结肿大等[12]。目前,标准的化学疗法可治愈40%~45%的年轻AML患者和10%~20%的成年AML患者,但对于复发及难治性疾病的患者,治愈率不超过10%,异基因造血干细胞移植是这些患者治愈的唯一希望,然而手术价格昂贵,排异反应大,术后复发率高,且常伴有系列并发症等局限性[13]。常规化学药物毒性高、副作用大、机体容易产生耐药性。因此,需要寻找不同的温和、高效药物对其进行联合治疗。
青蒿琥酯是我国经典的一线抗疟药物,具有多种生物学活性,且毒副作用小、易耐受、与中药不产生交叉耐药。研究表明,青蒿琥酯具有抗肿瘤特性[14-15],对多种急性白血病细胞株包括耐药细胞株均具有抑制增殖和促进凋亡的作用[16],但其作用机制研究较少。本研究观察青蒿琥酯对AML细胞株MV4-11增殖凋亡的影响,结果显示,青蒿琥酯对AML细胞株MV4-11的增殖具有抑制作用,增殖抑制率呈现时间、剂量依赖性。流式细胞分析实验结果表明,青蒿琥酯可以阻滞MV4-11细胞的G0/G1、G2/M期,诱导细胞凋亡。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路与细胞增殖、分化、凋亡等多个生物学过程密切相关,参与肿瘤的发生发展过程,调节AMPK通路,可促进AML分化和阻断增殖[17]。AMPK是一个异源三聚体蛋白,内含一个催化性α亚单位和调节性β、γ亚单位,AMP结合到γ亚单位后,使苏氨酸172位点变成更易磷酸化的底物,变构激活复合体,造成胞内钙离子水平发生变化[18]。AMPK可对ATP低水平做出反应,可对补充细胞ATP供应的信号转导通路进行正向调控[19],是能量代谢调节的关键分子,对肿瘤细胞的生长、增殖、自噬、凋亡、侵袭转移和极性调控方面具有重要影响。Zhou等[20]研究表明,青蒿琥酯通过上调ROS并激活人膀胱癌细胞中的AMPKmTOR信号通路诱导自噬依赖性细胞凋亡。Xiao等[21]研究显示,青蒿琥酯通过激活AMPK/mTOR途径抑制口腔鳞状癌细胞增殖。本研究取对数生长期MV4-11细胞,经青蒿琥酯、AMPK通路阻断剂复合物C及青蒿琥酯联合复合物C处理后检测Bcl-2、Bax mRNA表达水平,AMPK、Bcl-2、Bax蛋白表达及AMPK、mTOR磷酸化水平。结果显示,青蒿琥酯可以上调MV4-11细胞Bax mRNA的转录和p-AMPK、Bax蛋白的表达,下调Bcl-2 mRNA的转录和p-mTOR、Bcl-2蛋白的表达,AMPK通路阻断剂复合物C则呈相反的作用效果,阻断剂和青蒿琥酯同时处理后,阻断剂对相关基因转录和蛋白表达的促进或抑制作用被逆转,提示青蒿琥酯通过调控AMPK信号通路抑制AML细胞株MV4-11的增殖,诱导其凋亡。
综上所述,青蒿琥酯可以抑制MV4-11细胞的增殖,诱导其凋亡,其作用机制可能与激活AMPK信号通路,调控细胞增殖凋亡相关基因的表达有关,此为青蒿琥酯相关药物的研发及应用于AML的临床治疗提供了理论支持。
