白藜芦醇对子宫内膜癌荷瘤裸鼠的抑瘤作用及对免疫功能的影响
2022-03-24李元昆鲁笑钦胡滨屈红杰顾晓荔
李元昆,鲁笑钦,胡滨,屈红杰,顾晓荔
(郑州大学第二附属医院妇科,河南郑州 450014)
子宫内膜癌(endometrial cancer)为妇科常见的恶性肿瘤,其发病率逐年攀升,并呈年轻化趋势,严重影响女性的生殖健康[1-2]。寻找中药抗肿瘤活性成分和明确其抗肿瘤作用机制成为该领域的研究热点。白藜芦醇(resveratrol)为非黄酮类多酚化合物,广泛存在于虎杖、藜芦、葡萄等药用植物及食物当中,具有抗肿瘤、抗炎、免疫调节等多种药理学活性[3-4]。白藜芦醇对人宫颈癌AN3CA细胞,子宫内膜癌HEC-1B、KLE及Ishikawa细胞的增殖以及两者移植瘤小鼠模型肿瘤的生长均有较好的抑制作用[4]。研究表明,肿瘤的发生发展与免疫炎症密切相关,由于肿瘤微环境慢性炎症的存在,Toll样受体4(TLR4)/髓样分化因子88(MyD88)信号通路可被异常激活,诱导多种促炎因子和抗凋亡蛋白的产生,促进肿瘤的侵袭转移[5]。那么,靶向作用于TLR4/MyD88信号通路,调节子宫内膜癌患者免疫功能可能可以有效地抑制子宫内膜的增殖侵袭,因此,本研究构建人子宫内膜癌Ishikawa细胞荷瘤裸鼠模型,探讨白藜芦醇对荷瘤裸鼠肿瘤生长及TLR4/MyD88介导的免疫炎症调节机制,以期为白藜芦醇的临床应用提供更多的药效研究基础。现将研究结果报道如下。
1 材料与方法
1.1 实验动物及细胞SPF级BALB/c-nu裸鼠,4~6周龄,雄性,30只,体质量18~22 g,购自北京维通利华实验动物技术有限公司。动物质量合格证号:202011179;动物生产许可证号:SCXK(京)2020-1-003;动物批次号:202007013。人子宫内膜癌Ishikawa细胞株,购自中国科学院上海生命科学研究院。该实验方案已经郑州大学第二附属医院实验动物伦理委员会审核批准。
1.2 药物与试剂白藜芦醇(纯度≥98%,5 mg/支)购自美国Sigma公司,批号:20192-307;注射用顺铂(10 mg/支)购自山东齐鲁制药有限公司,批号:201986509。肿瘤坏死因子α(TNF-α)、白细胞介素2(IL-2)、干扰素γ(IFN-γ)酶联免疫吸附分析(ELISA)试剂盒均购自武汉伊莱瑞特生物科技股份有限公司;细胞计数试剂盒8(CCK-8)购自上海碧云天生物技术公司;藻红蛋白(Phycoerythrin,PE)标记的CD4抗体、PE-CD8a抗体、别藻蓝蛋白(Allophycocyanin,APC)标记的CD3e抗体均购自美国BD公司;兔抗鼠TLR4单克隆抗体、兔抗鼠MyD88单克隆抗体、兔抗鼠核因子κB(NF-κB)p65单克隆抗体和兔抗鼠GAPDH单克隆抗体均购自美国Abcam公司。
1.3 仪器IX73倒置荧光显微镜购自日本奥林巴斯光学有限公司;BD FACS Calibur流式细胞仪购自美国Beckman Coulter公司;B5060EK CO2细胞培养箱购自德国Hearers公司;JY92-2D超声波细胞粉碎机购自美国Bio-Tek生物仪器有限公司。
1.4 细胞培养常规复苏子宫内膜癌Ishikawa细胞,转移至含10%热灭活的胎牛血清RPMI 1640培养液中,迅速置于饱和湿度、37℃、5%CO2的培养箱内培养并进行传代。收集对数生长期的细胞,用0.5%胰蛋白酶消化传代,使用磷酸盐缓冲液(PBS)配制成浓度为1.8×107个/mL的细胞悬液。
1.5 子宫内膜癌荷瘤裸鼠模型的建立将配制好的子宫内膜癌Ishikawa细胞混悬液接种于实验裸鼠的右腋部皮下,每只裸鼠接种0.1 mL。接种5 d后,可观察到裸鼠接种癌细胞的部位出现扁平或椭圆形的包块,并且逐渐增大,视为建立子宫内膜癌皮下移植瘤模型成功[6]。
1.6 动物分组与给药方法将造模成功的30只BALB/c-nu裸鼠按照随机数字表法分为模型组,顺铂组和白藜芦醇低、中、高剂量组,每组6只。在造模第8天,皮下移植瘤生长至1 cm左右时进行药物干预,顺铂组腹腔注射1 mL的顺铂(2 mg·kg-1),白藜芦醇低、中、高剂量组分别腹腔注射1 mL剂量为2.5、5、10 mg·kg-1的白藜芦醇,模型组给予等体积的生理盐水腹腔注射,每天1次,连续给药21 d。
1.7 观察指标与方法
1.7.1 测定子宫内膜癌荷瘤裸鼠肿瘤体积、抑瘤率及免疫器官指数各组荷瘤裸鼠在停药后第2天处死前,每隔3 d使用游标卡尺测量每只荷瘤鼠肿瘤的短径(b)与长径(a),计算肿瘤体积[V=(a×b2)×1/2],并绘制移植瘤生长曲线。停药后第2天,眼眶收集静脉血后,无菌操作剥离肿瘤、胸腺和脾脏组织,称质量,计算抑瘤率、胸腺指数、脾脏指数。抑瘤率=(m模型组平均瘤质量-m实验组平均瘤质量)/m模型组平均瘤质量×100%;胸腺指数=m胸腺/m体质量;脾脏指数=m脾脏/m体质量[7]。
1.7.2 ELISA法检测子宫内膜癌荷瘤裸鼠血清中TNF-α、IFN-γ及IL-2含量收集各组荷瘤裸鼠静脉血,分离血清,于4℃静置20 min后,离心取上清,分装后于-80℃保存待测。采用ELISA法,按照对应试剂盒说明书中的操作步骤,使用酶标仪测定450 nm波长处吸光度(OD)值,计算血清中TNF-α、IFN-γ及IL-2含量[8]。
1.7.3 流式细胞术检测荷瘤裸鼠外周血中CD4+及CD8+T淋巴细胞水平参考文献研究[9]的方法制备外周血细胞混悬液,收集的外周血,加入3 mL红细胞裂解液低温裂解10 min,随后离心(300 r/min,离心半径15 cm)10 min;分离上清后再次加入3 mL红细胞裂解液低温裂解,再次低温离心(300 r/min,离心半径15cm)10 min后,使用PBS重悬收集的细胞沉淀;吸取外周血细胞悬液,加入500μL Binding Buffer悬浮细胞,再加入APC-CD3e、PE-CD4和PE-CD8a抗体,避光孵育15 min;低温离心(300 r/min,离心半径15 cm)10 min后,分离上清,PBS洗涤后使用多聚甲醛溶液定容;过350目滤网后,进行流式上机。以CD3e+CD8+双阳性细胞亚群表示CD8+T细胞所占比例,以CD3e+CD4+双阳性细胞亚群百分比表示CD4+T细胞所占比例,检测CD4+、CD8+T细胞水平,并计算CD4+/CD8+比值。
1.7.4 测定子宫内膜癌荷瘤裸鼠免疫功能
1.7.4.1 检测NK细胞杀伤功能 将分离得到的脾脏置于200目灭菌筛网上碾压挤碎,加入5 mL淋巴细胞分离液后过滤,制备单脾细胞悬液,使用RPMI-1640培养液重悬并调整细胞浓度为5×107个/mL,作为效应细胞。传代培养至浓度1×106个/mL的K562细胞作为靶细胞。在96孔板中加入100μL K562细胞,置于37℃、5%CO2及饱和湿度的培养箱中培养8 h,随后加入100μL效应细胞,效靶比为50∶1,同时另设单纯靶细胞孔和效应细胞孔,常规条件下继续培养48 h,加入20μL的四甲基偶氮唑盐(MTT)(5 mg/mL)继续培养3 h,再加入100μL二甲基亚砜(DMSO),最后使用酶标仪在570 nm波长处测定各孔的OD值,计算细胞抑瘤率,评价NK细胞杀伤功能。细胞抑瘤率=1-(OD实验孔-OD单纯效应孔)/OD靶细胞孔×100%[10]。
1.7.4.2 检测T淋巴细胞增殖转化能力 按上述方法制备单脾细胞悬液,使用RPMI-1640培养液漂洗2次后调整细胞浓度为2×106个/mL,在96孔板中加入100μL单脾细胞悬液和100μL的刀豆蛋白(10μg/mL)作为实验孔,对照孔加入100μL单脾细胞悬液和100μL的RPMI-1640培养液,常规条件下继续培养48 h,加入10μL的MTT(5 mg/mL)继续培养4 h,最后使用酶标仪在570 nm波长处测定各孔的OD值,计算T淋巴细胞转化刺激指数[11]。
1.7.4.3 检测腹腔巨噬细胞吞噬功能 处死各组裸鼠后,使用PBS缓冲液灌洗裸鼠腹腔并收集灌洗液,随后离心(300 r/min,离心半径15 cm)10 min。然后收集细胞,使用DMEM培养基调整细胞浓度为2×106个/mL,在96孔板中加入200μL腹腔巨噬细胞悬液,常规条件下继续培养4 h,去除未贴壁的细胞,更换培养基后继续培养12 h,加入50μL中性红溶液(3 mg/mL)继续培养4 h。使用PBS缓冲液漂洗后,加入200μL细胞裂解液,随后使用酶标仪在540 nm波长处测各孔的OD值[12]。
1.7.5 蛋白免疫印迹(Western Blot)法检测脾脏组织中TLR4/MyD88信号通路相关蛋白表达水平分离上述各组裸鼠的脾脏组织,制备脾脏组织匀浆,放射免疫沉淀分析(RIPA)裂解后提取脾脏组织总蛋白,用二喹啉甲酸(BCA)试剂盒进行蛋白定量。随后常规上样、聚丙烯酰胺凝胶电泳,经转膜、封闭,随后依次加入TLR4(1∶1 000)、MyD88(1∶1 000)、NF-κB p65(1∶1 000)及GAPDH(1∶1 000)等一抗稀释液,4℃孵育过夜[13]。辣根过氧化物酶标志鼠抗兔二抗稀释液(1∶2 000),化学底物发光法显色,图像扫描分析。采用Image-QuaNT软件测量其光密度,以GAPDH为内参对照分析。
1.8 统计方法采用SPSS 21.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析(One-way ANOVA)检验,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 白藜芦醇对子宫内膜癌荷瘤裸鼠肿瘤生长的影响在接种20 d后,顺铂组和白藜芦醇高剂量组的肿瘤体积显著低于模型组(P<0.05);在接种24 d后,白藜芦醇中剂量组的肿瘤体积亦显著低于模型组(P<0.05);在接种全程,白藜芦醇低剂量组的肿瘤体积与模型组比较,差异无统计学意义(P>0.05)。具体结果见图1。
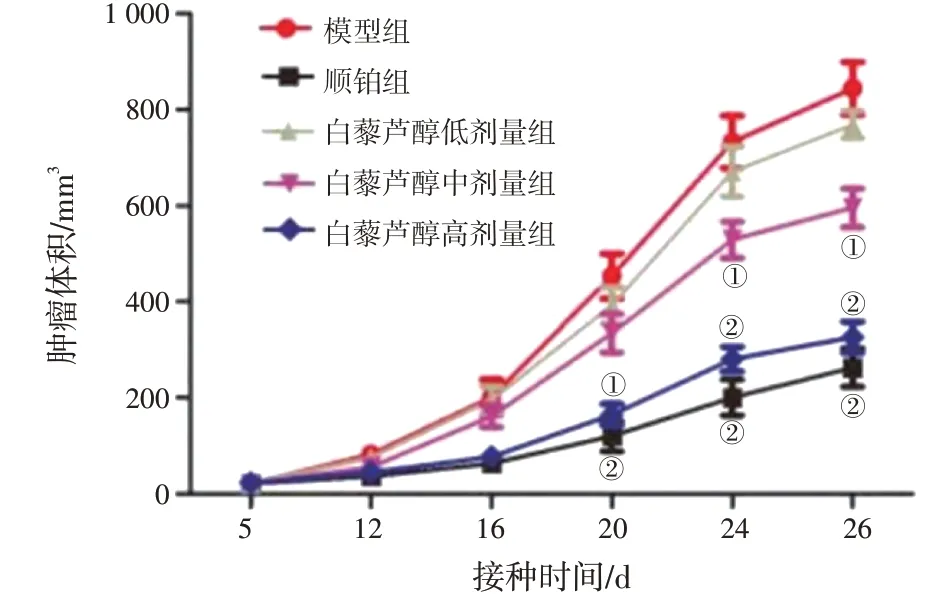
图1 各组荷瘤裸鼠肿瘤体积变化图Figure 1 Tumor volume changes of tumor-bearing nude mice in each group
各组荷瘤裸鼠在接种28 d后肿瘤实物如图2所示。

图2 接种28 d后荷瘤裸鼠肿瘤实物图Figure 2 Physical image of tumor-bearing nude mice 28 days after transplantation
5组荷瘤裸鼠肿瘤质量比较,差异均有统计学意义(P<0.05)。与模型组比较,顺铂组和白藜芦醇低、中、高剂量组的肿瘤质量显著降低(P<0.05);与顺铂组比较,白藜芦醇低、中、高剂量组的肿瘤质量显著增加(P<0.05);白藜芦醇各剂量组组间肿瘤质量比较,差异均有统计学意义(P<0.05),且随着白藜芦醇剂量的增加,抑瘤率明显提高。具体结果见表1。
表1 各组荷瘤裸鼠肿瘤质量及抑瘤率的比较Table 1 Comparison of tumor mass and tumor inhibition rate in tumor-bearing nude mice of various groups(±s)

表1 各组荷瘤裸鼠肿瘤质量及抑瘤率的比较Table 1 Comparison of tumor mass and tumor inhibition rate in tumor-bearing nude mice of various groups(±s)
①P<0.05,与模型组比较;②P<0.05,与顺铂组比较;③P<0.05,与白藜芦醇低剂量组比较;④P<0.05,与白藜芦醇中剂量组比较
抑瘤率/%—78.21±3.74 15.14±2.43②45.33±3.68②③67.65±4.17②③④组别模型组顺铂组白藜芦醇低剂量组白藜芦醇中剂量组白藜芦醇高剂量组鼠数/只66666肿瘤质量/g 2.44±0.75 0.52±0.11①2.07±0.36①②1.31±0.42①②③0.78±0.23①②③④
2.2 白藜芦醇对子宫内膜癌荷瘤裸鼠免疫器官指数的影响表2结果显示,与模型组比较,顺铂组的胸腺指数及脾脏指数显著降低(P<0.05),白藜芦醇中、高剂量组均显著增加(P<0.05),但白藜芦醇低剂量组无显著性差异(P>0.05)。与顺铂组比较,白藜芦醇低、中、高剂量组的胸腺指数及脾脏指数均显著增加(P<0.05)。与白藜芦醇低剂量组比较,白藜芦醇中、高剂量组的胸腺指数及脾脏指数均显著增加(P<0.05)。白藜芦醇中、高剂量组胸腺指数及脾脏指数组间比较,差异无统计学意义(P>0.05)。
表2 各组荷瘤裸鼠免疫器官指数的比较Table 2 Comparison of immune organ index of tumorbearing nude mice in various groups (±s,mg·g-1)

表2 各组荷瘤裸鼠免疫器官指数的比较Table 2 Comparison of immune organ index of tumorbearing nude mice in various groups (±s,mg·g-1)
①P<0.05,与模型组比较;②P<0.05,与顺铂组比较;③P<0.05,与白藜芦醇低剂量组比较
脾脏指数5.35±0.38 3.39±0.43①5.66±0.47②6.72±0.34①②③7.18±0.29①②③组别模型组顺铂组白藜芦醇低剂量组白藜芦醇中剂量组白藜芦醇高剂量组鼠数/只66666胸腺指数1.82±0.31 1.02±0.26①1.95±0.22②2.47±0.33①②③2.76±0.28①②③
2.3 白藜芦醇对子宫内膜癌荷瘤裸鼠血清TNF-α、IFN-γ及IL-2含量的影响表3结果显示:与模型组比较,顺铂组和白藜芦醇低、中、高剂量组的血清TNF-α、IFN-γ及IL-2含量均显著增加(P<0.05或P<0.01)。与顺铂组比较,白藜芦醇各剂量组的血清TNF-α、IFN-γ及IL-2含量均显著增加(P<0.05)。白藜芦醇各剂量组血清TNF-α、IFN-γ及IL-2含量组间比较均有差异(P<0.05),随着白藜芦醇剂量的增加,血清TNF-α、IFN-γ及IL-2含量明显增加(P<0.05或P<0.01)。
表3 各组荷瘤裸鼠血清TNF-α、IFN-γ及IL-2含量的比较Table 3 Comparison of serum TNF-α,IFN-γand IL-2 contents in tumor-bearing nude mice of various groups(±s,ng·L-1)

表3 各组荷瘤裸鼠血清TNF-α、IFN-γ及IL-2含量的比较Table 3 Comparison of serum TNF-α,IFN-γand IL-2 contents in tumor-bearing nude mice of various groups(±s,ng·L-1)
①P<0.05,②P<0.01,与模型组比较;③P<0.05,④P<0.01,与顺铂组比较;⑤P<0.05,⑥P<0.01,与白藜芦醇低剂量组比较;⑦P<0.05,⑧P<0.01,与白藜芦醇中剂量组比较
IL-2 2.65±0.11 3.17±0.16①3.52±0.22①③3.95±0.31①③⑤4.47±0.29①③⑤⑦组别模型组顺铂组白藜芦醇低剂量组白藜芦醇中剂量组白藜芦醇高剂量组鼠数/只66666 TNF-α 315.76±27.16 358.25±18.76①418.39±38.25②④467.19±27.71②④⑤526.78±33.19②④⑥⑧IFN-γ 3.29±0.47 3.88±0.39①4.47±0.22①③4.88±0.26①③⑤5.48±0.37①③⑤⑦
2.4 白藜芦醇对子宫内膜癌荷瘤裸鼠外周血T淋巴细胞亚群水平的影响表4、图3结果显示:与模型组比较,顺铂组CD4+、CD8+T细胞水平及CD4+/CD8+比值差异无统计学意义(P>0.05),白藜芦醇中、高剂量组的CD4+T细胞水平及CD4+/CD8+比值均显著增加(P<0.05)、CD8+T细胞水平显著降低(P<0.05),白藜芦醇低剂量组的CD4+/CD8+比值显著增加(P<0.05)、CD8+T细胞水平显著降低(P<0.05)、CD4+T细胞水平无显著性差异(P>0.05)。与顺铂组比较,白藜芦醇各剂量组的CD4+T细胞水平及CD4+/CD8+比值均显著增加(P<0.05)、CD8+T细胞水平显著降低(P<0.05)。白藜芦醇各剂量组CD4+、CD8+T细胞及CD4+/CD8+比值组间均有显著性差异(P<0.05),且随着白藜芦醇剂量的增加,CD4+T细胞水平及CD4+/CD8+比值明显增加、CD8+T细胞水平明显降低(P<0.05)。

图3 各组荷瘤裸鼠外周血T淋巴细胞亚群的流式散点图Figure 3 Comparison of flow cytometry scatter diagram of T lymphocyte subsets in peripheral blood of tumor-bearing nude mice in various groups
表4 各组荷瘤裸鼠外周血T淋巴细胞亚群水平的比较Table 4 Comparison of level of T lymphocyte subsets in peripheral blood of tumor-bearing nude mice in various groups (±s)

表4 各组荷瘤裸鼠外周血T淋巴细胞亚群水平的比较Table 4 Comparison of level of T lymphocyte subsets in peripheral blood of tumor-bearing nude mice in various groups (±s)
①P<0.05,与模型组比较;②P<0.05,与顺铂组比较;③P<0.05,与白藜芦醇低剂量组比较;④P<0.05,与白藜芦醇中剂量组比较
CD4+/CD8+0.72±0.15 0.76±0.27 1.01±0.28①②1.23±0.33①②③1.56±0.32①②③④组别模型组顺铂组白藜芦醇低剂量组白藜芦醇中剂量组白藜芦醇高剂量组鼠数/只66666 CD4+/%17.39±3.67 15.98±1.82 18.67±2.77②21.54±3.25①②③23.18±3.78①②③④CD8+/%22.47±2.31 20.32±3.49 18.15±2.79①②16.89±1.98①②③13.76±2.67①②③④
2.5 白藜芦醇对子宫内膜癌荷瘤裸鼠免疫功能的影响表5结果显示:与模型组的淋巴细胞增殖能力、巨噬细胞吞噬功能及NK细胞杀伤活性比较,顺铂组均降低(P<0.05),白藜芦醇中、高剂量组均增加(P<0.05),白藜芦醇低剂量组则无显著性差异(P>0.05)。与顺铂组比较,白藜芦醇各剂量组的上述指标均增加(P<0.05)。白藜芦醇各剂量组上述指标组间比较也有显著性差异,且随着白藜芦醇剂量的增加,淋巴细胞增殖能力、巨噬细胞吞噬功能及NK细胞杀伤活性明显提高。
表5 各组荷瘤裸鼠NK细胞杀伤活性、淋巴细胞增殖能力及巨噬细胞吞噬功能的比较Table 5 Comparison of killing activity of NK cells,proliferation ability of lymphocytes and phagocytic function of macrophages in tumor-bearing nude mice (±s)

表5 各组荷瘤裸鼠NK细胞杀伤活性、淋巴细胞增殖能力及巨噬细胞吞噬功能的比较Table 5 Comparison of killing activity of NK cells,proliferation ability of lymphocytes and phagocytic function of macrophages in tumor-bearing nude mice (±s)
①P<0.05,②P<0.01,与模型组比较;③P<0.05,与顺铂组比较;④P<0.05,与白藜芦醇低剂量组比较;⑤P<0.05,与白藜芦醇中剂量组比较
NK细胞杀伤活性/%45.72±3.18 33.66±2.76①46.66±3.62③57.19±4.17②③④64.18±4.85②③④⑤组别模型组顺铂组白藜芦醇低剂量组白藜芦醇中剂量组白藜芦醇高剂量组鼠数/只66666淋巴细胞增殖能力OD值0.45±0.03 0.32±0.02①0.47±0.04③0.56±0.05①③④0.68±0.05①③④⑤巨噬细胞吞噬功能OD值0.59±0.06 0.42±0.04①0.61±0.05③0.77±0.06①③④0.82±0.05①③④⑤
2.6 白藜芦醇对子宫内膜癌荷瘤裸鼠脾脏中TLR4/MyD88信号通路相关蛋白表达的影响表6、图4结果显示:与模型组比较,顺铂组裸鼠脾脏中TLR4、MyD88及NF-κB p65的表达无显著性变化(P>0.05),白藜芦醇低剂量组中TLR4的表达显著增加(P<0.05)、MyD88及NF-κB p65的表达无显著性变化(P>0.05),白藜芦醇中、高剂量组TLR4、MyD88及NF-κB p65的表达均显著增加(P<0.05)。与顺铂组比较,白藜芦醇低剂量组中TLR4的表达显著增加(P<0.05)、MyD88及NFκB p65的表达无显著性变化(P>0.05),白藜芦醇中、高剂量组TLR4、MyD88及NF-κB p65的表达均显著增加(P<0.05)。白藜芦醇各剂量组TLR4、MyD88及NF-κB p65表达的组间比较,有显著性差异(P<0.05),随着白藜芦醇剂量的增加,TLR4、MyD88及NF-κB p65的表达明显增加(P<0.05)。

图4 各组荷瘤祼鼠脾脏TLR4、MyD88及NF-κB p65的Western Blot电泳图Figure 4 Western Blot analysis of TLR4,MyD88 and NF-κB p65 in spleen of each group
表6 各组荷瘤裸鼠脾脏TLR4、MyD88、NF-κB p65蛋白表达水平的比较Table 6 Comparison of protein expression levels of TLR4,MyD88,NF-κB p65 in spleen in tumor-bearing nude mice of various groups (±s)

表6 各组荷瘤裸鼠脾脏TLR4、MyD88、NF-κB p65蛋白表达水平的比较Table 6 Comparison of protein expression levels of TLR4,MyD88,NF-κB p65 in spleen in tumor-bearing nude mice of various groups (±s)
①P<0.05,与模型组比较;②P<0.05,与顺铂组比较;③P<0.05,与白藜芦醇低剂量组比较;④P<0.05,与白藜芦醇中剂量组比较
NF-κB p65相对表达量0.22±0.04 0.25±0.03 0.28±0.04 0.57±0.05①②③0.64±0.05①②③④组别模型组顺铂组白藜芦醇低剂量组白藜芦醇中剂量组白藜芦醇高剂量组鼠数/只66666 TLR4相对表达量0.13±0.02 0.14±0.03 0.33±0.03①②0.45±0.04①②③1.05±0.05①②③④MyD88相对表达量0.14±0.02 0.16±0.02 0.19±0.03 0.35±0.03①②③0.67±0.04①②③④
3 讨论
近年来,白藜芦醇等天然化合物的抗肿瘤活性日益受到关注,其对多种肿瘤细胞的增殖均表现出较好的抑制作用[14]。白藜芦醇可通过调节Bax及Bcl-2等凋亡蛋白的表达,抑制宫颈癌细胞株U14及人子宫内膜癌AN3CA、Ishikawa等细胞株的增殖,诱导凋亡[15]。本研究中,白藜芦醇能够明显降低Ishikawa细胞株移植瘤的生长速度,降低移植瘤的瘤体质量,抑瘤率明显增加,说明白藜芦醇对于体内子宫内膜癌细胞的生长同样具有较好的作用,这与此前相关白藜芦醇对子宫内膜癌荷瘤裸鼠抑制作用的报道相一致[16]。同时,白藜芦醇还可以通过降低肿瘤组织巨噬细胞移动抑制因子和微血管密度抑制宫颈癌移植瘤的生长[17]。因此,白藜芦醇对于子宫内膜癌和宫颈癌等肿瘤细胞体内外均具有较好的抗肿瘤活性。
肿瘤的发生发展与免疫炎症密切相关,机体免疫功能的降低可致使肿瘤细胞逃逸免疫系统的监控,促进肿瘤的转移[18]。胸腺和脾脏作为机体重要的免疫器官,两者指数的高低在一定程度上反映了机体免疫功能的强弱[19]。本研究结果显示,白藜芦醇对于子宫内膜癌荷瘤裸鼠的干预,能够显著增加其胸腺指数及脾脏指数,表明白藜芦醇可以有效防止子宫内膜癌荷瘤裸鼠免疫器官萎缩及功能减退,维持和提高免疫功能。脾脏作为机体细胞免疫和体液免疫的中心组织,含有大量的淋巴细胞、NK细胞及吞噬细胞[20]。本研究结果显示,白藜芦醇能够明显提高荷瘤裸鼠脾脏中淋巴细胞增殖能力、巨噬细胞吞噬功能及NK细胞杀伤活性,而阳性药顺铂组荷瘤裸鼠的上述指标却显著降低,再次表明白藜芦醇的抗肿瘤作用与提高子宫内膜癌荷瘤裸鼠免疫功能有关。
在肿瘤患者的免疫系统中,T淋巴细胞具有重要作用,CD4+等辅助/诱导T淋巴细胞能够分泌IL-2、TNF-α等细胞因子,刺激B细胞活化发挥抗肿瘤效应,CD8+等抑制/细胞毒T淋巴细胞则能够分泌抑制因子,具有负调控作用,因此,T细胞亚群的数目和比值能够很好地评价机体免疫功能状态[21]。白藜芦醇对于子宫内膜癌荷瘤裸鼠的干预,能够显著增加血中CD4+T细胞亚群比例,降低CD8+T细胞亚群比例,从而提高CD4+/CD8+比值。TNF-α、IL-2和IL-6等细胞因子是机体免疫系统发挥免疫调节作用和抗癌作用的主要物质[22]。本研究结果显示,白藜芦醇的干预还能够明显增加荷瘤裸鼠血清中TNF-α、IFN-γ及IL-2等细胞因子的分泌,进一步激活机体免疫功能。因此,白藜芦醇可通过增加TNF-α、IL-2和IFN-γ等细胞因子的分泌,刺激T细胞的活化,进而发挥增强免疫、抗肿瘤的作用。
Toll样受体作为天然免疫模式识别受体,主要存在于免疫细胞表面,参与机体的天然免疫和适应性免疫过程,多数单体中药成分的抗肿瘤及免疫调节作用均与TLRs信号通路有关[23]。MyD88作为TLRs信号通路的接头分子,活化后可激活NF-κB,进而调节免疫因子的分泌,促进淋巴细胞的增殖活化[24]。白藜芦醇对于子宫内膜癌荷瘤祼鼠的干预,能够显著增加脾脏中TLR4、MyD88及NF-κB p65的表达,而阳性药顺铂对荷瘤裸鼠脾脏中TLR4、MyD88及NF-κB p65的表达无显著影响,表明白藜芦醇能够激活脾脏TLR4/MyD88信号通路,又进一步说明白藜芦醇具有的促免疫作用可能与激活TLR4/MyD88信号通路有关。
综上所述,白藜芦醇能够抑制子宫内膜癌荷瘤祼鼠肿瘤的生长,其作用机制可能与激活脾脏TLR4/MyD88信号通路,进而调节机体的免疫功能有关。
