米曲霉发酵厨余垃圾制备富酶产物的研究
2022-03-24冶荣霞李雪琪刘晓佩李鸣晓
贾 璇,郭 萌,冶荣霞,李 辉,李雪琪,刘晓佩,李鸣晓,戴 昕
1. 北京工商大学,中国轻工业清洁生产和资源综合利用重点实验室,北京 100048
2. 北京工商大学,国家环境保护食品链污染防治重点实验室,北京 100048
3. 中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012
4. 南京万德斯环保科技股份有限公司,江苏 南京 211100
厨余垃圾是指居民日常生活和学校、公司等单位供餐,以及餐饮服务等活动中产生的有机垃圾,在生活垃圾中占比为49.4%~64.5%. 厨余垃圾具有高油脂、高含水率、高有机质和高盐分“四高”属性,并且含有多种微量元素,易腐败和滋生细菌. 随着我国垃圾分类政策的实施,厨余垃圾产量剧增,据报道,2020年我国厨余垃圾产量已达到1.2×10t. 厨余垃圾的高值化利用迫在眉睫,其中生物处理因其条件温和、产物可控,成为国内外研究热点. Dienye等利用水果废弃果皮和黑曲霉的遗传特性菌株白化金藻()生产柠檬酸,发现白化金藻适合培养黑曲霉,具有较大的柠檬酸生产潜力,并可减少农业环境污染. Jurado等研究认为,接种菌剂可以强化在处理过程中整个微生物系统的生长及活性. Kwan等研究表明,真菌水解发酵干酪乳杆菌是将餐厨垃圾转化为乳酸的有效途径.
在厨余垃圾生物处理过程中,菌株的选取至关重要. 米曲霉分泌的丰富酶系能有效降解淀粉及蛋白质原料,为其他微生物的生长代谢奠定基础. 目前,米曲霉已应用于食品加工领域,但在有机废弃物资源化领域的研究刚刚起步. Mamo等发现,利用米曲霉产凝乳蛋白酶可提高丹伯干酪的生产率. Miyazawa等证明,半乳糖氨基半乳聚糖和α-1,3-葡聚糖都有助于米曲霉菌丝在液体培养中的聚集. 汪刚慧将米曲霉接种到餐厨垃圾中生产水解酶,利用生物酶强化污泥厌氧消化. Pleissner等在泡盛曲霉和米曲霉的深层发酵中,获得了富含葡萄糖、磷酸盐的水解产物. Pengthamkeerati等以木薯、甘蔗渣和污泥为培养基,接种米曲霉TISTR 3 605进行固态发酵产生α-淀粉酶. Balakrishnan等用食用油饼固态发酵优化了酸碱度、培养时间和温度的条件,从而提高了米曲霉生产α-淀粉酶的速率.
目前,对米曲霉的研究仅局限于食品加工、生长特性、污泥的厌氧消化和富含营养物质的水解产物等方向,对于不同米曲霉的生长特性和产酶规律尚有待研究. 因此,该研究以厨余垃圾为底物,通过对比两株米曲霉的生长特性及其好氧发酵过程中的产酶规律,旨在为厨余垃圾高值化利用提供理论依据和技术支撑.
1 材料与方法
1.1 试验材料
厨余垃圾
厨余垃圾取自北京某大学食堂,将厨余垃圾中的骨头、果核等大块杂质分拣出后,用粉碎机匀浆,过20目(0.85 mm)筛后置于4 ℃冰箱保存备用. 厨余垃圾基本理化指标如表1所示.

表 1 厨余垃圾基本理化指标Table 1 Basic physical and chemical indexes of kitchen waste
米曲霉
所用米曲霉CGMCC3.4427 (简称“米曲霉C”)购于中国微生物菌种保藏管理委员会普通微生物中心,米曲霉BNCC142787 (简称“米曲霉B”)购于北纳创联生物技术研究院.
1.2 试验设计
米曲霉孢子液制备
将平板培养的米曲霉收集至无菌瓶中,用无菌水稀释100倍后置于4 ℃冰箱保存备用,利用稀释平板计数法测得米曲霉B、米曲霉C的孢子悬浮液的浓度分别为90、85个/mL.
生长条件优化
分别取米曲霉B和米曲霉C的孢子悬浮液5 mL接种到100 mL液体培养基(葡萄糖2%、蛋白胨1%、KHPO0.1%、MgSO0.05%、NaCl 0.05%)中,于38 ℃、120 r/min下培养,每隔24 h取出2 mL液体培养基,用滤纸过滤后将真菌菌丝体烘干后称量,以菌丝体干质量为纵坐标、培养时间为横坐标,绘制米曲霉的生长曲线.
采用察氏固体培养基培养72 h后进行形态观察,探究米曲霉B和米曲霉C在不同温度(20、30、40、50 ℃)和pH(5、6、7)条件下的生长特性.
米曲霉酶源制备
接种米曲霉孢子悬浮液,研究不同培养方式(静置、振荡)和培养温度(30、35、40 ℃)对两株米曲霉固态发酵产酶活性的影响. 为保证试验的准确性且获得更好的富酶产物,通过灭菌方式开展研究,避免土著生物的干扰.
设计10组试验,每组设3个平行. 每个锥形瓶内称取50 g破碎后的厨余垃圾,初始pH调至6,高温灭菌并冷却至室温后,各接种1 mL米曲霉B、米曲霉C的孢子悬浮液,加入1 mL无菌水混合培养,每隔24 h取样测定指标. 试验设计如表2所示.

表 2 厨余垃圾酶源制备试验设计Table 2 Experimental design of preparation of enzyme source from kitchen waste
1.3 分析方法
总固体(TS)含量和挥发性固体(VS)含量采用恒重法测定;蛋白质含量采用凯氏定氮法测定;淀粉含量、溶解性碳水化合物含量分别采用酸水解法和蒽酮法进行测定;pH使用pH计测量;蛋白酶、淀粉酶活性分别采用微生物蛋白水解酶、淀粉水解酶ELISA试剂盒测定.
2 结果与分析
2.1 米曲霉的生长特性分析
米曲霉生长曲线
丝状真菌类的微生物与细菌类的微生物不同,其菌体的生长主要由菌丝体的延伸完成. 米曲霉B和米曲霉C在察氏培养基中的生长曲线如图1所示,结果表明,两株米曲霉的生长曲线均分为对数期(0~48 h)、稳定期(48~96 h)和衰亡期(96~120 h). 在培养初期,米曲霉逐渐适应环境开始生长,培养液中出现肉眼可见的菌丝,随后菌丝体生长速率加快,进入对数生长期,菌丝开始不断地增长和增厚,菌液中开始出现黏液状菌丝,72 h后米曲霉进入生长衰亡期,由于菌丝体自溶,菌丝体干质量开始减少. 张晓琦发现,在pH为5、温度为35 ℃、转速为140 r/min、56 h条件下米曲霉生长曲线也呈现先升后降的趋势. 试验结果显示,米曲霉B和米曲霉C的干质量分别在72和48 h达到最大值,分别为0.120和0.111 g.

图 1 两种米曲霉的生长曲线Fig.1 Growth curve of two Aspergillus oryzae
米曲霉形态特征
每种真菌都有最适合其生长的温度,且pH直接影响细胞外酶的活性和微生物的代谢. 米曲霉B和米曲霉C在不同温度(20、30、40、50 ℃)和pH(5、6、7)条件下培养72 h后的形态特征分别如图2、3所示. 米曲霉在察氏固体培养基上形成菌落较快,培养初期生出孢子,初为嫩黄色,继而转到黄绿色,米曲霉的生长可分为3个阶段:孢子发芽期、菌丝生长期、产孢子期.
由图2、3可见,在20 ℃下,米曲霉B和米曲霉C生长缓慢;在30和40 ℃、培养72 h下,米曲霉B、米曲霉C的生长速率在pH为6时生长最佳,其中40 ℃下的生长速率快于30 ℃;在50 ℃、培养72 h下,米曲霉B和米曲霉C分别在pH为5、6的条件下有菌丝体产生,其余pH下米曲霉不生长. 米曲霉B和米曲霉C菌株在培养后期呈黄绿色,其中米曲霉B颜色偏绿,菌丝较长,容易结块,孢子多;米曲霉C颜色偏黄,菌丝较短,结块较少,孢子较多.

图 2 米曲霉B在不同温度和pH下的生长情况Fig.2 Growth of Aspergillus oryzae B under different temperatures and pH conditions

图 3 米曲霉C在不同温度和pH下的生长情况Fig.3 Growth of Aspergillus oryzae C under different temperatures and pH conditions
由米曲霉的形态分析可知,米曲霉的菌丝体由分割的分枝菌丝所构成,从菌丝体中生出分生孢子,孢子均呈圆形. 相对于其他情况,两株米曲霉分别在30 ℃和40 ℃、pH为6时生长最好,米曲霉B生长速率较快,产孢子较早.
2.2 不同培养方式对米曲霉产酶的影响
在米曲霉培养过程中,不同培养方式对米曲霉菌丝体的形成、形态和发酵产酶都有一定影响. 因此,探究在静置培养与振荡培养下米曲霉的产酶效果,选取A-1、A-2、A-3、A-4处理组进行分析.
培养方式对蛋白酶活性的影响
蛋白酶活性是表征厨余垃圾固态发酵酶源制备过程中酶活变化的重要参数,蛋白酶是催化其他蛋白质中肽键水解的一大类酶,可高效快速水解厨余垃圾中的蛋白质,将其转化为游离氨基酸.
如图4所示,在38 ℃下静置培养的A-1组以及振荡培养的A-3组中蛋白酶活性均呈上升-下降-

图 4 不同培养方式下米曲霉产蛋白酶活性随时间的变化情况Fig.4 Changes of protease activity of Aspergillus oryzae in different culture methods with tim
上升的趋势. 米曲霉菌丝适应新环境时吸收充足营养,新陈代谢加快,分泌大量酶. 在24 h时,A-1、A-3组的蛋白酶活性分别为50.30、53.65 U/g,可以得出,转速影响霉菌菌丝体的形成及形态,振荡(120 r/min)培养下米曲霉B的蛋白酶活性高于静置培养;在24~96 h内,随着发酵的进行,A-1、A-3组的蛋白酶活性达到一定值后呈下降趋势,96 h时分别降至33.05、19.99 U/g,可能是因为营养物的耗尽和大量代谢废物的产生,形成了大量的休眠孢子,最终降低了酶的活性;96~120 h内蛋白酶活性升高,120 h时分别升至45.99、63.85 U/g.
在38 ℃下静置培养的A-2组以及振荡培养的A-4组的蛋白酶活性在0~48 h内呈上升趋势,48 h时分别升至79.19、92.57 U/g,A-4组的蛋白酶活性高于A-2组,48 h时达到第1个峰值,原因可能是振荡培养的方式能够更好地使厨余垃圾与米曲霉充分接触,混合均匀,故能更好地促进米曲霉的菌体生长,进而促进其孢子增殖,可以推断,振荡培养可以提高米曲霉的产酶速率;在48~72 h内,A-2、A-4组的蛋白酶活性呈下降趋势,由于蛋白酶的不断溶出,环境内酶量达到环境容纳量(值)使其竞争加强,酶活性下降. 在72~96 h内,A-2、A-4组中蛋白酶活性升高,在96 h时达到第2个峰值(109.65 U/g),可能是因为,米曲霉稳定生长且厨余垃圾中的营养物质还未消耗尽,随着时间的延长,米曲霉继续吸收环境内的营养物质,促进蛋白酶溶出. 由此可见,振荡培养可加强米曲霉菌丝体的形成和生长速率,加快其繁殖,促进酶分泌,使米曲霉B和米曲霉C的蛋白酶活性分别提高26.94%、38.46%,明显优于静置培养.
培养方式对淀粉酶活性的影响
淀粉酶活性是表征厨余垃圾酶源制备过程酶活变化的主要参数,淀粉酶可将淀粉和糖原转化为单糖或低聚糖等可发酵性糖,为米曲霉及其他微生物提供碳素营养,淀粉酶活性的增加可以使发酵过程中微生物获得更多的碳源,促进碳代谢.
由图5可见,在0~24 h内,A-1、A-2、A-3、A-4组的淀粉酶活性均上升,其中A-2组数值最大,为84.07 U/g;在24~48 h内,A-1、A-3组的淀粉酶活性继续上升,A-2、A-4组的淀粉酶活性呈下降趋势,在48 h时,A-1、A-3组的淀粉酶活性分别为64.98、52.64 U/g,由于米曲霉C生长较快,产生孢子较早,产酶快,分解速率快,这两组的淀粉酶活性低于A-2、A-4组,可见,无论是振荡培养还是静置培养,米曲霉B的淀粉酶活性均低于米曲霉C;在48~72 h内,4个处理组的淀粉酶活性均呈下降趋势,表明随着发酵时间的延长,菌丝体不断地断裂与溶解,新陈代谢速率减慢,使淀粉酶活性降低;在72~120 h内,A-1、A-3、A-4组的淀粉酶活性呈上升趋势,至120 h时,A-3组的淀粉酶活性达到最高值,为137.92 U/g. 综上,在振荡条件下,两株米曲霉在厨余垃圾中产淀粉酶能力更强,淀粉酶活性分别提高54.65%、43.76%,反应底物中有大量可利用的溶解性有机物质,伴随着微生物迅速繁殖充分吸收营养物质进而大量分泌淀粉酶,促使反应体系中淀粉酶含量增加.

图 5 不同培养方式下米曲霉产淀粉酶活性随时间的变化情况Fig.5 Changes of amylase activity of Aspergillus oryzae in different culture methods with tim
2.3 不同培养温度对米曲霉产酶的影响
温度是影响酶的重要因素之一. 较高的温度会对微生物的代谢活动产生一些不利影响,还会抑制真菌生长. 由节得出,在振荡培养下两株米曲霉的产酶活性优于静置培养,基于此,探究不同温度(30、35、40 ℃)对米曲霉B和米曲霉C产酶的影响.
培养温度对蛋白酶活性的影响
由图6可见,在0~120 h内,B-1、B-3、C-1、C-2、C-3组中的蛋白酶活性均呈上升-下降-上升-下降的趋势. 在0~24 h内,两种米曲霉进入新环境发生应激反应,使蛋白酶活性均呈上升趋势,且米曲霉B的蛋白酶活性在30 ℃时升至64.23 U/g;在24~48 h内,随温度的升高,B-2、B-3、C-3组蛋白酶的催化速率增加,活性较高,且48 h时B-3组的蛋白酶活性(66.64 U/g)最佳;在48~72 h内,B-1、C-1、C-2组蛋白酶继续溶出,蛋白酶活性上升,B-2、B-3、C-3组蛋白酶活性下降,在72 h时C-2组蛋白酶活性升至63.55 U/g. 在72~120 h内,B-2、C-3组蛋白酶活性呈先升后降的趋势,且96 h时C-3组蛋白酶活性达到峰值(64.02 U/g),米曲霉C蛋白酶活性在96 h时达到了稳定期峰值. 随着发酵时间的延长,营养物逐渐耗尽,菌体自溶,菌体不再产生孢子,蛋白酶活性下降. B-1、B-3、C-2组蛋白酶活性呈下降趋势,C-1组则呈先降后升的趋势.
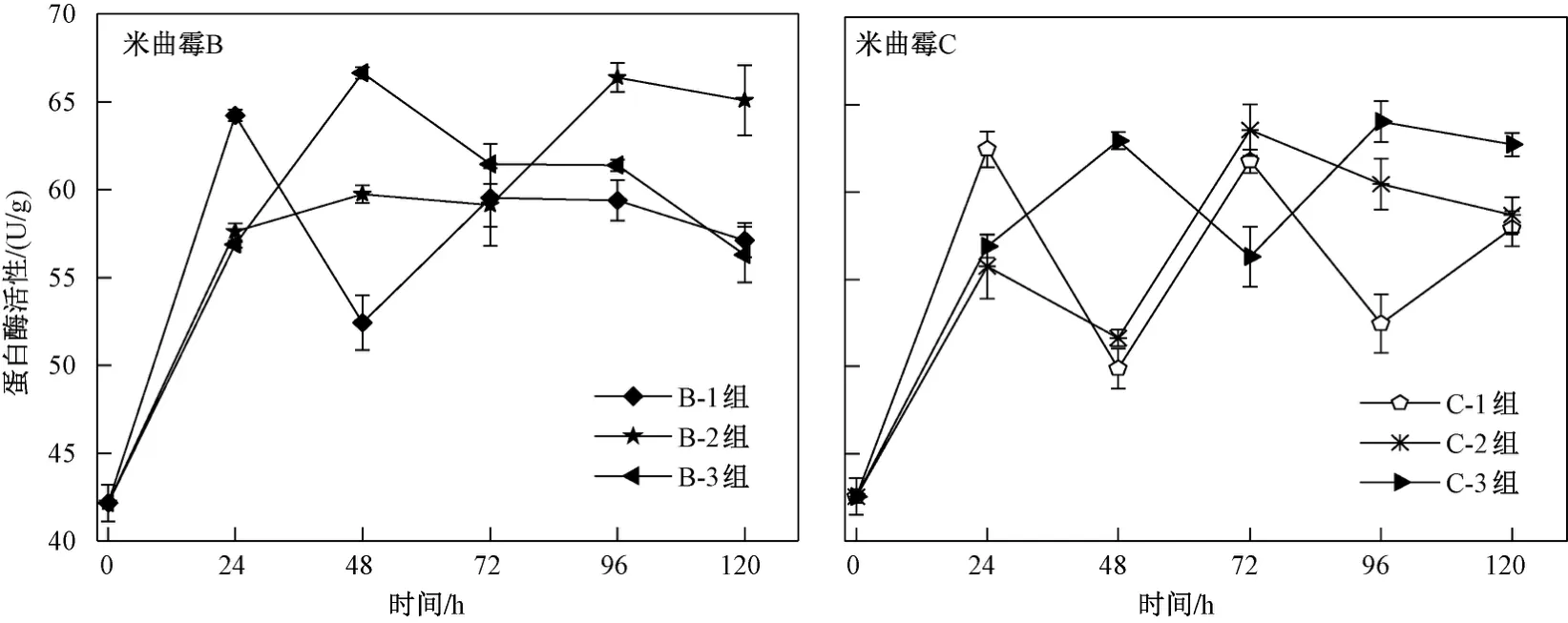
图 6 不同培养温度下米曲霉B和米曲霉C产蛋白酶活性随时间的变化情况Fig.6 Changes of protease activity of Aspergillus oryzae B and Aspergillus oryzae C with time at different culture temperatures
综上,米曲霉B在40 ℃下培养48 h时蛋白酶活性(66.64 U/g)最高,米曲霉C在40 ℃下培养96 h时的蛋白酶活性(64.02 U/g)最高.
培养温度对淀粉酶活性的影响
由图7可见,随着培养时间的延长,B、C两组淀粉酶活性均呈上升-下降-上升-下降的趋势,分别降至99.10 U/g(B-1组)、99.41 U/g(B-2组)、101.68 U/g(B-3组)、106.33 U/g(C-1组)、105.43 U/g(C-2组)、96.57 U/g(C-3组). 0~120 h内,B-1组在30 ℃下培养48 h时淀粉酶活性(129.44 U/g)达到最高;C-3组在40 ℃下培养96 h时淀粉酶活性(131.11 U/g)达到最高.

图 7 不同培养温度下米曲霉B和米曲霉C产淀粉酶活性随时间的变化情况Fig.7 Changes of amylase activity of Aspergillus oryzae B and Aspergillus oryzae C with time at different culture temperatures
在0~48 h内,由于米曲霉的快速生长和生长代谢活动,淀粉酶活性迅猛增长. 48~72 h内淀粉酶活性降低的原因可能是,随着生长时间的延长,菌丝不断溶解和断裂. 72~96 h内淀粉酶活性升高的原因可能是,虽然处于稳定期,但也有部分米曲霉菌丝体产生,96~120 h,由于米曲霉进入衰败期,培养基中营养物质的耗尽导致淀粉酶活性降低.
综上,米曲霉B在30 ℃下培养48 h时淀粉酶活性达到最高,米曲霉C在40 ℃下培养96 h时淀粉酶活性达到最高. 但从整个淀粉酶活性周期综合来看,米曲霉B的淀粉酶活性高于其他各组,故米曲霉B的淀粉酶活性优于米曲霉C.
3 结论
a) 米曲霉B和米曲霉C分别在30 ℃和40 ℃、pH为6时生长速率最佳;与静置培养相比,振荡培养可使米曲霉B和米曲霉C的蛋白酶活性分别提高26.94%、38.46%;淀粉酶活性分别提高54.65%、43.76%. 可见,振荡培养显著加强米曲霉菌丝体的形成和生长速率,加快其繁殖,促进淀粉酶和蛋白酶分泌,明显优于静置培养.
b) 厨余垃圾好氧发酵过程中,米曲霉B和米曲霉C产生蛋白酶与淀粉酶的潜在能力相当. 在120 r/min、40 ℃条件下,米曲霉B、米曲霉C的蛋白酶活性分别在48 h、96 h时达到最大,分别为66.64、64.02 U/g. 随温度的升高,蛋白酶催化的速率加快,活性升高,当温度过高时,酶活性受到抑制,同时随着时间的延长,菌体不再产生孢子,导致活性下降;在120 r/min下,30 ℃培养48 h、40 ℃培养96 h时,米曲霉B、米曲霉C产淀粉酶活性分别达到最高,为129.44、
131.11 U/g.
c) 米曲霉B可在更温和的条件下实现产酶,采用其好氧发酵厨余垃圾制备的富酶产物可以为目前厨余垃圾处理提供一种经济、可行、处理能效高的生物酶制剂,为厨余垃圾全量高值化利用提供技术支撑.
