川牛膝多糖通过调控Sema7A基因的表达对病毒性心肌炎心肌细胞损伤和细胞凋亡的影响
2022-03-24陈忠锐
陈忠锐






【摘要】 目的:研究川牛膝多糖在病毒性心肌炎心肌细胞损伤和细胞凋亡中的作用及其机制。方法:利用柯萨奇病毒B3(CVB3)诱导SD大鼠原代心肌细胞,构建病毒性心肌炎模型,并给予不同浓度的川牛膝多糖。流式细胞术检测细胞凋亡,蛋白质印迹法(Western blot)检测心肌细胞活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase-3)、Sema7A蛋白表达,试剂盒检测丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性和过氧化氢酶(CAT)活性,实时荧光定量PCR(qPCR)检测Sema7A mRNA表达。在心肌细胞中转染si-Sema7A,同时进行CVB3处理,观察抑制Sema7A表达对CVB3感染心肌细胞凋亡和氧化损伤的影响。在心肌细胞中转染Sema7A过表达载体(pcDNA Sema7A),同时进行CVB3和川牛膝多糖处理,探讨过表达Sema7A对川牛膝多糖作用的CVB3感染心肌细胞凋亡和氧化损伤的影响。结果:与空白组比较,CVB3显著增加心肌细胞凋亡率、cleaved caspase-3蛋白表达量、MDA含量、Sema7A mRNA和Sema7A蛋白表达量(P<0.05),明显降低SOD、CAT活性(P<0.05)。与CVB3组比较,20、40、80、160 μg/mL的川牛膝多糖显著减少CVB3感染心肌细胞的细胞凋亡率、cleaved caspase-3蛋白表达量(P<0.05),并且80 μg/mL川牛膝多糖明显降低MDA含量、Sema7A mRNA和蛋白表达量,显著提高SOD、CAT活性(P<0.05)。抑制Sema7A表达明显减少CVB3感染心肌细胞中Sema7A mRNA及蛋白表達量、MDA含量、cleaved caspase-3蛋白表达量、细胞凋亡率(P<0.05),提升SOD活性、CAT活性(P<0.05)。过表达Sema7A逆转了川牛膝多糖对CVB3感染心肌细胞凋亡和氧化损伤的抑制作用。结论:川牛膝多糖可能通过调控Sema7A表达,保护病毒性心肌炎心肌细胞损伤并抑制细胞凋亡。
【关键词】 川牛膝多糖 Sema7A 病毒性心肌炎 细胞凋亡
[Abstract] Objective: To study the role and mechanism of polysaccharide from Cyathulae officinalis Kuan in myocardial cell injury and apoptosis of viral myocarditis. Method: CVB3 was used to induce primary cardiomyocytes of SD rats to construct a model of viral myocarditis, and different concentrations of polysaccharides from Cyathulae officinalis Kuan were administered. Flow cytometry was used to detect cell apoptosis, Western blot was applied to analyze the expression of cleaved caspase-3 and Sema7A in cardiomyocytes, the kit detected MDA content, SOD activity and CAT activity, and qPCR determined Sema7A mRNA expression. si-Sema7A was transfected into cardiomyocytes and treated with CVB3 to observe the effect of inhibiting the expression of Sema7A on apoptosis and oxidative damage of CVB3-infected cardiomyocytes; Sema7A overexpression vector (pcDNA Sema7A) was transfected into cardiomyocytes, and CVB3 and polysaccharides from Cyathulae officinalis Kuan were treated simultaneously to investigate the effects of overexpression of Sema7A on apoptosis and oxidative damage of cardiomyocytes infected by CVB3. Result: Compared with the blank group, CVB3 obviously increased myocardial apoptosis rate, cleaved caspase-3 protein expression, MDA content, Sema7A mRNA and Sema7A protein expression (P<0.05), and significantly decreased SOD and CAT activities (P<0.05). Compared with the CVB3 group, 20, 40, 80, 160 μg/mL of polysaccharide from Cyathulae officinalis Kuan greatly reduced the apoptosis rate of CVB3-infected cardiomyocytes and the expression of cleaved caspase-3 protein (P<0.05), and 80 μg/mL polysaccharide from Cyathulae officinalis Kuan evidently decreased MDA content, Sema7A mRNA and protein expression, while markedly increased SOD and CAT activities (P<0.05). Inhibition of Sema7A expression remarkably reduced Sema7A mRNA and protein expression, MDA content, cleaved caspase-3 protein expression, apoptosis rate (P<0.05), and improved SOD activity and CAT activity in CVB3-infected cardiomyocytes (P<0.05). Overexpression of Sema7A reversed the inhibitory effects of polysaccharides from Cyathulae officinalis Kuan on apoptosis and oxidative damage of cardiomyocytes infected with CVB3. Conclusion: Polysaccharide from Cyathulae officinalis Kuan protects the cardiomyocytes of viral myocarditis and inhibits apoptosis by regulating the expression of Sema7A.
[Key words] Polysaccharide from Cyathulae officinalis Kuan Sema7A Viral myocarditis Apoptosis
First-author’s address: Benxi Central Hospital, Liaoning Province, Benxi 117000, China
doi:10.3969/j.issn.1674-4985.2022.03.008
病毒性心肌炎是最常见的心肌炎类型,常伴有心源性猝死和慢性扩张性心肌病,年轻人尤为常见[1]。病毒性心肌炎相关病毒主要包括肠道和上呼吸道感染病毒,其中最常见的是柯萨奇病毒B3(CVB3)[2]。由于对该疾病的分子机制了解有限,缺乏对病毒性心肌炎的有效治疗策略。因此,阐明病毒性心肌炎的分子机制对于理解和治疗心肌病非常关键。川牛膝为苋科植物川牛膝Cyathula officinalis Kuan的干燥根,具逐瘀通经、通利关节、利尿通淋之功,用于经闭癥瘕,胞衣不下,跌扑损伤,风湿痹痛,足痿筋挛,尿血血淋[3]。川牛膝多糖是中药川牛膝的药效成分之一,川牛膝多糖具有一定的抗氧化能力[4],可以保护H2O2刺激的PC12细胞氧化损伤,降低丙二醛(malondialdehyde,MDA)含量、活性氧(reactive oxygen species,ROS)活性而增强超氧化物歧化酶(superoxide dismutase,SOD)活性,并减少细胞凋亡[5],也可明显减轻D-半乳糖诱导的小鼠机体氧化应激,效果与维生素C相当[6]。然而对于川牛膝多糖在病毒性心肌炎中的作用鲜有报道。Semaphorin 7A(Sema7A)在神经轴突生长、肿瘤抑制以及各种炎症相关疾病的调节中发挥重要作用,在CVB3诱导的病毒性心肌炎模型中,Sema7A上调表达,下调其表达显著缓解小鼠病毒性心肌炎症状,表明Sema7A在病毒性心肌炎发病进程中扮演着重要角色[7]。基于此,本研究利用CVB3损伤SD大鼠原代心肌细胞,复制病毒性心肌炎模型,评价川牛膝多糖对心肌细胞损伤和凋亡的影响,并结合Sema7A基因探索其潜在的作用机制。
1 材料与方法
1.1 试剂 SD大鼠(SPF级)购自浙江中医药大学动物实验研究中心,川牛膝购自北京市药材公司,CVB3购自中国医学科学院生物技术研究所,Dulbecco’s modified Eagle’s medium(DMEM)培养基购自美国GIBCO公司,胎牛血清购自美国Hyclone公司,Annexin V-FITC/PI细胞凋亡检测试剂盒、MDA、SOD、过氧化氢酶(catalase,CAT)检测试剂盒购自上海碧云天生物技术研究所,RIPA裂解液购自美国Sigma公司,活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3,cleaved caspase-3)、Sema7A、β肌动蛋白(β-actin)抗体购自美国Cellular Signaling Technology公司,辣根过氧化物酶标记二抗购自北京中杉金桥生物技术有限公司,聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜购自美国Millipore公司,Tris-HCl-Tween缓冲液(Tris buffered saline with Tween,TBST)购自上海生工生物工程公司,逆转录试剂盒购自美国Thermo Fisher公司,Lipofectamine 2000、TRIzol购自美国Invitrogen公司,小干扰RNA阴性对照(si-con)、Sema7A小干扰RNA(si-Sema7A)、过表达空载体pcDNA、Sema7A過表达载体(pcDNA Sema7A)购自武汉淼灵生物科技有限公司。
1.2 川牛膝多糖制备 川牛膝饮片粉碎,取药材粉末,采用水提醇沉法提取川牛膝多糖[6,8],大孔吸附树脂进行分离纯化,经浓缩、干燥,得到川牛膝多糖,多糖提取率为4.52%。
1.3 细胞分离、培养与分组 取出生2~3 d的SD大鼠心室,参考刘真等[9]方法进行原代心肌细胞的分离,用0.05%的胰酶消化,再用0.1%的Ⅱ型胶原酶消化,结合差速贴壁纯化心肌细胞。用含10%胎牛血清的DMEM培养基培养心肌细胞,0.1 mmol/L的5-溴脱氧尿嘧啶用于抑制成纤维细胞增殖,在37 ℃、5%CO2培养箱中培养,选取72 h后的单层细胞进行后续研究。将心肌细胞(1×105)随机分为空白组(无任何处理的心肌细胞),CVB3组(模型组,使用CVB3处理心肌细胞),CVB3+川牛膝多糖20 μg/mL组(使用CVB3、20 μg/mL川牛膝多糖处理心肌细胞),CVB3+川牛膝多糖40 μg/mL组(使用CVB3、40 μg/mL川牛膝多糖处理心肌细胞),CVB3+川牛膝多糖80 μg/mL组(使用CVB3、80 μg/mL川牛膝多糖处理心肌细胞),CVB3+川牛膝多糖160 μg/mL组(使用CVB3、160 μg/mL川牛膝多糖处理心肌细胞)。其中,心肌炎细胞模型(CVB3感染心肌细胞)建立参考常欣等[10]方法,共处理7 d。独立重复实验3次,每个重复有3个复孔。
1.4 流式细胞术检测心肌细胞凋亡 细胞凋亡检测按照Annexin V-FITC/PI细胞凋亡检测试剂盒的说明进行。收集5×105个心肌细胞,加入Annexin V-FITC结合液195 μL,使细胞重悬,加入Annexin V-FITC 5 μL,轻轻混匀。加入碘化丙啶染色液10 μL,轻轻混匀。在室温条件下避光孵育10 min,检测心肌细胞凋亡。
1.5 蛋白质印迹法(Western blot)检测心肌细胞cleaved caspase-3、Sema7A蛋白表达 在心肌细胞中加入RIPA裂解液,以提取蛋白。蛋白置沸水变性,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE),然后将其转移到PVDF膜,在5%脱脂奶粉中封闭1 h。加入cleaved caspase-3、Sema7A蛋白(稀释度1︰1 000)一抗,同时加入内参蛋白β-actin一抗,4 ℃孵育过夜。使用TBST溶液洗膜15 min,重复3次,加入二抗(稀释度1︰5 000),室温中孵育1 h,TBST溶液洗膜15 min,重复3次,显色显影,分析cleaved caspase-3、Sema7A蛋白表达。
1.6 MDA含量、SOD活性和CAT活性测定 心肌细胞经不同处理后,取200 μL上清液,按照各自试剂盒说明书的指示,评估细胞中MDA含量、SOD活性和CAT活性。
1.7 实时荧光定量PCR(quantitative real-time polymerase chain reaction,qPCR)检测Sema7A mRNA表达 为检测心肌细胞中Sema7A mRNA水平,采用TRIzol试剂提取细胞总RNA,利用逆转录试剂盒合成cDNA,之后进行qPCR反应。Sema7A正向引物序列5’-TACCAGGGTCTATGGCGTTTTC-3’,反向引物序列5’-GCCCATGTGGTAGCCTTTGA-3’。收集Ct值,根据2-ΔΔCt法分析Sema7A mRNA相对表达量。
1.8 细胞转染 调整心肌细胞密度为1×105个/mL,将其接种至6孔板,心肌细胞融合至70%时,利用Lipofectamine 2000试剂,将si-con、si-Sema7A、pcDNA、pcDNA Sema7A转染入心肌细胞,培养备用。根据不同的实验目的,将转染si-con、si-Sema7A的心肌细胞使用CVB3处理,转染pcDNA、pcDNA Sema7A的细胞使用CVB3和80 μg/mL川牛膝多糖处理。
1.9 统计学处理 数据采用SPSS 22.0软件进行处理分析,计量资料以(x±s)表示。两组间数据比较采用t检验,多组数据间比较用单因素方差分析,组间多重比较用SNK-q检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 川牛膝多糖对心肌细胞凋亡和cleaved caspase-3蛋白表达的影响 流式细胞术检测结果显示,与空白组比较,CVB3组细胞凋亡率明显升高(P<0.05);与CVB3组比较,CVB3+川牛膝多糖20、40、80、160 μg/mL组的细胞凋亡率均下降(P<0.05)。Western blot检测结果发现,与空白组相比,CVB3组心肌细胞中cleaved caspase-3蛋白表达量明显增加(P<0.05);与CVB3组比较,CVB3+川牛膝多糖20、40、80、160 μg/mL组的cleaved caspase-3蛋白水平均下降(P<0.05)。见图1、表1。
2.2 川牛膝多糖对心肌细胞氧化损伤的影响 与空白组相比,CVB3组心肌细胞中MDA含量明显增加,SOD、CAT活性均显著降低(P<0.05);与CVB3组比较,CVB3+川牛膝多糖80 μg/mL组MDA含量明显减少,SOD、CAT活性均显著提高(P<0.05)。见表2。
2.3 川牛膝多糖对心肌细胞中Sema7A基因表达的影响 qPCR和Western blot检测结果显示,CVB3组心肌细胞中Sema7A mRNA和蛋白表达量均明显高于空白组(P<0.05),CVB3+川牛膝多糖80 μg/mL组心肌细胞中Sema7A mRNA和蛋白表达量均显著低于CVB3组(P<0.05)。见表3、图2。
2.4 抑制Sema7A表达对CVB3感染心肌细胞凋亡和氧化损伤的影响 与空白组比较,CVB3明显影响Sema7A mRNA、Sema7A蛋白、MDA含量、SOD活性、CAT活性、cleaved caspase-3蛋白表达和细胞凋亡率(P<0.05)。在心肌细胞中转染si-Sema7A,发现CVB3+si-Sema7A组心肌细胞中Sema7A mRNA和蛋白表达量均明显低于CVB3+si-con组(P<0.05)。與CVB3+si-con组相比,CVB3+si-Sema7A组心肌细胞中MDA含量明显减少,SOD活性、CAT活性均显著提高,cleaved caspase-3蛋白表达量明显降低,细胞凋亡率显著减少,差异均有统计学意义(P<0.05)。见图3、表4。
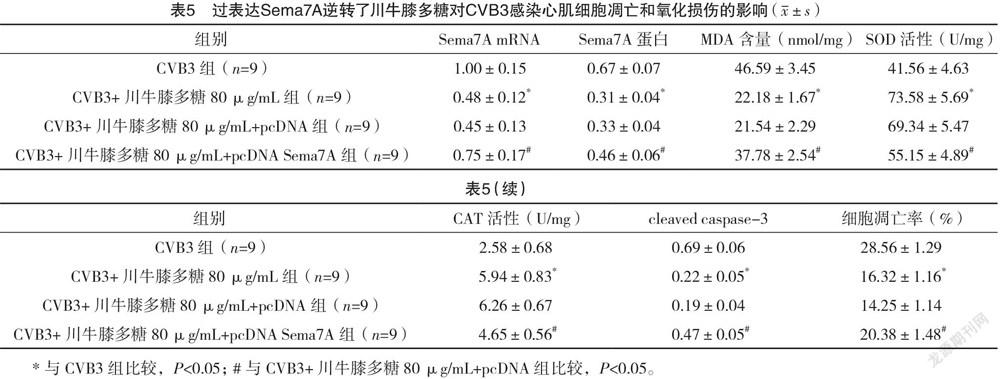
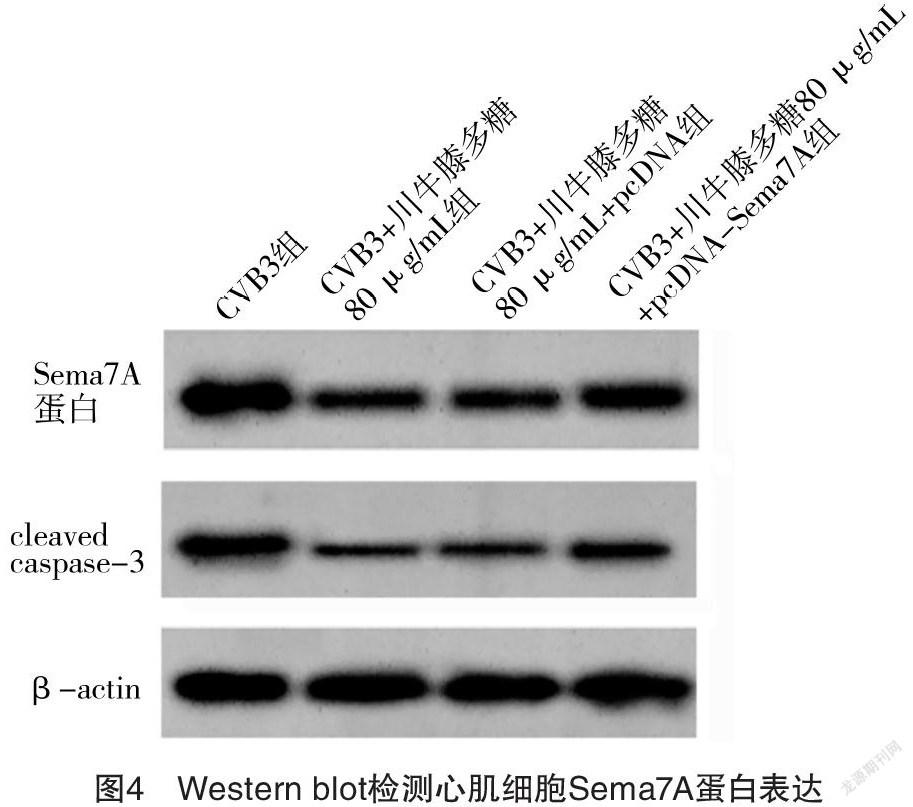
2.5 过表达Sema7A逆转了川牛膝多糖对CVB3感染心肌细胞凋亡和氧化损伤的影响 CVB3组与CVB3+川牛膝多糖80 μg/mL组心肌细胞中Sema7A mRNA、Sema7A蛋白、MDA含量、SOD活性、CAT活性、cleaved caspase-3蛋白表达和细胞凋亡率比较,差异均有统计学意义(P<0.05)。CVB3+川牛膝多糖80 μg/mL+pcDNA Sema7A组较CVB3+川牛膝多糖80 μg/mL+pcDNA组明显提高心肌细胞内Sema7A mRNA、Sema7A 蛋白表达量,增加MDA含量,降低SOD活性、CAT活性,提升cleaved caspase-3蛋白水平,并提高细胞凋亡率,差异均有统计学意义(P<0.05)。见表5、图4。
3 讨论
病毒性心肌炎是一种常见的心血管疾病,严重危害人们的健康,甚至导致猝死[11-12]。病毒性心肌炎与年龄小于40岁的成年人或儿童的心源性猝死有关[13]。病毒性心肌炎的死亡率主要归因于其易于发展为慢性炎症性和扩张型心肌病,其特点为预后不良[14]。目前,尽管对该疾病病理生理学机制的诊断和了解取得了显著进展,但仍然没有特定的治疗方法。流行病学研究表明,CVB3是病毒性心肌炎最常见的病原体[15]。CVB3可以通过心肌细胞的凋亡和坏死诱导心肌损伤,由病毒基因组翻译产生的蛋白可以以各种方式显著影响细胞蛋白的结构和功能,包括关闭宿主蛋白,切割转录因子,细胞周期停滞,细胞凋亡等[16]。因此,有效控制CVB3感染是改善心肌损伤的关键。
川牛膝多糖是川牛膝活性成分之一,具有抗氧化、抗肿瘤、抗病毒等活性[17]。既往研究表明,磷酸化的川牛膝多糖可以促进细胞毒性T淋巴细胞(CTL)和自然杀伤细胞(NK)的杀伤活性,刺激小鼠免疫应答[18]。川牛膝多糖可以抑制犬细小病毒感染F81细胞的能力,表现出一定的抗病毒作用。4个磷酸化川牛膝多糖(pRCPS1-4)表现出明显的抗病毒活性[19]。本研究中,CVB3诱导心肌细胞凋亡,并造成氧化损伤,而川牛膝多糖可以有效减轻CVB3对心肌细胞的作用,在一定程度上阻滞病毒性心肌炎进展。川牛膝多糖明显抑制CVB3感染的心肌细胞凋亡率、cleaved caspase-3蛋白表达、MDA水平,并提高抗氧化酶SOD、CAT活性,显示出对病毒性心肌炎的保护作用。
Sema7A与心血管疾病密切相关。Sema7A是在病毒性心肌炎中表达上调,敲除Sema7A可显著改善心脏功能,提高CVB3感染小鼠7 d时的存活率,减少炎症反应,Sema7A可能在CVB3诱导的心肌炎过程中发挥关键作用[20]。本项研究显示,抑制Sema7A表达明显降低CVB3感染心肌细胞的细胞凋亡率、cleaved caspase-3蛋白表达、MDA含量(P<0.05),显著提高SOD活性、CAT活性(P<0.05),表明Sema7A是CVB3感染心肌细胞过程中重要的影响因子。而川牛膝多糖明显下调CVB3感染心肌细胞中Sema7A mRNA和蛋白表达(P<0.05),提示川牛膝多糖的保护作用与Sema7A密切相关。为了进一步揭示川牛膝多糖对病毒性心肌炎的作用机制,构建过表达Sema7A的心肌细胞,并使用CVB3和川牛膝多糖进行处理,发现过表达Sema7A逆转了川牛膝多糖对CVB3感染心肌细胞凋亡和氧化损伤的抑制作用,表明调控Sema7A表达可能是川牛膝多糖保护病毒性心肌炎的重要机制之一。
综上所述,川牛膝多糖明显降低CVB3感染的心肌细胞凋亡、cleaved caspase-3蛋白表达、MDA含量,提高SOD、CAT活性,有效减轻病毒性心肌炎细胞凋亡和氧化损伤,其保护作用可能是通过调控Sema7A表达实现的,这为病毒性心肌炎的治疗提供了新的思路。
参考文献
[1]廖光芝,高电萨.病毒性心肌炎性别差异研究进展[J].心血管病学进展,2020,41(2):42-45.
[2] WANG Y,WEI C X,SHAO L Q,et al.MiRNA Signaling in Viral Myocarditis Novel and Unique Pathological Features[J].Acta Cardiologica Sinica,2018,34(1):77-86.
[3]国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2015:38.
[4]李娜,余璇,于巧红,等.中药多糖类成分稳定性研究进展[J].中国中药杂志,2019,44(22):19-25.
[5]王媛媛,张雪芹,袁菲菲,等.川牛膝和怀牛膝多糖抗炎免疫调节活性研究[J].济宁医学院学报,2018,41(2):132-134.
[6]邱雪,王倩,王瑞,等.川牛膝多糖提取及单糖组分分析[J].中药与临床,2020,11(3):10-13,17.
[7]吴学洁.Sema7A在CVB3诱导的病毒性心肌炎中的作用及其机制[D].苏州:苏州大学,2016:35-39.
[8]王倩.川牛膝多糖抗痛风作用及其组分研究[D].成都:成都中医药大学,2017:9-11.
[9]刘真,杨志玲,刘晓艳.新生SD大鼠心肌成纤维细胞的原代培养方法[J].中西医结合心脑血管病杂志,2021,19(5):755-757.
[10]常欣,王昆,芦秋彤,等.依那普利对CVB3诱导的病毒性心肌炎小鼠的保護作用[J].免疫学杂志,2020,36(1):69-73.
[11] CHANG J J,LIN M S,CHEN T H,et al.Heart failure and mortality of adult survivors from acute myocarditis requiring intensive care treatment-a nationwide cohort study[J].International Journal of Medical Sciences,2017,14(12):1241-1250.
[12] XU H F,GAO X T,LIN J Y,et al.MicroRNA-20b suppresses the expression of ZFP-148 in viral myocarditis[J].Molecular and Cellular Biochemistry,2017,429(1-2):199-210.
[13] GOU W,ZHANG Z,YANG C,et al.MiR-223/Pknox1 axis protects mice from CVB3-induced viral myocarditis by modulating macrophage polarization[J].Experimental Cell Research,2018,366(1):41-48.
[14] MITEVA K,PAPPRITZ K,SOSNOWSKI M,et al.Mesenchymal stromal cells inhibit NLRP3 inflammasome activation in a model of Coxsackievirus B3-induced inflammatory cardiomyopathy[J]. Scientific Reports,2018,8(1):2820.
[15] ZHOU N,YUE Y,XIONG S.Sex hormone contributes to sexually dimorphic susceptibility in CVB3-induced viral myocarditis via modulating IFN-γ+ NK cell production[J].Canadian Journal of Cardiology,2018,34(4):492-501.
[16]周飞,滕林,邹文博,等.RIP3/CaMKII信号通路对重症病毒性心肌炎小鼠心脏功能及生存曲线的影响[J].中国病理生理杂志,2021,37(1):146-150.
[17]刘小妹,程中琴,施崇精,等.川牛膝多糖的研究概况[J].亚太传统医药,2017,13(24):61-63.
[18] FENG H,MCDONOUGH S,FAN J,et al.Phosphorylated radix cyathulae officinalis polysaccharides act as adjuvant via promoting dendritic cell maturation[J].Molecules,2017,22(1):106-122.
[19] FENG H,FAN J,YANG S,et al.Antiviral activity of phosphorylated Radix Cyathulae officinalis polysaccharide against Canine Parvovirus in vitro[J].International Journal of Biological Macromolecules,2017,99:511-518.
[20] WU X J,MENG Y M,WANG C,et al.Semaphorin7A aggravates coxsackievirusB3-induced viral myocarditis by increasing α1β1-integrin macrophages and subsequent enhanced inflammatory response[J].Journal of Molecular and Cellular Cardiology,2018,114:48-57.
(收稿日期:2021-06-07) (本文编辑:占汇娟)
