动脉瘤性蛛网膜下腔出血患者介入治疗后miR-27a 表达水平及意义
2022-03-23陈飞虎陈建龙林海峰
陈飞虎,陈建龙,林海峰
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)是一种由颅内动脉瘤破裂导致的脑出血性疾病,有发病率高、致残率高和致死率高等特点[1-2]。目前,针对aSAH 的治疗虽取得一定进展,但预后仍不容乐观,其长期死亡率仍高达10%~24%[3-4]。探究预示aSAH 预后的指标有着重要意义,可有效辅助临床治疗方案和康复管理方案的制定。有研究报道,上调微小核糖核酸-27a(microRNA-27a,miR-27a)表达可抑制神经元凋亡,增强神经元活性,从而改善aSAH 诱发的大鼠脑部损伤和认知功能障碍[5]。基于此,推测miR-27a与aSAH 预后有关,是其预后评估的潜在生物标志物。目前,鲜有研究分析miR-27a 与aSAH 预后的关系,本研究选取接受介入治疗的aSAH 患者作为研究对象,分析介入治疗前后miR-27a 表达水平变化及其与aSAH 预后的关系,以期为aSAH预后评估提供参考。
1 资料与方法
1.1 一般资料
选取2019 年3 月至2021 年1 月在文昌市人民医院接受介入治疗的171 例aSAH 患者作为研究对象。参照《中国蛛网膜下腔出血诊治指南2019》中相关标准诊断aSAH[6]。纳入标准:(1)经血管造影确诊为aSAH,且患者首次发病;(2)发病12 h 内接受弹簧圈动脉瘤栓塞术治疗。排除标准:(1)外伤诱发的脑出血;(2)既往有脑卒中史、神经退行性疾病史等;(3)严重的心肝肾等功能异常或恶性肿瘤;(4)血小板计数<100×109/L 或国际标准化比值>1.4;(5)生命体征不稳定。受试对象中男性67 例,女性104 例;年龄(47.37±4.96)岁,范围40~64 岁。本研究符合《世界医学协会赫尔辛基宣言》,所有aSAH 患者或家属均知情同意,签署了知情同意书,本研究经文昌市人民医院医学伦理委员会批准。
1.2 方法
1.2.1 血清miR-27a 表达水平检测 分别于介入治疗前和介入治疗后24 h 抽取aSAH 患者的肘部静脉血10 ml,离心后提取血清,将其冻存于-80℃冰箱中保存,待验。用实时荧光定量PCR 法[7]检测aSAH 患者血清miR-27a 表达水平。实验步骤:(1)取冻存的血清,解冻后用RNA 提取试剂盒(日本TAKARA 公司)提取血清中总RNA;(2)用752 型紫外分光光度计(上海光学仪器五厂有限公司)检测RNA 纯度,本实验中RNA 的吸光度值(OD260/280)比均在1.9~2.0;(3)取2 μg 的RNA,用逆转录试剂盒(日本TAKARA 公司)将其转录为cDNA;(4)用CFX96 型实时荧光定量PCR 仪(美国伯乐公司)扩增cDNA,反应条件为95℃10 min,95℃15 s,60℃30 s,72℃30 s,40 个循环。miR-27a 上游序列:5′-CGCGTTCACAGTGGCTAAGT-3′,下游序列:5′-GTGCAGGGTCCGAGGTATTC-3′;内参U6 上游序列:5′-CTCGCTTCGGCAGCACA-3′,下游序列:5′-AACGCTTCACGAATTTGCGT-3′。ΔCt=CtmiR-27a-CtU6,用2-ΔΔCt计算miR-27a 的相对表达水平。
1.2.2 预后随访及评估 本研究采用门诊和电话等方式随访,了解aSAH 患者精神状态、日常生活状况等,本研究共随访了211 例aSAH 患者,其中40 例随访失联(未纳入研究进行分析),失访率为18.96%,随访截止时间为2021 年4 月23 日。采用改良Rankin 量表(modified Rankin scale,mRS)评分评价aSAH 患者治疗90 d 预后,mRS≤2 分为预后良好,mRS>2 分为预后不良。mRS 评分赋分标准:(1)症状轻微,无明显残疾,可独自完成日常活动赋1 分;(2)轻度残疾,能独自料理日常生活,但不能完全从事发病前的活动赋2 分;(3)中度残疾,可独自行走,但其他复杂日常活动需他人帮助赋3 分;(4)重度残疾,不能独自行走,且其他日常活动需他人照顾赋4 分;(5)严重残疾,患者持续卧床,大小便失禁,需持续床旁护理赋5 分;(6)死亡赋6 分[8]。本研究中预后良好组124 例,预后不良组47 例。
1.3 统计学处理
用SPSS 23.0 软件做统计分析。正态分布的计量资料用均数±标准差(±s)表示,2 组间比较用独立样本t检验;预后不良组和预后良好组介入治疗前后的miR-27a 表达水平比较用重复测量方差分析。计数资料用百分比(%)表示,2 组间比较用χ2检验。用受试者工作特征(receiver operating characteristic,ROC)曲线评价miR-27a 判断aSAH 预后的价值。用Logistic 回归分析aSAH 预后的风险因素。P<0.05为差异有统计学意义。
2 结果
2.1 预后良好组和预后不良组基线资料比较
预后良好组和预后不良组的性别构成、体质量指数(body mass index,BMI)、高血压史、糖尿病史、高脂血症史和动脉瘤位置差异均无统计学意义(P>0.05)。预后不良组的年龄、Hunt-Hess Ⅲ级占比、Fisher Ⅲ级占比、脑血管痉挛占比、格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分和C反应蛋白(C-reactive protein,CRP)均高于预后良好组,差异均有统计学意义(P<0.05)。见表1。
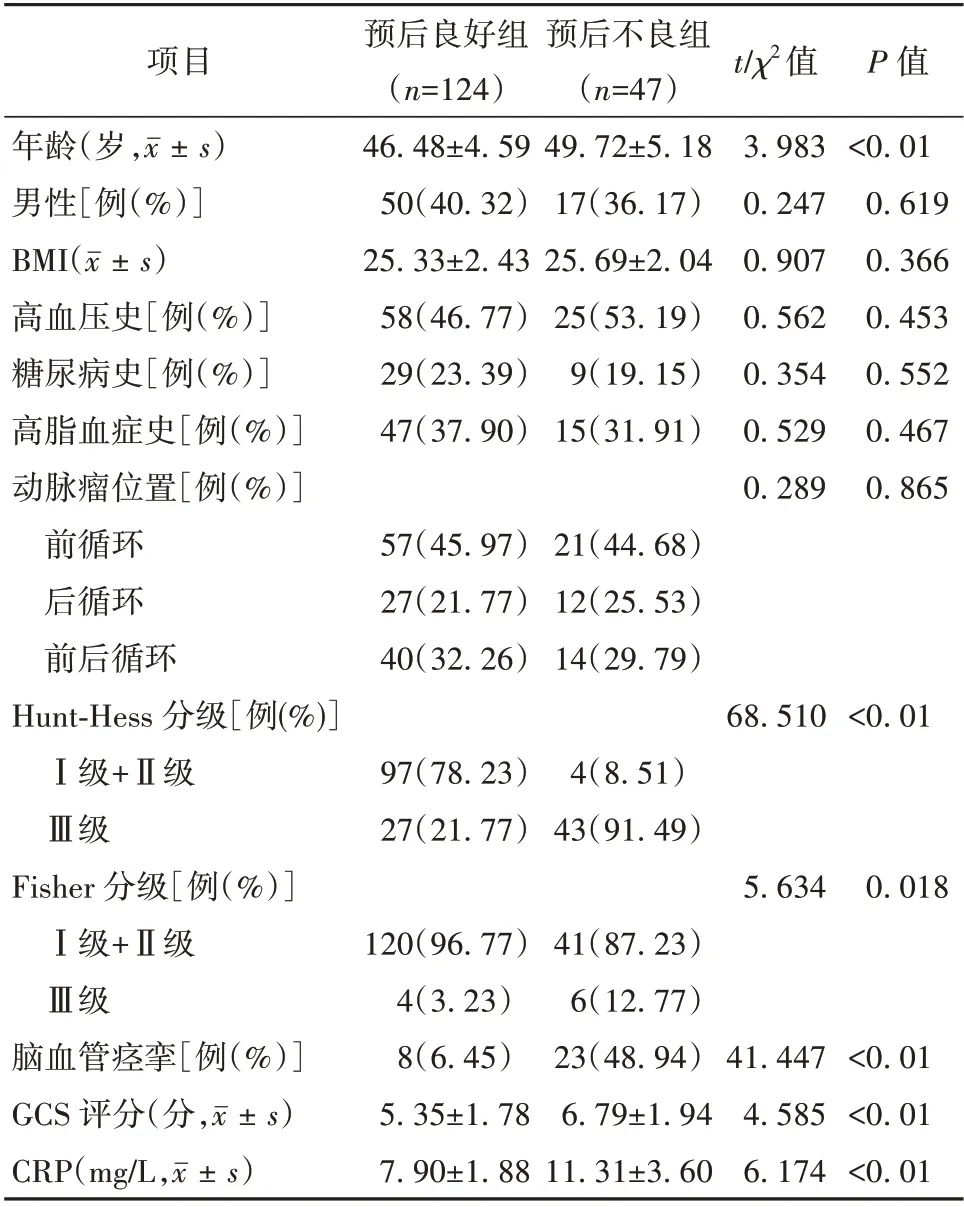
表1 预后良好组和预后不良组的动脉瘤性蛛网膜下腔出血患者基线资料比较
2.2 预后良好组和预后不良组治疗前后血清miR-27a 表达水平比较
预后良好组和预后不良组的血清miR-27a 相对表达水平差异有统计学意义(F=46.692,P<0.01),预后良好组治疗前后的血清miR-27a 相对表达水平均高于预后不良组(P<0.05);治疗前后的血清miR-27a 相对表达水平差异有统计学意义(F=140.703,P<0.01),治疗后的血清miR-27a 相对表达水平均高于治疗前(P<0.05);预后和时间有交互效应(F=10.920,P=0.001),预后良好组治疗前后血清miR-27a相对表达水平变化值高于预后不良组,差异有统计学意义(P<0.05)。见表2。
表2 预后良好组和预后不良组的动脉瘤性蛛网膜下腔出血患者治疗前后血清miR-27a 表达水平比较(± s)
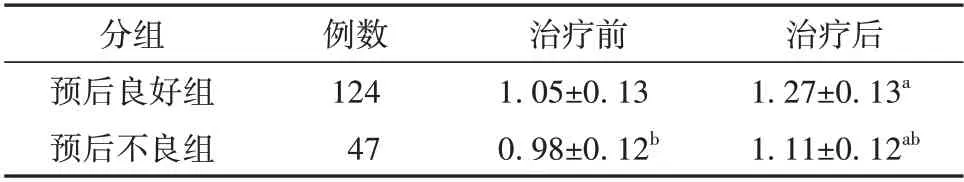
表2 预后良好组和预后不良组的动脉瘤性蛛网膜下腔出血患者治疗前后血清miR-27a 表达水平比较(± s)
注:与治疗前比较aP<0.05,与预后良好组比较bP<0.05
分组预后良好组预后不良组治疗后1.27±0.13a 1.11±0.12ab例数124 47治疗前1.05±0.13 0.98±0.12b
2.3 miR-27a 判断aSAH 预后的价值
治疗前血清miR-27a 判断aSAH 患者90 d 预后的ROC曲线下面积、最佳截断点、灵敏度和特异度分别为0.656(95%CI:0.563~0.749)、1.05、76.60% 和52.42%;治疗后血清miR-27a 判断aSAH 患者90 d 预后的ROC 曲线下面积、最佳截断点、灵敏度和特异度分别为0.814(95%CI:0.734~0.895)、1.14、72.34%和85.48%。治疗后血清miR-27a 判断aSAH 患者90 d 预后的ROC 曲线下面积高于治疗前血清miR-27a(Z=2.618,P=0.009)。见图1。
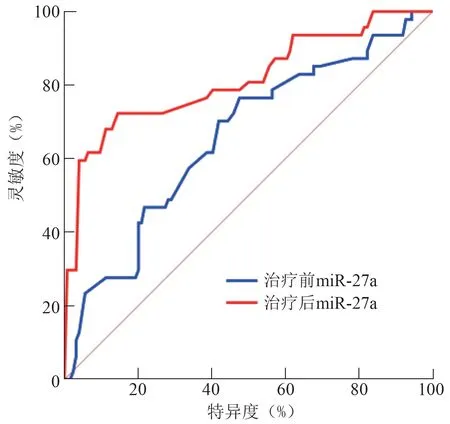
图1 miR-27a 判断aSAH 患者90 d 预后的ROC 曲线
2.4 aSAH 预后的风险因素分析
将aSAH 患者90 d 预后作为因变量,将年龄、GCS 评分、CRP、Hunt-Hess 分级、Fisher 分级、脑血管痉挛和治疗后miR-27a 作为自变量(纳入标准为P<0.1,变量赋值见表3),纳入Logistic 回归分析,结果显示GCS 评分高、CRP 水平高、Hunt-Hess Ⅲ级和脑血管痉挛均是aSAH 患者90 d 预后的独立危险因素(P<0.05),治疗后miR-27a 是aSAH 患者90 d预后的独立保护因素(P<0.05)。见表4。
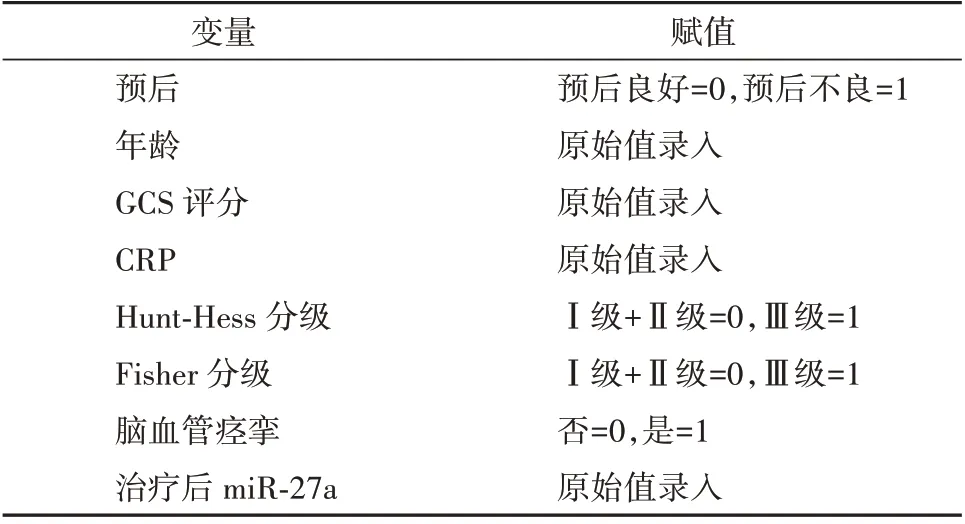
表3 变量赋值

表4 动脉瘤性蛛网膜下腔出血患者预后的风险因素分析结果
3 讨论
早期发现aSAH 预后不良的高危患者,给予及时有效的干预,可一定程度上降低aSAH 致残率,改善患者的生活质量[9]。探究预示aSAH 预后不良的生物标志物有着重要意义。
炎症反应是出血性脑损伤的重要机制,且其被认为与继发性脑损伤有关,其相关标志物对aSAH 预后有一定价值[10-12]。miR-27a 已被报道与多数炎症性疾病有关,如其可靶向磷脂酰肌醇3 激酶/丝苏氨酸激酶/雷帕霉素靶蛋白通路促进白细胞介素-1β 诱导的关节软骨细胞自噬和凋亡[13],此外,其还可抑制toll 样受体4 诱导的肾脏缺血再灌注损伤[14]。目前,多数研究[5,15]报道miR-27a 与脑出血后损伤及神经功能恢复等有关。本研究中预后良好组治疗前后的血清miR-27a 相对表达水平均高于预后不良组,2 组治疗后的血清miR-27a 相对表达水平均高于治疗前,预后良好组治疗前后血清miR-27a 相对表达水平变化值高于预后不良组,上述结果提示血清miR-27a 与aSAH 患者90 d 预后有关,或可用于aSAH 预后评估。
本研究构建了治疗前后的miR-27a 判断aSAH 患者90 d 预后的ROC 曲线,结果显示治疗后血清miR-27a 判断aSAH 患者90 d 预后的ROC 曲线下面积为0.814,高于治疗前血清miR-27a,该结果提示治疗后血清miR-27a 对aSAH患者90 d 预后有一定判断价值,可辅助临床医师决策。为避免混杂因素影响分析结果,本研究调整了年龄、GCS 评分、CRP、Hunt-Hess 分级、Fisher 分级和脑血管痉挛等因素,结果显示治疗后miR-27a 是aSAH 患者90 d 预后的独立保护因素,推测其原因有二,一是miR-27a 过表达可靶向微管相关蛋白tau 抑制神经元凋亡,增强神经元活性[5,15];二是miR-27a 过表达可抑制炎症性损伤[13-14],从而保护神经元。miR-27a 可通过上述机制改善aSAH 诱发的脑部损伤和认知功能障碍,其血清表达水平可反映脑部损伤和认知功能障碍等情况,进而反映预后。此外,本研究结果还显示GCS 评分高、CRP 水平高、Hunt-HessⅢ级和脑血管痉挛均是aSAH 患者90 d 预后的独立危险因素,与既往研究[16-18]结果一致。
综上所述,aSAH 患者介入治疗后miR-27a 表达水平低与其90 d 预后不良有关,其可辅助临床决策。本研究尚存在一定不足,一是本研究选取对象为接受血管内介入治疗的aSAH 患者,对于miR-27a 评价接受开颅夹闭术的aSAH 患者预后的价值还未可知;二是本研究仅分析miR-27a 评价接受血管内介入治疗的aSAH 患者90 d 预后的价值,关于其对患者远期预后的判断价值还需进一步研究;三是本研究样本量有限,分析结果可能存在一定偶然性,后续还需开展大样本、多中心研究充实本研究内容。
