葛根素调控miR-7 抗小鼠肝细胞缺氧-复氧存活和细胞凋亡的作用机制
2020-09-13张威王帅王喜梅张帆
张威,王帅,王喜梅,张帆
作者单位:洛阳东方医院消化科,河南 洛阳471003
肝缺血再灌注(Ischemia reperfusion,IR)损伤是一个复杂的病理生理过程,由缺氧引起的细胞损伤,随后是血流量和供氧量的恢复,从而导致细胞损伤[1]。IR损伤是肝移植、肝切除、失血性休克和肝衰竭等常见的临床并发症[2]。在肝移植病例中,IR损伤的发生引起10%病人早期移植失败,在急性和长期的排斥反应中发生率更高[3]。在肝IR 损伤过程中,缺血损伤不仅直接造成细胞损伤,还会引起急性炎症反应,进而加重肝细胞损伤、器官功能障碍和衰竭。目前,IR 损伤的机制尚不清楚,临床仍然缺乏有效的预防策略,因此,迫切需要开发新的治疗方法。葛根素主要提取自豆科植物野葛Pueraria lobata(Willd.)Ohwi的干燥根。既往研究表明,葛根素(Puerarin)或葛根素注射液在肝IR损伤中表现出良好的治疗效果[4-6],但其分子机制并未完全阐明。因此,本研究于2018年4月至2019年2月建立小鼠肝细胞缺氧-复氧(Hypoxia and reoxygenation,H-R)损伤模型来模拟IR 损伤,考察葛根素对H-R 损伤的小鼠肝细胞增殖和凋亡的影响,结合miR-7 和核因子-κB(Nuclear factor-κB,NF-κB)信号通路进一步探索葛根素的作用机制,为葛根素在IR损伤中的应用提供实验依据。
1 材料与方法
1.1试剂及仪器小鼠肝细胞购于中国科学院上海生命科学研究院细胞资源中心,DMEM 培养基、胎牛血清购于美国Gibco 公司,葛根素购于上海阿拉丁生化公司,miRNA 提取试剂盒购于上海Qiagen公司,胰酶、RIPA裂解液、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、佛波酯(PMA)购于美国Sigma公司,膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)细胞凋亡检测试剂盒购于上海碧云天生物技术研究所,Lipofectamine 2000、实时荧光定量PCR(qPCR)试剂盒购于美国赛默飞世尔有限公司,miR-7、anti-miR-7、miR-7 阴性对照(miR-con)、antimiR-7阴性对照(anti-miR-con)购于广州锐博生物有限公司,β-肌动蛋白(β-actin)、细胞核相关抗原Ki-67、B 细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)、核因子-κB(NF-κB)p65蛋白抗体购于美国Cellular Signaling Technology 公司,辣根过氧化物酶标记二抗购于博士德生物公司。BD FACSCalibur流式细胞仪购于美国BD公司,酶标仪购于美国Bio-Rad公司。
1.2细胞培养小鼠肝细胞用含10%胎牛血清的DMEM 培养基,于37 ℃、5%二氧化碳培养箱培养。每周换液2~3 次。待细胞生长至约80%融合度时,使用胰酶消化,按1∶4比例接种传代。
1.3细胞转染收集小鼠肝细胞,以1×105/mL的密度接种于6孔细胞板,当细胞融合度达约80%进行转染,按照Lipofectamine 2000试剂说明书操作,在细胞中转染miR-7或anti-miR-7及miR-con、anti-miR-con。转染24h后,进行H-R处理。
1.4实验分组将生长状态良好的小鼠肝细胞采用随机数字表法分为正常组(未H-R处理正常小鼠肝细胞):对照组(0 μmol/L葛根素处理小鼠肝细胞)、不同浓度葛根素组(分别用70 μmol/L、140 μmol/L、280 μmol/L、560 μmol/L葛根素处理小鼠肝细胞);HR组(H-R处理小鼠肝细胞):对照组(0 μmol/L 葛根素处理小鼠肝细胞)、不同浓度葛根素组(分别用70 μmol/L、14 0 μmol/L、280 μmol/L、560 μmol/L葛根素处理小鼠肝细胞),以筛选最佳药物剂量。
确定最佳药物剂量后,对小鼠肝细胞进行分组,研究葛根素对H-R损伤小鼠肝细胞的作用。小鼠肝细胞采用随机数字表法随机分为对照组(0 μmol/L 葛根素处理小鼠肝细胞)、葛根素组(280 μmol/L 葛根素处理小鼠肝细胞)、H-R 组(H-R 处理小鼠肝细胞)、H-R+葛根素组(280 μmol/L葛根素预处理小鼠肝细胞,并进行H-R 处理)、H-R+miR-con组(小鼠肝细胞中转染miR-con 并进行H-R 处理)、H-R+miR-7 组(小鼠肝细胞中转染miR-7 并进行HR处理)、H-R+葛根素+anti-miR-con 组(小鼠肝细胞中转染anti-miR-con,并进行280 μmol/L葛根素预处理和H-R处理)、H-R+葛根素+anti-miR-7组(小鼠肝细胞中转染anti-miR-7,并进行280 μmol/L葛根素预处理和H-R处理)、H-R+葛根素+PMA组(280 μmol/L 葛根素预处理小鼠肝细胞,并进行H-R 和NF-κB信号通路激活剂PMA 处理)。其中,葛根素预处理24 h。H-R处理均为缺氧3 h,复氧6 h[7]。
1.5四甲基偶氮唑盐微量酶反应比色法(MTT法)检测细胞活性小鼠肝细胞以1×105/mL 的密度接种于96 孔细胞板,每孔加入MTT 溶液(5 mg/mL)20 μL,37 ℃孵育4 h,弃去上清,加入二甲基亚砜(DMSO)150 μL,37 ℃摇床孵育10 min,酶标仪读取各孔细胞在490 nm 波长处光密度(OD)值,细胞活性=实验组OD值/对照组OD值×100%。
1.6 qPCR检测细胞中miR-7水平利用miRNA提取试剂盒提取细胞中总miRNA,逆转录为互补DNA(cDNA),并以合成的cDNA为模板,U6为内参,按照qPCR 试剂盒说明书步骤,于荧光定量PCR 仪进行反应,检测miR-7水平。miR-7正向引物序列为5′-AAAAAGAACACGTGGAAGGATAG-3′,反向引物序列为 5′-CCGCCTAACGTACCGCGAATTT-3′。实验设置 3 次重复,以 2-ΔΔCt法计算 miR-7 相对表达量。
1.7流式细胞仪检测细胞凋亡调整各组细胞密度为1×106/mL,根据细胞凋亡试剂盒的说明,使用195 μL Annexin V-FITC 结合液重悬细胞,加入5 μL Annexin V-FITC,轻轻混匀,10 μL碘化丙啶(PI),轻轻混匀,在室温条件下避光孵育20 min,置流式细胞仪分析细胞凋亡情况。
1.8蛋白质印迹法(Western Blot)检测Ki-67、Bcl-2、Bax、磷酸化核因子-κB p65(p-NF-κB p65)和NF-κB p65蛋白表达各组细胞中加入RIPA裂解液提取总蛋白,后经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白样品转移到聚偏二氟乙烯(PVDF)膜,用5%脱脂奶粉于常温条件下封闭1 h,加入一抗(1∶1 000稀释),同时加入β-actin一抗(1∶1 000 稀释)作内参蛋白,4 ℃孵育过夜,次日用Tris-HCl-Tween缓冲盐溶液(TBST)充分漂洗,加入二抗(1∶5 000稀释),室温孵育1 h,TBST充分漂洗,置化学发光液显色,曝光,分析目的蛋白相对表达量。
1.9统计学方法采用SPSS 22.0软件对结果进行统计与分析。数据以xˉ±s表示,两组间数据比较采用t检验,多组数据间比较采用单因素方差分析,多组间两两比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1不同浓度葛根素对正常小鼠肝细胞和小鼠肝细胞H-R后细胞活性的影响MTT 法检测结果显示(表1),与正常对照组相比,不同浓度葛根素处理小鼠肝细胞后,细胞活性呈下降趋势,70 μmol/L、140 μmol/L、280 μmol/L 葛根素组细胞活性差异无统计学意义(P1=0.935,P2=0.385,P3=0.116),560 μmol/L 葛根素组细胞活性显著降低(P4=0.001)。与H-R 对照组相比,不同浓度葛根素组预处理H-R小鼠肝细胞后,细胞活性随葛根素浓度增加呈先升后降趋势,70 μmol/L和560 μmol/L葛根素组细胞活性与对照组差异无统计学意义(P1>0.05,P4>0.05),而140 μmol/L和280 μmol/L葛根素组细胞活性均显著高于H-R 对照组(P2<0.001,P3<0.001)。蛋白质印迹法检测结果表明(表1、图1),与正常对照组相比,不同浓度葛根素处理小鼠肝细胞后,70 μmol/L、140 μmol/L、280 μmol/L葛根素组细胞中Ki-67蛋白表达量无明显变化(P1=0.691,P2=0.552,P3=0.06),560 μmol/L 葛根素组细胞中Ki-67 蛋白表达量显著降低(P4<0.001)。与H-R对照组相比,不同浓度葛根素组预处理H-R的小鼠肝细胞后,细胞中Ki-67 蛋白表达量随葛根素浓度增加呈先升后降趋势,其中70 μmol/L、140 μmol/L、560 μmol/L 葛根素组Ki-67 蛋白表达量与对照组差异无统计学意义(P1>0.05,P2>0.05,P4>0.05),280 μmol/L 葛根素则显著高于H-R对照组(P3<0.001)。

表1 不同浓度葛根素对正常小鼠肝细胞和小鼠肝细胞缺氧-复氧(H-R)后细胞活性的影响/xˉ±s
2.2葛根素对小鼠肝细胞H-R后小鼠肝细胞凋亡的影响对细胞凋亡的检测结果表明(图2A,表2),相比于对照组,H-R 处理的小鼠肝细胞凋亡率大幅增加(P<0.001)。相比于H-R组,葛根素+H-R组小鼠肝细胞凋亡率明显降低(P<0.001)。对Bcl-2 和Bax 蛋白表达的检测结果显示(图2B,表2),与对照组比较,H-R处理的小鼠肝细胞Bcl-2蛋白表达量明显增加(P<0.001),而Bax蛋白表达量显著降低(P<0.001)。与H-R组比较,葛根素+H-R组小鼠肝细胞Bcl-2 蛋白表达量明显升高(P<0.001),而Bax 蛋白表达量显著减少(P<0.001)。

表2 葛根素对小鼠肝细胞缺氧-复氧(H-R)后细胞凋亡的影响/xˉ±s
2.3不同浓度葛根素对小鼠肝细胞中miR-7的表达qPCR 检测结果显示,与对照组(1.00±0.07)相比,miR-7 表达量在 70 μmol/L(1.12±0.13)、140 μmol/L(1.35±0.11)、280 μmol/L(1.39±0.09)和560 μmol/L(1.49±0.09)浓度葛根素处理的小鼠肝细胞中呈上升趋势(F=12.320,P=0.001;P1=0.073,P2<0.001,P3<0.001,P4<0.001)。与H-R 组(1.00±0.05)相比,miR-7 表达量在70 μmol/L(1.46±0.11)、140 μmol/L(1.73±0.15)、280 μmol/L(3.39±0.23)和560 μmol/L(2.73±0.26)浓度葛根素处理的小鼠肝细胞中呈先升后降趋势,均显著高于H-R 组(F=90.663,P<0.001;P1=0.001,P2<0.001,P3<0.001,P4<0.001)。
2.4过表达miR-7对小鼠肝细胞H-R后细胞凋亡的影响H-R 组小鼠肝细胞中的miR-7 表达量、细胞活性、Ki-67 蛋白表达量明显低于对照组(均P<0.001,图3、表3),其细胞凋亡率、Bcl-2、Bax 蛋白表达受到显著影响(均P<0.001),结果同“2.2”。在小鼠肝细胞中转染miR-7,并用H-R 处理,发现与H-R+miR-con组相比,过表达miR-7显著提升miR-7水平,增强细胞活性(P=0.001),降低细胞凋亡率(P<0.001),提升Ki-67、Bcl-2 蛋白水平而减少Bax蛋白表达量(均P<0.001)。
2.5干扰miR-7表达部分逆转葛根素对小鼠肝细胞H-R后细胞凋亡的抑制作用miR-7 表达、细胞活性、细胞凋亡率、Ki-67、Bcl-2 和 Bax 蛋白表达在H-R 组或H-R+葛根素组小鼠肝细胞受到明显影响(均P<0.001,表4),结果同2.1~2.4部分。与H-R+葛根素+anti-miR-con组比较,H-R+葛根素+anti-miR-7组显著降低miR-7 表达量(P<0.001)、细胞活性(P=0.013),明显增加细胞凋亡率(P<0.001),降低Ki-67、Bcl-2 蛋白水平而提高Bax 蛋白表达量(均P<0.001,图4、表4)。
2.6葛根素调控miR-7表达影响小鼠肝细胞H-R NF-κB信号通路蛋白质印迹法检测结果显示(图5、表5、表6),H-R 组小鼠肝细胞中p-NF-κB p65 表达量高于对照组(P<0.001),H-R+葛根素+PMA 组p-NF-κB p65 表达量高于 H-R+葛根素组(P=0.001),H-R+葛根素组p-NF-κB p65表达量低于H-R组(P<0.001),而在H-R+葛根素+anti-miR-7组小鼠肝细胞中,p-NF-κB p65 表达量高于H-R+葛根素+anti-miR-con组(P<0.001);H-R组、H-R+葛根素组、H-R+葛根素+PMA组、H-R+葛根素+anti-miR-con组和 H-R+葛根素+anti-miR-7 组中 NF-κB p65 表达量均差异无统计学意义(P1=0.729,P2=0.943)。

表6 葛根素调控miR-7表达影响小鼠肝细胞缺氧-复氧(H-R)核因子-κB(NF-κB)信号通路/xˉ± s
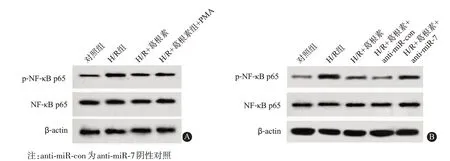
图5 蛋白质印迹法检测葛根素调控miR-7表达影响小鼠肝细胞缺氧-复氧(H-R)核因子-κB(NF-κB)信号通路:A为葛根素、激活剂佛波酯(PMA)对小鼠肝细胞NF-κB信号通路的影响;B为葛根素调控miR-7表达影响小鼠肝细胞NF-κB信号通路
3 讨论
葛根素是一种异黄酮类衍生物[8],具有抗氧化、降血糖、抗炎、抗凝血、抗肿瘤、改善微循环等活性[9-10],在糖尿病、神经系统疾病、骨质疏松症、高血压和心血管疾病[11-14]中拥有广泛的应用价值。资料显示,在IR 损伤方面,葛根素表现出显著的保护作用[15-16],葛根素注射液可以显著抑制大鼠肝脏IR损伤的肝细胞凋亡,从而实现保护作用[5]。本研究同样发现葛根素可以减轻小鼠肝细胞IR 损伤。不同浓度葛根素组作用于H-R损伤的小鼠肝细胞,细胞活性、Ki-67 蛋白表达显著增加(P<0.05)。使用280 μmol/L 葛根素预处理后,H-R 损伤的小鼠肝细胞凋亡率和Bax蛋白表达量明显减少(P<0.05),Bcl-2 蛋白水平明显升高(P<0.05)。证实葛根素可以减轻小鼠肝细胞IR损伤,促进细胞增殖并抑制细胞凋亡,这与前人研究[17]结果一致。
miR-7 作为肿瘤抑制因子,可以减少肿瘤细胞增殖,并诱导细胞凋亡,如肝细胞癌,非小细胞肺癌和胃癌[18-20]。miR-7 还参与 IR 损伤,在心肌细胞H-R模型中,miR-7能够抑制心肌细胞凋亡,干扰其表达则发挥相反的作用[21]。miR-7可以在一定程度上保护脑IR损伤,机制与调控PI3K/Akt信号通路活性,调控下游Bcl-2和Bax表达有关[22]。miR-7a/b对IR 损伤敏感,并通过在体内和体外负调节聚(ADP-核糖)聚合酶表达来保护心肌细胞免受IR 诱导的细胞凋亡[23]。为探究葛根素保护小鼠肝细胞IR损伤的分子机制,本实验用不同浓度葛根素预处理H-R 损伤的小鼠肝细胞,结果显示,葛根素预处理后,H-R损伤小鼠肝细胞中的miR-7表达上调;在H-R 损伤小鼠肝细胞中,miR-7 表达显著下调(P<0.05);干扰miR-7表达部分逆转葛根素对小鼠肝细胞H-R损伤后细胞凋亡的抑制作用,这与Geng等[24]对姜黄素通过上调miR-7a/b 表达来保护缺氧诱导的心肌细胞免受细胞凋亡的研究结果相符。此外,本实验还发现过表达miR-7显著增强H-R损伤小鼠肝细胞活性,降低细胞凋亡率,提升Ki-67、Bcl-2 蛋白水平而减少Bax蛋白表达量(P<0.05);干扰miR-7表达部分逆转葛根素对小鼠肝细胞H-R损伤后细胞活性和Bcl-2蛋白水平的促进作用,以及对Bax蛋白表达的抑制作用。上述结果表明,miR-7 是葛根素保护小鼠肝细胞H-R损伤的重要调控因子。
NF-κB 主要包括 p65、RelB、c-Rel、p50 和 p52等,可以调节免疫、炎症、细胞生存和增殖等相关基因。NF-κB 密切参与细胞凋亡,在不同类型的细胞和不同刺激中发挥着促凋亡和抗凋亡作用[25]。多项研究表明心肌细胞中NF-kB p65 活化是促凋亡的[26]。研究表明,葛根素通过显著降低大鼠IR损伤后肝脏组织中NF-κB 蛋白和mRNA 表达,保护大鼠肝脏 IR 损伤[27]。唐东等[28]报道指出,在大鼠肝脏IR损伤处理中,NF-κB p65表达量显著增加;使用葛根素预处理会明显降低NF-κB p65 蛋白水平,与本研究结果相同。同时,使用NF-κB信号通路激活剂PMA 处理后,明显提高H-R+葛根素组p-NF-κB p65蛋白表达。干扰miR-7表达部分逆转葛根素对小鼠肝细胞H-R损伤后NF-κB p65表达的抑制作用。提示NF-κB信号通路是葛根素减轻肝细胞H-R损伤的重要途径之一,葛根素可能通过调控miR-7 表达抑制NF-κB信号通路活性,从而发挥对肝细胞H-R 损伤的保护作用。
总之,葛根素能够促进H-R 损伤的小鼠肝细胞增殖,并抑制细胞凋亡,其作用机制与调控miR-7表达,抑制NF-κB 信号通路活性有关,这将为治疗肝IR损伤提供新思路。
(本文图2见插图9-3)
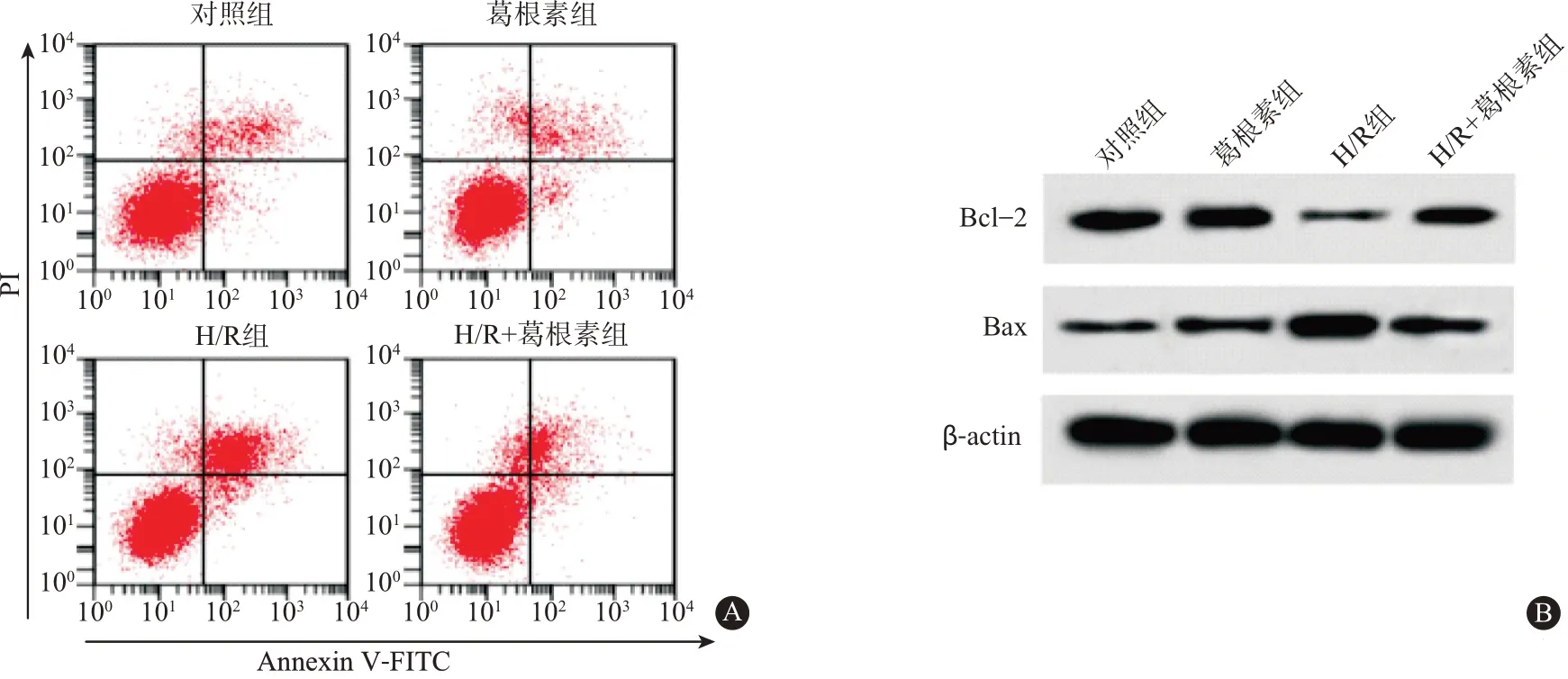
图2 葛根素对小鼠肝细胞缺氧复氧后细胞凋亡的影响:A为流式细胞仪检测细胞凋亡图;B为葛根素对小鼠肝细胞缺氧复氧后小鼠肝细胞B细胞淋巴瘤/白血病-2(Bcl-2)和Bcl-2相关X蛋白(Bax)蛋白表达的影响
