卵泡液全氟化合物的UHPLC-MS/MS测定及其与体外受精结局的关系
2022-03-23蔡芸莹朱秀芳汪瑞琪
王 敏,蔡芸莹,武 泽,朱秀芳,汪瑞琪,苏 恒
(1.云南大学 化学科学与工程学院,云南 昆明 650091;2.云南省第一人民医院内分泌科,云南 昆明 650032;3.云南省第一人民医院生殖医学科,云南 昆明 650032;4.昆明理工大学附属医院,云南 昆明 650032)
0 引 言
全氟化合物(Perfluorinated Compounds,PFCs)是一类具有独特表面活性剂性质的合成含氟化合物,可作为疏水疏油剂,其结构是烷烃分子链上的氟原子取代氢原子.由于碳氟键是化学稳定性最强的键,因此PFCs具有高度耐化学和热降解的特性,可长期稳定存在于自然环境中.自20世纪50年代以来,含氟有机物广泛用于纸张、服装、地毯、食品包装材料和厨房用具的生产[1].PFCs是具有高度生物蓄积性的环境污染物,进入人体的主要途径包括受污染的空气颗粒、饮食和水[2-3].动物研究表明,全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)对肝脏、免疫系统、发育和生殖都具有毒性作用[4-6].PFCs作为重要的内分泌干扰物,可对女性卵巢激素水平[7-9]及卵母细胞受精能力[10]产生不良影响, 与女性不孕不育之间存在密切关系.
液相色谱-串联质谱(Tandem Massspectrometry, MS-MS)联用技术具有样品需要量少、高灵敏度、高精确度、高分辨率鉴定和量化目标分析物等突出优势,能有效地解决生物样本中痕量组份同时检测及确证等难点问题,近年来已被广泛应用于人体血浆[11]、血清[12]、脐带血[13-14]等痕量PFCs的高通量检测.离线或在线固相萃取(SPE)法是目前比较主流的人体体液样品前处理方法,具有基质效应较低及信号强度较高等优势[15-16],但不足之处在于样品需经过柱子预处理,包括上样、淋洗、洗脱、蒸发和复溶等较为繁琐的步骤,在不使用自动固相萃取装置处理样品时不太适合高通量分析.近年来有研究通过蛋白沉淀技术预处理血清后采用超高效液相色谱(UHPLC)结合质谱(MS)法对PFCs进行快速色谱分离,在提高信噪比(S/N)的同时兼顾了分离效率,取得较好效果[13].
卵泡液(Follicular Fluid, FF)由颗粒细胞和卵泡膜细胞分泌的因子以及血浆渗透液组成,在卵母细胞的发育成熟中发挥重要作用,理论上FF中的PFCs与女性生育力的关系应该较血清更为紧密.由于人的FF获取难度较大,加之FF内的PFCs浓度可能比血清中更为微量,目前探讨卵泡液中PFCs水平的研究尚不多见.
本研究采用蛋白沉淀预处理FF样品,通过优化高效液相色谱/串联质谱法液相色谱流动相条件,在有效提高长链全氟化合物检测灵敏度的同时也兼顾了短链全氟化合物的检测灵敏度, 建立了一种可同时测定卵泡液中C4~C11的8种PFCs的分析方法.本方法具有快速、准确、灵敏度和回收率高的优势.通过此方法对104例接受体外受精不孕妇女卵泡液样本中的PFCs水平进行定量分析,评估其与辅助生殖结局的关系.
1 实验部分
1.1 仪器与试剂
EXIONLC System超高效液相色谱仪、SCIEX 6500 QTRAP+质谱仪(美国SCIEX公司);Heraeus Fresco17离心机(美国Thermo Fisher Scientific);PS-60AL超声仪(深圳市雷德邦电子有限公司);BSA124S-CW电子天平(德国Sartorius公司);氮吹仪(上海梓桂仪器有限公司).
全氟辛酸(PFOA,purity≥98%,CAS No.335-67-1)、全氟己烷磺酸钾(PFHxS, purity≥98%,CAS No.3871-99-6)、全氟癸酸(PFDA, purity≥98%,CAS No.335-76-2)、全氟庚酸(PFHpA, purity≥99%, CAS No.375-85-9)、全氟丁酸(PFBA,purity≥99%,CAS No.375-22-4)乙酸铵(99%,CAS No.631-61-8)均购自美国Sigma-Aldrich公司;全氟辛基磺酸(PFOS, 99.1%,CAS No.1763-23-1)、全氟壬酸(PFNA, 98.5%,CAS No.375-95-1)、全氟十一酸(PFUA, 99.2%,CAS No.2058-94-8)购自德国DR EHRENSTORFER公司;13C4-PFOA(50 μg/mL,CAS No.960315-48-4)和13C4-PFOS(50 μg/mL,CAS No.960315-53-1)购自加拿大Wellington Laboratories;甲醇(≥99.9%,CAS No.67-56-1)、乙腈(≥99.9%)购自德国Merk公司.实验用水为经 Milli-Q 纯水仪(美国Millipore公司)制备的超纯水.
1.2 实验方法
1.2.1 卵泡液样品准备和前处理
人卵泡液样品由云南省第一人民医院生殖医学科采集提供.样品收集自2018年至2020年在云南省第一人民医院生殖医学科接受体外受精治疗的104名女性卵泡液样本.研究经云南省第一人民医院伦理委员会批准(批准号2017YY138),所有入组者均签署知情同意书.卵泡液样品采用蛋白沉淀法进行预处理.将装有卵泡液样品的聚丙烯离心管在 4 ℃ 解冻为溶液,涡旋震荡 30 s 混匀.取 150 μL 样品,加入 450 μL 甲醇液.向溶液中加入两个同位素内标(13C4-PFOA、13C4-PFOS)稀释至 10 nmol/L,涡旋 30 s,在冰水浴中超声 20 min 后于 4 ℃ 静置 10 min;样品在 4 ℃ 离心 15 min,12 000 rpm;取上清液 400 μL,氮气吹干;用 100 μL 定容试剂(甲醇∶水=7∶3)复溶,超声 10 min,离心 15 min,12 000 rpm,取上清液待上机分析.
将 10 mmol/L 的储备液混标逐级稀释,配制成含 10 nmol/L 同位素内标的15种0.01~200 nmol/L 校准溶液.实验用玻璃器皿在实验前用甲醇冲洗.
1.2.2 全氟化合物的液相色谱分离条件
色谱柱: ACQUITY UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm, Waters);柱温:40 ℃;自动进样器温度:4 ℃;流动相A为乙酸铵溶液(3 mmol/L,pH=8.5),B相为乙腈.梯度洗脱程序:0~0.5 min,75% A;0.5~2 min,75%~50% A;2~4 min,50%~5% A;4~5 min,5% A;5~5.1 min,5%~75% A;5.1~8 min,75% A.进样体积为 5 μL.
1.2.3 全氟化合物的质谱检测条件
IonDrive Turbo V电喷雾离子源(ESI);负离子多反应监测(MRM)模式;喷雾电压(ISV):-4 500 V;离子化温度(TEM):400 ℃;气帘气(CUR):30 PSI(1 PSI=6.89 kPa);喷雾气(GS1):45 PSI;辅助加热气(GS2):45 PSI.
1.2.4 临床妊娠判断
临床妊娠定义为:接受体外受精,胚胎移植后28天B超可见子宫内孕囊、胚芽及胎心搏动.
1.2.5 数据处理
所有质谱数据采集及目标化合物定量分析工作,均通过SCIEX Analyst Work Station Software(Version 1.6.3)和Sciex OS-Q software完成.采用SPSS 16.0软件进行独立样本的非参数检验(Mann-Whitney U秩和检验)统计学分析,P<0.05 表明差异有统计学意义.
2 结果与讨论
2.1 色谱分离条件优化
PFCs是具有一定表面活性和极性的有机化合物, 有研究报道,采用较低硅羟基活性填料的C18反相柱可以实现这类化合物的分离[17].本研究比较了Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)和Thermo Hypersil GOLDTMC18(100 mm×2.1 mm,1.9 μm)两种色谱柱对目标化合物的分离效果和峰形,结果表明,8种全氟化合物在Waters ACQUITY UPLC BEH C18柱上峰形尖锐,峰的对称度和响应更好.因此本文选用Waters ACQUITY UPLC BEH C18(100 mm × 2.1 mm, 1.7 μm)色谱柱.
我们分别考察了乙腈-0.1%甲酸溶液、乙腈-1 mmol/L 乙酸铵溶液、乙腈-3mmol/L 乙酸铵溶液体系对8种PFCs 响应强度及分离效果的差异,发现C4~C8短链PFCs和中链PFCs在乙腈-0.1%甲酸溶液体系中的信号响应强度更好,而长链PFCs,如全氟壬酸、全氟癸酸和全氟十一酸的色谱峰响应不强.之后我们将 3 mmol/L 乙酸铵用氨水调至pH 8.5,发现长链PFCs色谱峰响应效果明显改善,同时短链和中链PFCs的响应强度和分离效果也得到较好的保证.综合考虑7个全氟化合物的信号响应强度,本研究选择 3 mmol/L、pH 8.5的乙酸铵溶液作流动相.
2.2 质谱条件优化
使用针泵进样直接注入质谱仪,分别将母离子在ESI +和ESI-两种模式下进行全扫描,结果显示ESI-模式下8种待测物和2种同位素内标的离子信号稳定、响应高,因此选择ESI-扫描模式.在电喷雾负离子模式MRM多反应监测模式下优化各项质谱参数,使目标分析物离子的信号达到最佳.确定PFCs以及内标的母离子, 根据离子对的丰度确定碰撞电压(CE).优化后的质谱参数见表1.
2.3 本底水平、线性范围、检出限和定量限
控制本底污染是PFCs检测方法质量保证和控制的关键,本方法考察了测试程序中空白试剂目标分析物的本底水平.结果显示,空白溶剂中检出PFOA背底,浓度小于 0.008 ng/mL(见图1).污染源可能来自色谱系统的聚四氟乙烯和全氟烷氧基化合物.
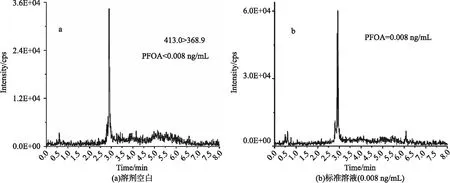
图1 全氟辛酸浓度
在优化条件下,我们考察了方法的检出限、定量限和线性范围.检出限和定量限为全氟化合物信噪比(S/N)3和10时对应的浓度.以目标分析物浓度对定量内标浓度之比为横坐标,以目标分析物与内标峰面积之比为纵坐标,绘制工作曲线.如表2所示,PFBA、PFHpA、PFHxS、PFNA、PFOS、PFNA和PFUA共7种目标物的检出限(LOD)在 0.002~0.004 ng/mL 之间,定量限(LOQ)在0.005~0.011 ng/mL 之间.因存在空白背底,PFOA的LOD和LOQ均高于这7个PFCs,分别为 0.008 ng/mL(LOD)和 0.017 ng/mL(LOQ).线性相关系数≥0.992 3.本方法可同时测定卵泡液基质中8种从短链到长链PFCs,灵敏度高、线性范围宽, 能够满足卵泡液中痕量PFCs的准确定量需要.
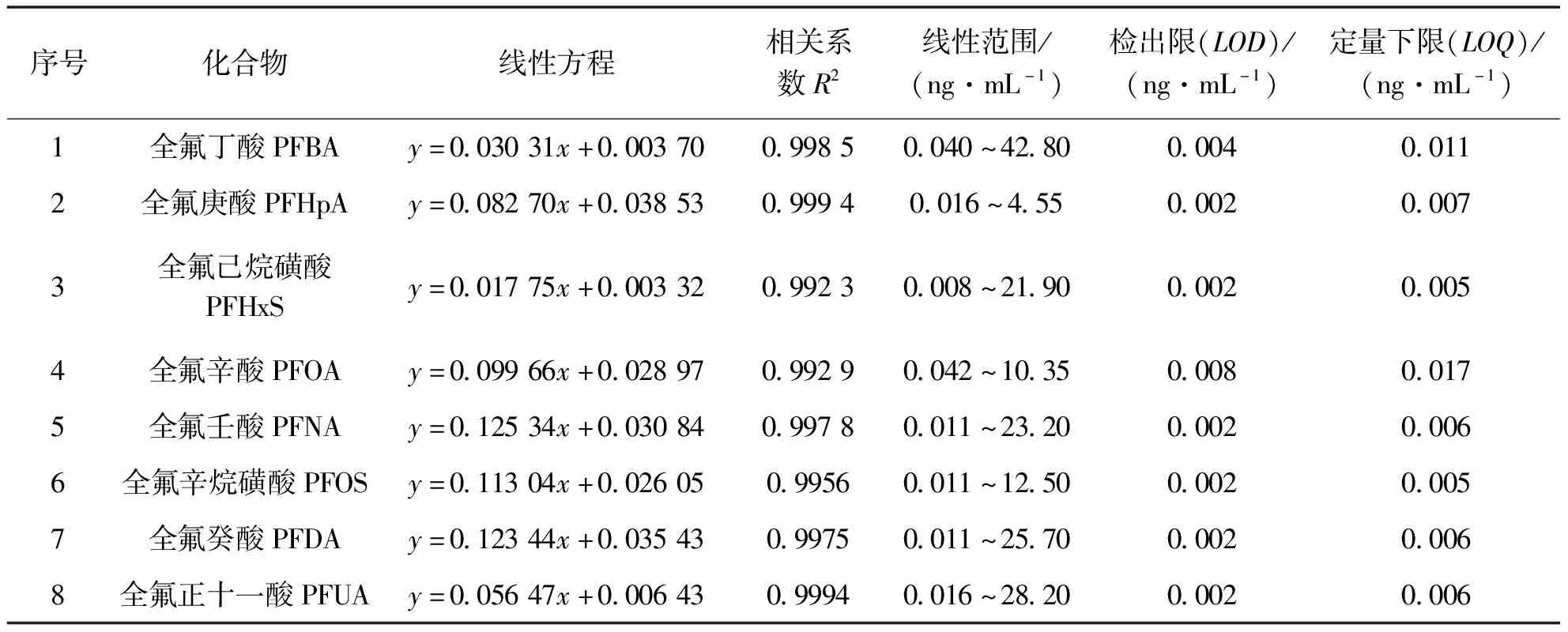
表2 目标分析物的线性方程、相关系数、线性范围、检测限和定量限
2.4 回收率、基质效应和精密度
为保证方法的可靠性,我们考察了精密度、基质效应和加标回收率.制备2种浓度的样品(2 nmol/L、6 nmol/L)在日内、日间重复做5次分析,计算日内和日间精密度,结果见表3.基质效应(Matrix Effect,ME)通过计算卵泡液中 10 nmol/L 同位素内标MPFOA和MPFOS的响应值与甲醇溶液中 10 nmol/L 同位素内标MPFOA和MPFOS响应值的比值得到.卵泡液中加入目标分析物的2个浓度水平(5 nmol/L、定量上限),重复测定3次计算加标回收率,结果见表4.目标分析物的日内精密度在0.9%~9.2%之间,日间精密度在3.3%~14.1%之间.ME%(MPFOA)=93%,ME%(MPFOS)=80%.检测结果未观察到严重的基质抑制效应.卵泡液中8种全氟化合物的加标回收率为85.9%~138.8%,精密度在4.1%~21.1%之间.上述结果表明,所建立的蛋白质前处理和液相色谱质谱联用分析方法准确、可靠,符合分析方法的要求.

表3 目标分析物的精密度
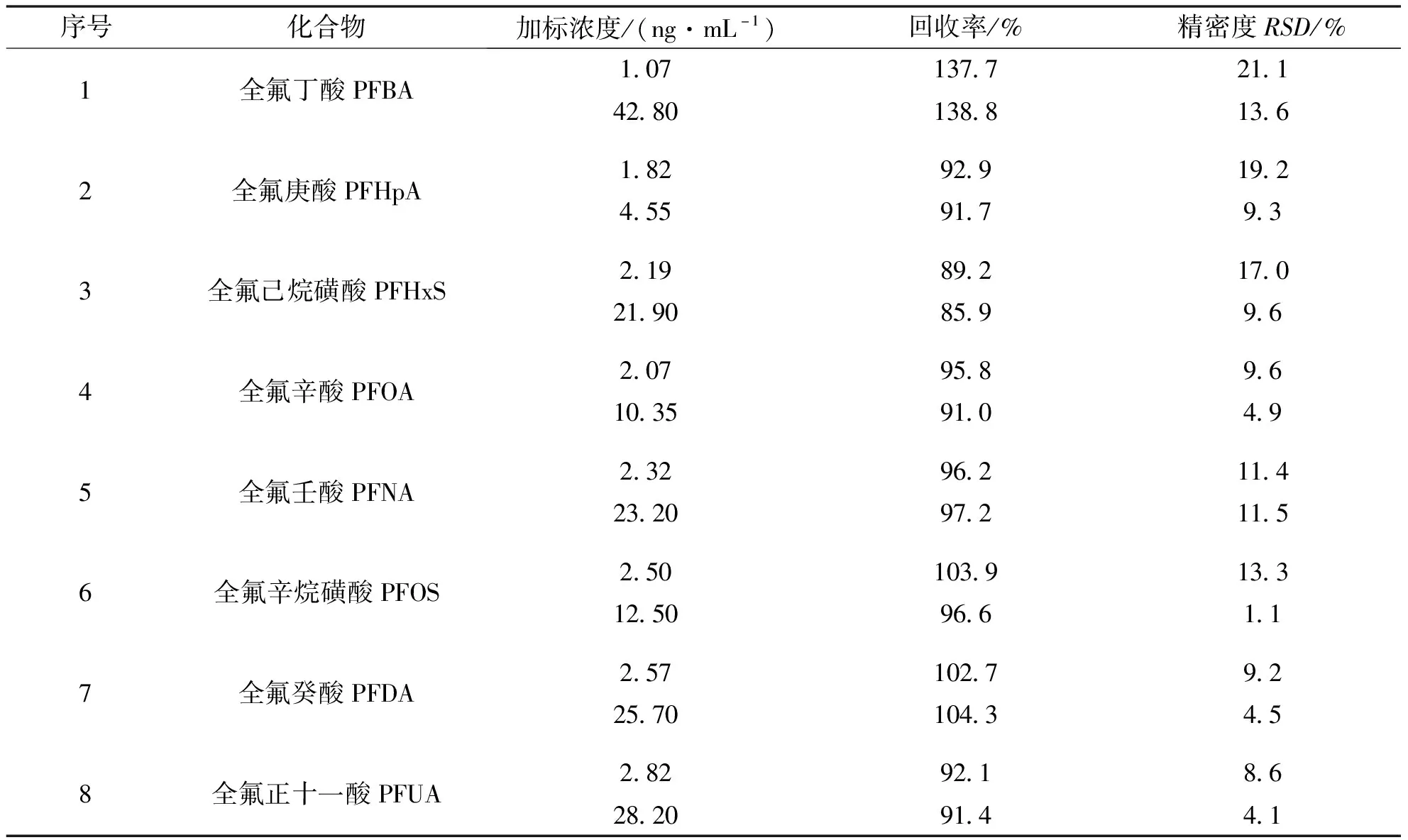
表4 卵泡液中目标分析物的加标回收率和相对标准偏差
2.5 实际样品分析
我们采用优化的液相色谱质谱条件对云南地区104例体外受精患者的卵泡液做分析,检测结果显示,卵泡液中8种PFCS的检出率均为100%(见图2).卵泡液中8种PFCs见表5.PFCs浓度(几何均值GM)较高的是PFBA(5.501 ng/mL)、PFOA(1.080 ng/mL)和PFOS(0.856 ng/mL),其次是PFHpA(0.841 ng/mL)、PFNA(0.526 ng/mL)、PFUA(0.270 ng/mL)和PFDA(0.227 ng/mL),含量最低的是PFHxS(0.050 ng/mL).在以往的报道中,59例英国妇女卵泡液中检出PFOS(GM:2.0 ng/mL)、PFOA(GM:1.82 ng/mL)、PFHxS(GM:0.88 ng/mL)和PFNA(GM:0.41 ng/mL)[18],但因检出限(LOD)水平高,英国未检出PFBA、PFDA和PFUA.本研究发现,云南地区卵泡液中PFOS和PFOA浓度低于英国[PFOS(GM:2.0 ng/mL)、PFOA(GM:1.82 ng/mL)]和北京[PFOS(GM:4.82 ng/mL)和PFOA(GM:4.6 ng/mL)][19].本研究中,云南地区的PFNA、PFDA和PFUA浓度与北京报道近似,但PFHpA水平(GM:0.841 ng/mL)远高于北京(0.012 ng/mL).与英国和北京的报道不同,本研究在FF中检出了PFBA.

图2 卵泡液中8个全氟化合物和2个同位素内标的提取离子色谱图

表5 卵泡液中8种全氟化合物的检测结果(ng/mL,n=104)
2.6 卵泡液PFCs与体外受精结局的关系
本研究按累计妊娠情况将患者分为妊娠组(n=46)和未妊娠组(n=58),比较两组间IVF指标和卵泡液PFCs水平的差异.结果表明,与未妊娠组相比,妊娠组窦卵泡数[4(3,6)vs 3(2,5),P=0.015]、MII卵数[0(0,1)vs 1(0,2),P=0.034]和受精率[71.4% vs 54%.1,P=0.018]均显著高于未妊娠组.此外,与妊娠组相比,未妊娠组卵泡液中PFOA[1.15(0.90,1.53)ng/mL vs 0.98(0.82,1.21)ng/mL,P=0.034];PFNA[0.58(0.47,0.78)vs 0.46(0.38,0.67)ng/mL,P=0.007];PFHxS[0.05(0.04,0.08)vs 0.04(0.03,0.06)ng/mL,P=0.034]水平显著增高(见表6).
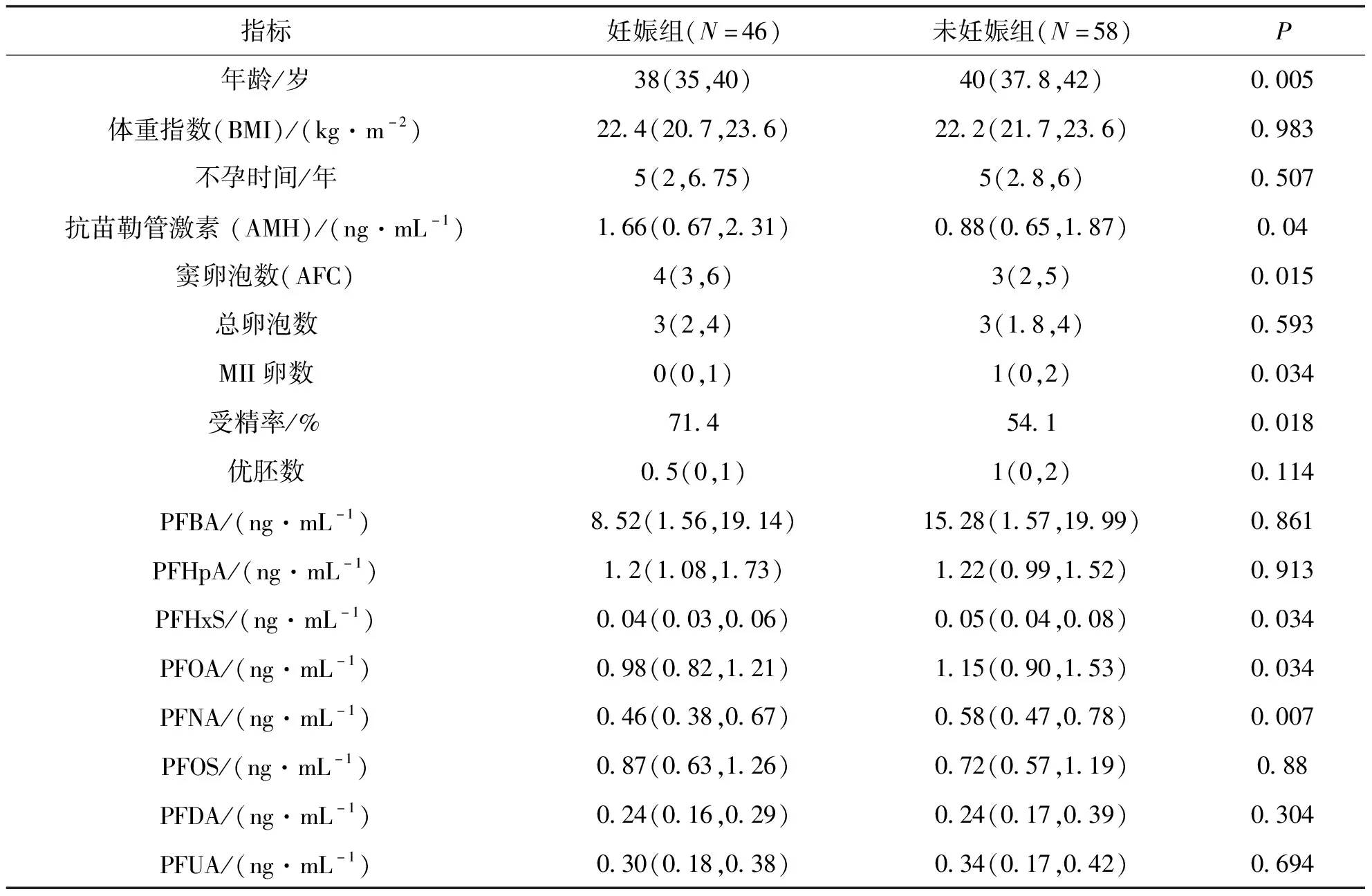
表6 体外受精后累计妊娠与未妊娠组临床指标和卵泡液PFCs水平
多项研究显示,不孕妇女体液中的PFCs水平可能与体外授精/单精子胞浆内注射-胚胎移植(IVF/ICSI-ET)结局有关.Fei等[11]对怀孕4~14周的丹麦妇女的研究表明,血浆全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)水平较高的妇女生育率低下的发生率较高.Velez等[20]在环境化学物质对母婴影响研究项目(MIREC)也发现,血清中PFOA和PFHxS每增加一个标准差,受孕率降低约10%.国内Zhang等[21]对173例子宫内膜异位症不孕妇女的研究发现,血浆中全氟丁烷磺酸(PFBS)水平与患子宫内膜异位症的不孕症的风险增加相关.此外,有研究显示,PFOA及PFOS是卵泡液中含量最高的全氟化合物,卵泡液中PFCs的暴露与体外受精的受精率及获卵数之间有相关性[22].我们将卵泡液中的PFCs进行三等分,与PFBA水平最低的三分位组相比,水平最高三分位组的妇女窦卵泡数、总卵泡数、MII卵数显著降低;与PFHxS水平最低的三分位组相比,水平最高三分位组的妇女总卵泡数和MII卵数显著增高;与PFOS水平最低的三分位组相比,水平最高三分位组的妇女总卵泡数显著增高(见表7).但我们的研究没有发现PFCs与优胚数有关.
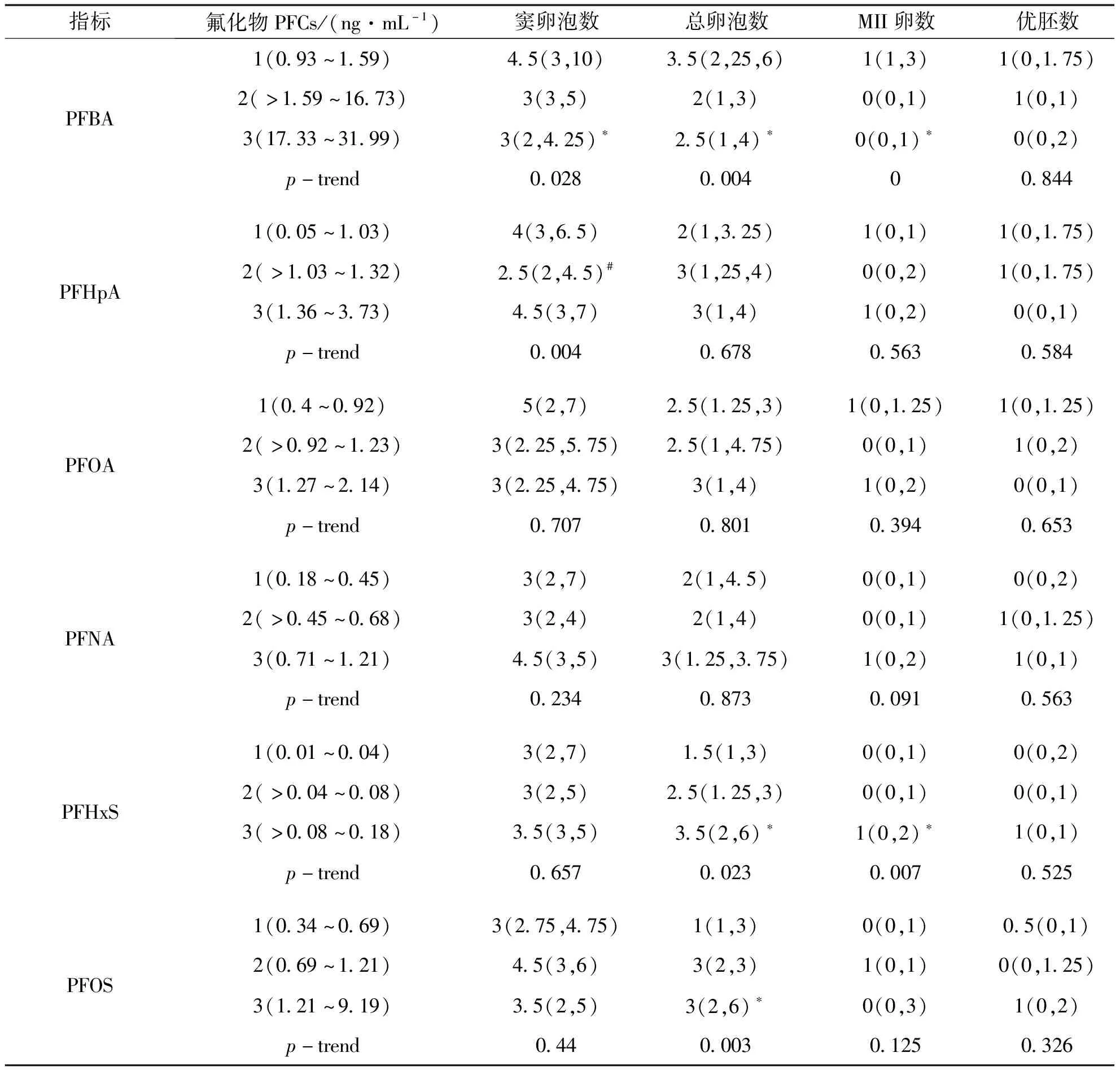
表7 卵泡液PFCs暴露水平与IVF指标的关系
3 结 论
基于超高效液相色谱/质谱联用技术,采用蛋白质沉淀预处理技术建立了在人卵泡液中测量8种微量全氟化合物的方法.本方法具有灵敏度高、操作简便、准确的优点,能够满足人卵泡液中全氟化合物的定性和定量要求,为不孕不育患者的诊断并进行生殖辅助治疗提供了重要的技术支持.研究发现,体外受精后临床妊娠组与未妊娠组相比,卵泡液中PFCs水平存在差异.此外,卵泡液中PFCs与IVF指标,窦卵泡数、总卵泡数和MII卵数有关.这些结果提示卵泡液中PFCs可能对卵母细胞发育存在影响,但不同种类的PFCs的生殖影响可能存在差异.今后的研究还需加大样本量,深入探究全氟化合物对女性生殖的影响及机制.
