仁青常觉对家兔急性呼吸窘迫综合征的保护作用研究*
2022-03-23姚梦琪付淑艳周自强更桑色里玛白玛罗布孙芳云
姚梦琪,付淑艳,周自强,更桑,色里玛,白玛罗布,孙芳云,
1 西藏民族大学医学部 藏药检测技术教育部工程研究中心 陕西咸阳 712082
2 西藏藏医药大学 西藏拉萨 850000
3 西藏甘露藏药股份有限公司 西藏拉萨 851414
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS )是指由于肺组织内外严重疾病导致的顽固性低氧血症,可引起弥漫性肺泡毛细血管损伤,肺毛细血管通透性增加而导致高通透性肺水肿。ARDS的临床症状为发热﹑咳嗽﹑咳痰等,其中严重的症状是呼吸困难,因为病情进展快,从而导致肺功能不全,患者会在短时间内出现呼吸衰竭等严重症状,病死率高达50%[1]。Matthay等[2]认为 ARDS 其实是弥漫性肺泡毛细血管损伤,肺毛细血管通透性增加所导致的高通透性肺水肿.目前西医治疗ARDS的主要方式是辅助性机械通气﹑控制体液的交换以及抗感染等,但是其临床死亡率仍然居高不下。药物使用较多的是糖皮质类激素等药物,虽有一定的疗效,但副作用多,达不到预期的效果。
仁青常觉是珍贵的藏族验方[3],2015年收录于《中华人民共和国药典》,由珍珠﹑朱砂﹑檀香﹑降香﹑诃子﹑牛黄﹑麝香﹑西红花等160多味药材炮制而成的丸剂[4],成分中珍珠﹑朱砂﹑牛黄等清热解毒,抑制病毒;檀香﹑沉香﹑降香等健脾化湿,理气健运;诃子涩肠止泻;麝香﹑西红花等凉血活血,化瘀消癓[5],特别是诃子为最常用藏药,主要含单宁及多元酚类﹑三萜类﹑黄酮类等化学成分,这些成分具有抗菌﹑ 抗氧化﹑抗炎 ﹑抗过敏﹑降压﹑清除自由基﹑抗衰老等作用。西藏自治区新型冠状病毒藏医药防治方案中建议:预防﹑发病﹑治愈后期和康复期都可服用仁青常觉。目前仁青常觉在临床上多用于治疗陈旧性胃肠炎﹑溃疡﹑萎缩性胃炎等症状,但未见在急性呼吸窘迫综合征方面的现代药理学研究报导。本研究通过 LPS 复制家兔 ARDS模型,观察仁青常觉疗效并初步探索其作用机制。
材料与方法
1 动物分组及模型制备
健康雄性新西兰大白兔36只,体重(2.00±0.2)kg,由成都达硕生物科技有限公司提供;内毒素(LPS)由北京博奥拓达科技有限公司提供,批号:12181202L2630;地塞米松由上海源叶生物科技有限公司提供,批号:S28D10B107184;仁青常觉由西藏甘露藏药股份有限公司提供,批号:200400302。
实验动物随机分为六组:正常组,模型组,地塞米松组(3mg·L-1),仁青常觉高中低剂量组(150mg·L-1﹑50mg·L-1﹑17mg·L-1),每组各6只。正常组 及模型组每天灌胃动物饮用水,其它四组灌胃对应药物,连续灌胃五天。实验前12h禁食﹑禁水,20%乌拉坦(5ml·kg-1)耳缘静脉注射麻醉,分离颈动脉做动脉插管连接生理监测仪,分离气管插入导管;分别记录0h﹑0.5h﹑1h﹑2h﹑4h时动脉压,呼吸频率,肛温和采血进行动脉血气分析。除正常组外,其余各组耳缘静脉缓慢推注 LPS(750ug·kg-1),复制ARDS模型。
2 样本采集及指标检测
在相应时间点从兔颈内动脉采集动脉血,检测其动脉血氧分压(PaO2)并计算氧合指数(PaO2/FiO2),在4h结束后放血处死实验动物,快速取出肺组织,分离左下肺叶并称取湿重,用滤纸吸去左肺表面水分及血液后置于烘干箱内(80 ℃ 48h)烘干后称量干重,计算肺湿重/干重(W/D)比值。右下肺叶经过4%多聚甲醛固定后脱水﹑透明﹑石蜡包埋﹑切片,免疫组化测定备用。其余肺组织取出后立即冻存-80 ℃冰箱待测 TNF-α﹑IL-1β﹑IL-6﹑IL-8﹑SOD及MDA,测定时用组织匀浆器用预冷生理盐水制成体积分数为10%的肺组织匀浆。
3 统计学方法
采用 spss 23.0统计分析软件进行数据处理。计量数据以均数±标准差(±s)表示,组间数据比较采用单因素 ANOVA 分析法,以P<0.05表示差异有统计学意义。
结 果
1 肺湿干重比值(W/D)
模型组与正常组相比,肺湿干重比值有明显上升(P<0.01);地塞米松组﹑高剂量组﹑中剂量组与模型组相比,肺湿干重降低(P<0.05);低剂量组与模型组相比较,不具有统计学意义(P>0.05)。结果表明:仁青常觉能抑制由LPS引发的肺水肿(见图1)。
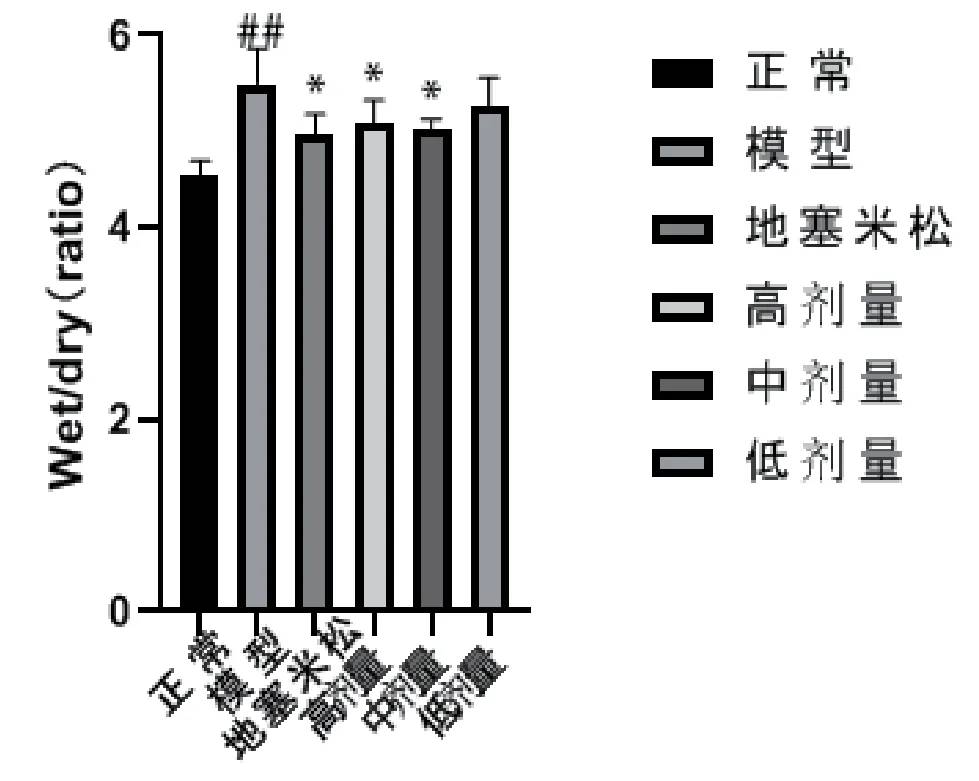
图1 6组兔肺 W/D 比值比较
2 不同时间点兔血动脉血氧分压和氧合指数结果
2.1 动脉血氧分压(PaO2)结果 耳缘静脉注射 LPS前,6 组家兔 PaO2无明显差异(P>0.05)。在注射 LPS后,正常组在实验过程中 PaO2保持相对稳定。模型组在 0.5h 时 PaO2降至最低为 566.74mmHg,明显低于正常组(P<0.01),随后逐渐开始呈上升趋势,但一直处于较低水平。地塞米松组﹑高剂量组﹑中剂量组与模型组相比在给药后同样呈下降趋势,其结果介于正常组与模型组之间(P<0.05);低剂量组与模型组相比较,不具有统计学意义(P>0.05)。见表1。
表1 6组兔不同时间 PaO2 变化情况(±s) mmHg
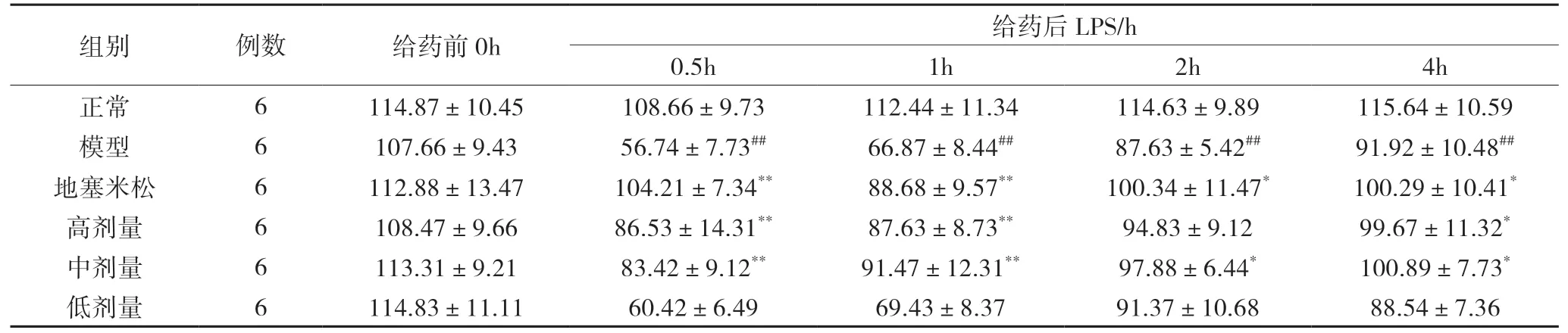
表1 6组兔不同时间 PaO2 变化情况(±s) mmHg
模型组与正常组相比##P<0.01,#P<0.05;给药组与模型组相比**P<0.01,*P<0.05。
?
2.2 动脉血氧合指数(Pa02/Fi02)的结果 耳缘静脉注射 LPS 前,6 组家兔 Pa02/Fi02 无明显差异(P>0.05)。在注射 LPS 后,正常组在实验过程中保持相对稳定。模型组 Pa02/Fi02 明显下降(P<0.01),0.5h 降至最低,均数为243.11(<300,符合 ARDS轻度标准),之后开始上升;地塞米松组﹑高剂量组﹑中剂量组 PaO2/FiO2给药后 0.5h 至 1.0h 稍有下降但其下降趋势小于模型组,与模型组比较有明显差异(P<0.05);低剂量组与模型组相比较,不具有统计学意义(P>0.05)。见表2。
表2 6组兔不同时间 PaO2/FiO2 变化结果(±s) mmHg
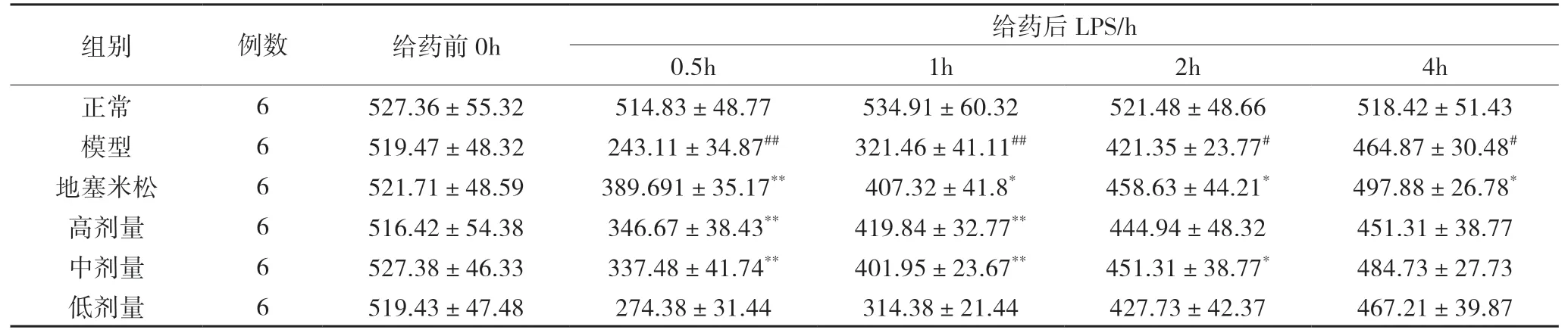
表2 6组兔不同时间 PaO2/FiO2 变化结果(±s) mmHg
模型组与正常组相比##P<0.01,#P<0.05;给药组与模型组相比**P<0.01,*P<0.05。
?
3 临床指征(血压﹑呼吸及体温)变化
3.1 血压(BP)变化 6组家兔在实验前基础血压无明显差异(P>0.05)。正常组在整个实验过程中血压
变化不明显,基本稳定。模型组在静注 LPS 后,血压明显下降(P<0.05),之后一直处于较低水平;给药组血压在给药后同样呈下降趋势,其数值介于正常组与模型组之间(P<0.05)。见表3。
表3 6组兔不同时间BP的变化(±s) mmHg
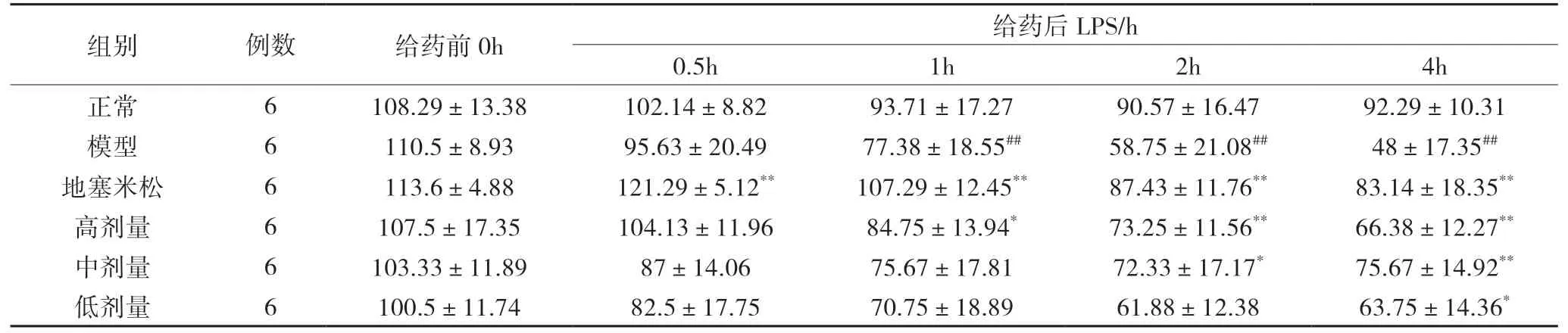
表3 6组兔不同时间BP的变化(±s) mmHg
模型组与正常组相比##P<0.01;给药组与模型组相比**P<0.01,*P<0.05。
?
3.2 呼吸(RR)变化 实验前各组动物之间呼吸频率无明显差异(P>0.05)。整个实验过程中,正常组动物呼吸频率变化较平稳。模型组动物在静注 LPS 后呼吸频率明显增快(P<0.01),达到高峰值68.75,然后缓慢下降。给药组动物呼吸频率的变化介于正常组及模型组之间(P<0.05)。见表4。
表4 6组兔不同时间RR变化(±s) times/min
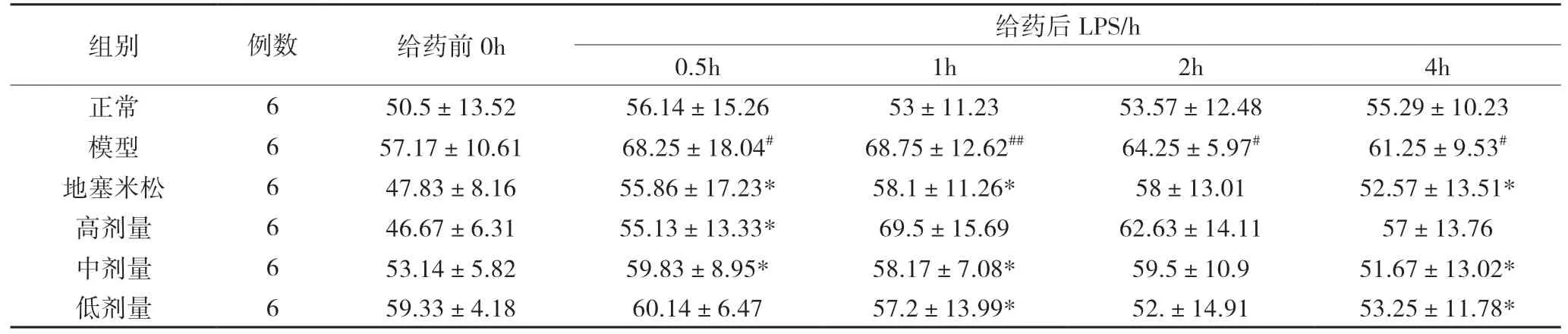
表4 6组兔不同时间RR变化(±s) times/min
模型组与正常组相比##P<0.01,#P<0.05;给药组与模型组相比**P<0.01,*P<0.05。
?
3.3 体温(T)变化 实验前各组动物之间体温无明显差异(P>0.05)。整个实验过程中,正常组动物体温变化较平稳。模型组动物在静注 LPS 后体温明显增快(P<0.01),达到高峰值39.19,然后缓慢下降。其他组动物体温的变化介于正常组及模型组之间(P<0.05)。见表5。
表5 6组兔不同时间 T 变化(±s) ℃

表5 6组兔不同时间 T 变化(±s) ℃
模型组与正常组相比##P<0.01,#P<0.05;给药组与模型组相比**P<0.01,*P<0.05。
?
4 兔肺细胞因子表达结果
模型组与正常组相比,肺组织中 TNF-a﹑IL-1β﹑IL-6﹑IL-8 显著升高(P<0.05);地塞米松组与模型组相比 TNF-a﹑IL-1β﹑IL-6﹑IL-8 明显降低(P<0.05);高剂量组与模型组相比 TNF-a﹑IL-1β﹑IL-6﹑IL-8明显降低(P<0.05),具有统计学意义;中剂量组与模型组相比 TNF-a﹑IL-1β﹑IL-6 均有不同程度下降(P<0.05);低剂量组与模型组相比 TNF-a﹑IL-1β 有下降趋势(P<0.05)。见图2。
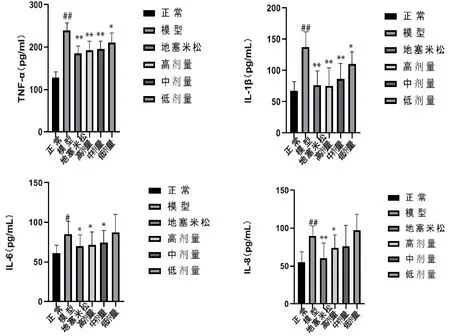
图2 6组兔肺炎症因子表达(pg/mL)
5 兔肺SOD﹑MDA表达
模型组与正常组相比,肺组织中 SOD﹑MDA 显著升高(P<0.05);地塞米松组与模型组相比 SOD﹑MDA 明显降低(P<0.05);高剂量组与模型组相比SOD﹑MDA 明显降低(P<0.05),具有统计学意义;中剂量组与模型组相比 SOD﹑MDA 均有不同程度下降(P<0.05);低剂量组与模型组相比 SOD﹑MDA 不具有统计学意义(P>0.05)。见图3。
图3 6组兔肺SOD﹑MDA表达
讨 论
急性肺损伤(acute lung injury,ALI) 和ARDS这两个概念在1994年欧美 ARDS 共识会议(AECC)中被提出。本次会议中认为 ALI 和 ARDS 是同一疾病发病过程中两个不同阶段,ALI 代表早期发病阶段,而 ARDS 代表后期病情较严重阶段,而且55% 的 ALI会在三天内进一步成为 ARDS。随后《美国医学会杂志》(JAMA) 在2012 年发表的柏林定义中决定取消ALI 的命名,将他们统一称为 ARDS[6]。
本研究使用耳缘静脉推注LPS(750ug/kg)的方法复制ARDS模型。注射LPS后,兔呼吸﹑体温均有明显上升,血压呈持续下降趋势,且 Pa02/Fi02明显下降(P<0.01),0.5h 降至最低,均数为243.11(<300,符合 ARDS轻度标准),表明兔ARDS模型成功。
机体在感染 ARDS 后会产生大量的炎症因子与介质,促使炎症细胞在肺组织大量聚集,如中性粒细胞﹑巨噬细胞﹑淋巴细胞等。被炎症反应激活的炎症细胞导致 ARDS 独有的“呼吸爆发(respiratory burst)”,并产生一系列连锁反应,生成大量氧自由基导致血管通透性增加和微血栓[7],促使炎症反应更加严重。在ARDS疾病的发生过程中肿瘤坏死因子-α(TNF—α)﹑白介素-1β(IL-1β)﹑白介素-6(IL-6)﹑白介素-8(IL-8)等促炎症细胞因子起着重要作用[8]。当大量炎症因子和介质产生时会促使炎症细胞在肺组织内聚集,其中就包括巨噬细胞,TNF-α 主要由活化的巨噬细胞产生。
本实验发现仁青常觉可降低 TNF-α﹑IL-1β﹑IL-6﹑IL-8 水平,提高 SOD 活性﹑降低 MDA 水平,说明仁青常觉具有一定抑制炎症因子释放,以及清除自由基﹑抗缺氧的作用,来减轻 ARDS 时对肺脏的损伤。通过本实验也间接验证了仁青常觉新冠肺炎病人急性呼吸窘迫症的保护作用。 但 ALI/ARDS 是由多种致病因素导致的肺功能严重损伤,并且发病速度快﹑致死率高,发病机制尚未完全确定,仁青常觉中有效的化学成分不清楚,大多数实验仍然停留在消化系统方面,关于 ARDS 的治疗在临床上未得到推广,仍然需要在此方面更加深入的研究和探讨。
综上所述,仁青常觉对家兔 ARDS 时肺的保护作用可能与抑制炎症因子释放﹑清除自由基﹑抗缺氧有关。
