不同剂量利福昔明联合益生菌治疗腹泻型肠易激 综合征合并小肠细菌过度生长的效果分析
2022-03-22范红云段志英赵亚男杨春春杨明月霍晓辉
范红云 段志英 赵亚男 杨春春 杨明月 张 梅 霍晓辉 白 云 王 竞
肠易激综合征(IBS)为常见的肠道功能紊乱性疾病,以腹痛、腹胀为主要临床表现,并伴有排便频率升高及粪便性状改变。按照粪便特征可将IBS分为未定型(IBS-U)、混合型(IBS-M)、便秘型(IBS-C)和腹泻型(IBS-D),其中IBS-D为中国IBS的主要类型[1]。小肠细菌过度生长(SIBO)是指由于小肠蠕动能力减弱、小肠结构异常等多种原因导致小肠内菌群数量或种类改变。IBS-D患者因肠黏膜屏障功能受损,导致其并发SIBO的概率较高(64%~85%)[2]。IBS-D患者并发SIBO后不仅可导致肠道症状加重,还将对康复造成显著影响。对于IBS-D并发SIBO的患者,临床治疗以调节肠道菌群、改善胃肠动力为主,但疗效并不理想,且停药后容易复发。利福昔明是一种具有较强抗菌活性的广谱抗生素,在消化系统疾病的治疗中应用广泛,研究表明其可有效抑制引起SIBO的常见致病菌,进而有效缓解IBS-D患者的肠道症状[3]。 目前对于利福昔明的合理用药剂量尚存在争议,本研究探讨了不同剂量利福昔明联合益生菌治疗IBS-D合并SIBO的效果,以期为安全有效地治疗IBS-D合并SIBO患者提供参考。
1 资料与方法
1.1 资料
选择河北医科大学第一医院自2017年5月至2019年12月收治的114例IBS-D合并SIBO患者作为研究对象。纳入标准:(1)排除肠道器质性疾病,IBS-D的诊断符合罗马Ⅲ标准[4],且乳果糖氢呼气试验(LHBT)结果为阳性;(2)年龄18~70岁;(3)入组前2周内未曾使用抗生素、肠动力药等影响疗效的药物;(4)知晓研究内容,并签署知情同意书。排除标准:(1)既往有肠道手术史;(2)入组前2周内曾接受灌肠、结肠气钡造影检查;(3)其他疾病(如甲状腺疾病等)导致的肠道功能不良;(4)合并肠梗阻等其他肠道疾病;(5)对本研究中应用的药物过敏;(6)治疗依从性差,不愿意配合调研;(7)有精神疾病。本研究经医院医学伦理委员会审查批准。
将114例患者按照随机数表法分为A组、B组和C组,每组38例。A组中男性17例,女性21例;年龄18~67岁,平均年龄为(42.73±6.49)岁;病程6~31个月,平均病程为(18.58±3.86)个月。B组中男性16例,女22例;年龄19~66岁,平均年龄为(43.21±6.80)岁;病程7~31个月,平均病程为(19.15±3.94)个月。C组中男性15例,女性23例;年龄19~65岁,平均年龄为(42.87±6.64)岁;病程8~30个月,平均病程为(19.34±3.67)个月。3组的基线资料相比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
所有患者均应用马来酸曲美布汀片(购自山西新宝源制药有限公司,生产批号20160203,规格0.1 g)治疗,1片/次,每日3次,连续口服4周;同时应用益生菌治疗,所用益生菌为双歧杆菌三联活菌肠溶胶囊(购自晋城海斯制药有限公司,生产批号20150807,规格210 mg),2粒/次,每日3次,连续口服4周。在此基础上,3组均应用利福昔明片(购自南昌市飞弘药业有限公司,生产批号20161130,规格0.2 g)口服治疗,其中A组予低剂量(0.2 g/次,每日3次),B组予中剂量 (0.4 g/次,每日3次),C组予高剂量(每日早、晚均0.4 g,中午0.8 g)。利福昔明片与马来酸曲美布汀片、双歧杆菌三联活菌肠溶胶囊连续治疗2周后停用,后两种药继续治疗2周。
1.3 观察指标
1.3.1 临床症状体征 参照《中药新药临床研究指导原则》[5],对3组的排便频率、粪便性状、腹痛、腹胀、肠鸣音等临床症状、体征进行量化评估,并计算临床症状体征总积分。量化评估标准:(1)腹痛、腹胀、肠鸣音 无,记为0分;轻微不适,对生活无影响,记为1分;不适症状明显,对生活有一定影响,记为2分;不适症状严重,对生活有极大影响,记为3分;(2)排便频率 频率正常,记为0分;频率小幅升高(2~3次/d),记为1分;频率中幅升高(4~6次/d),记为2分;频率大幅升高(> 6次/d),记为3分;(3)粪便性状 正常,成形便,记为0分;轻微异常,软团状,记为1分;中等异常,稀便,记为2分;重度异常,稀便或水样便,记为3分。上述症状、体征评分之和为临床症状体征总积分。
1.3.2 SIBO转阴率 治疗4周后,复查LHBT,计算3组的SIBO转阴率。
1.3.3 血清炎性细胞因子水平及呼出气一氧化氮体积分数 分别于治疗前、治疗4周后抽取3组患者的晨起空腹静脉血5 mL,离心后分离出血清,保存于-70 ℃冰箱内待测。采用ELISA试剂盒(购自上海劲马生物科技有限公司)检测血清IL-1β、IL-10、IL-18水平,由同一检验科工作人员严格按说明书操作完成。此外,于治疗前、治疗4周时行呼出气一氧化氮(eNO)体积分数检测,采用Nano Coulomb NO分析仪[购自尚沃医疗电子(上海)有限公司]测定。
1.3.4 用药安全性 观察3组患者在治疗期间有无便秘、消化不良等不良反应发生,计算不良反应发生率。
1.4 疗效判定标准
治疗4周后,根据临床症状体征总积分变化对3组的疗效进行判定:(1)显效 临床症状体征总积分较治疗前降低≥80%;(2)有效 临床症状体征总积分较治疗前降低≥50%但<80%;(3)无效 临床症状体征总积分较治疗前降低<50%。显效、有效的比例之和为总有效率。
1.5 统计学方法
应用SPSS 20.0软件处理数据。计量资料经Shapiro-Wilk检验符合正态分布,以均数±标准差(x±s)表示,两组间均数比较采用独立样本t检验,本组治疗前后比较采用配对样本t检验,3组比较采用方差分析。计数资料用例(%)表示,组内比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组的临床疗效比较
3组的临床疗效相比较,C组的总有效率(94.74%)明显高于A组(71.05%)和B组(78.95%),差异均有统计学意义(P均<0.05)。详见表1。

表1 3组的临床疗效比较/例(%)
2.2 3组的临床症状体征总积分比较
3组的各项症状、体征评分详见表3。A、B、C组的治疗前临床症状体征总积分[(10.71±1.76)分,(10.73±1.72)分,(10.97±1.67)分]相比较,差异均无统计学意义(P均>0.05)。A、B、C组的治疗后临床症状体征总积分[(4.23±1.23)分,(3.37±1.08)分,(2.19±0.72)分]均较本组治疗前明显降低(P均<0.05),且C组明显低于A组和B组(P均<0.05)。详见表2。
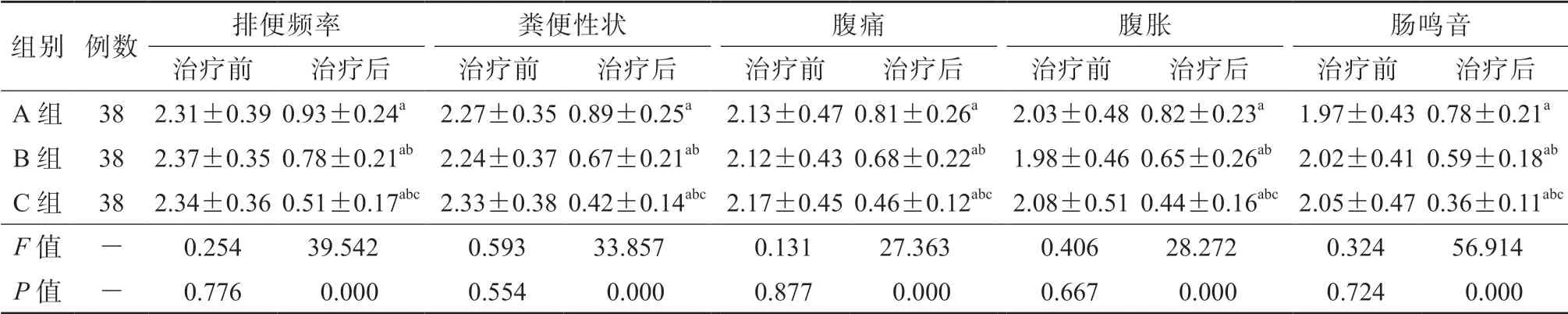
表2 3组的各项症状、体征评分比较 (x±s)/分
2.3 3组的SIBO转阴率比较
治疗4周后,A组的SIBO转阴率为65.79%(25/38),B组的SIBO转阴率为73.68%(28/38),C组的SIBO转阴率为92.11%(35/38)。C组的SIBO转阴率明显高于A组和B组(χ2=7.872,P=0.020)。
2.4 3组的血清炎性细胞因子水平及eNO体积分数比较
3组的治疗前血清IL-1β、IL-10、IL-18水平及eNO体积分数相比较,差异均无统计学意义 (P均>0.05)。3组的治疗后血清IL-1β、IL-18水平及eNO体积分数均较本组治疗前明显降低(P均< 0.05),3组的治疗后血清IL-10水平均较本组治疗前明显升高(P均<0.05)。治疗后C组的血清IL-1β、 IL-18水平及eNO体积分数均明显低于A组和B组(P均<0.05),治疗后C组的血清IL-10水平明显高于A组和B组(P均<0.05)。详见表3。
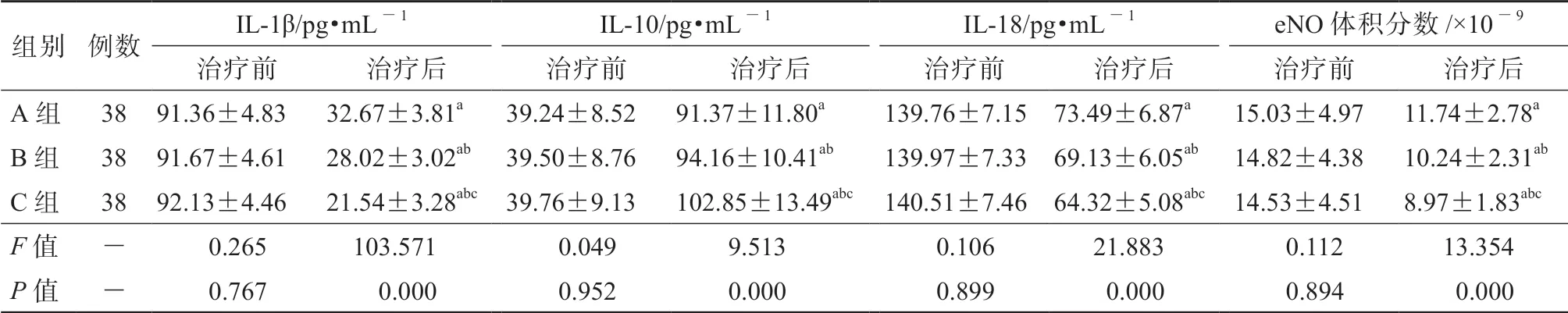
表3 3组的血清炎性细胞因子水平及eNO体积分数比较
2.5 3组的用药安全性比较
治疗期间,A组出现便秘2例,消化不良1例,不良反应发生率为7.89%;B组出现便秘4例,消化不良2例,不良反应发生率为15.79%;C组出现便秘3例,消化不良4例,不良反应发生率为18.42%。3组的不良反应发生率相比较,差异无统计学意义(χ2=1.890,P=0.389)。
3 讨论
IBS-D作为IBS的重要类型,不但发病机制复杂,发病率呈逐年升高趋势,且多合并SIBO,临床治疗较为困难。IBS-D患者出现肠道症状与肠道菌群失调有关,有研究收集IBS-D患者的粪便行微生物学检验,发现IBS-D患者粪便中双歧杆菌、乳杆菌等益生菌数量较健康人明显减少,而拟杆菌、肠球菌数量较健康人明显增多[6]。SIBO是指远端肠道内微生物因各种原因移位至小肠内,导致小肠内微生物数量增多及多样性升高。研究表明IBS-D患者常并发SIBO,且其LHBT阳性率为健康人的4.46倍[7]。肠道益生菌制剂是治疗IBS-D等肠道功能紊乱性疾病的常用药,双歧杆菌三联活菌肠溶胶囊是一种肠道益生菌制剂,其含有双歧杆菌、粪肠球菌和嗜乳酸杆菌这3种活性菌,其作用机制包括:(1)补充消化道优势菌群,纠正肠道菌群比例失衡;(2)可通过占据肠黏膜、与致病菌竞争营养物质等对致病菌生长增殖起到抑制作用[8];(3)可促进营养物质消化、吸收,且益生菌代谢产生的短链脂肪酸除可使肠道形成酸性环境而抑制致病菌生长外,还可修复肠黏膜屏障,阻止病原菌定植、入侵,从而对肠黏膜起到保护作用[9]。此外,双歧杆菌三联活菌肠溶胶囊还可调节肠道免疫功能,有助于增强巨噬细胞的吞噬能力,从而增强机体抵御致病菌感染的能力。目前已有研究证实,益生菌可对IBS-D起到治疗效果,且复合益生菌制剂的疗效较单菌株制剂更好[10]。另有研究发现,单用益生菌治疗IBS-D的疗效有限,患者的SIBO转阴率仅为50%左右[11]。
近年来,随着对IBS-D研究的逐渐深入,发现SIBO参与了IBS-D的发生过程,其机制可能与SIBO加重肠道动力异常、促使肠腔积气等有关,且SIBO发生后,小肠内致病菌可发酵碳水化合物生成大量氢气,导致IBS-D患者的腹痛、腹胀等肠道不适症状加剧[12]。利福昔明是一种非氨基糖苷类肠道抗生素,其不能被消化系统吸收入血,故不易导致系统性毒性反应,安全性较高。利福昔明可通过与RNA多聚酶上的β-亚单位发生作用而使细菌RNA合成过程受阻,导致RNA多聚酶无法与DNA连接,从而阻碍RNA转录,导致蛋白合成中断,起到抑菌作用[13]。由于利福昔明对拟杆菌、粪肠球菌、肠杆菌等厌氧菌具有高度活性,而这些细菌是导致SIBO的病原菌,故利福昔明可对SIBO起到治疗作用[14]。目前,对于利福昔明的有效剂量尚不明确,若用药量不足将无法获得理想疗效,而若用药过量会引起不良反应。本研究对不同剂量利福昔明联合益生菌治疗IBS-D合并SIBO患者的效果进行了探讨,以期为临床用药提供参考。本研究结果显示,与A组(低剂量)、B组(中剂量)相比,C组(高剂量)的总有效率更高;C组的治疗后临床症状体征总积分低于治疗前本组及治疗后A组、B组,这提示益生菌联合高剂量利福昔明的协同治疗作用更强,可使肠道致病菌过度生长得到有效抑制,使肠道菌群及微环境得到有效调节和改善,从而显著改善患者症状,并促使SIBO转阴。
胃肠道炎性反应过程中始终存在促炎、抗炎两方面的作用。研究显示IBS-D患者外周血中促炎与抗炎因子表达失衡,表现为IL-1β、IL-18等促炎因子水平升高,IL-10等抗炎因子水平降低[15]。IL-1β可提高IBS-D患者内脏感受器的敏感度,导致肠功能障碍。IL-10主要由B淋巴细胞、单核巨噬细胞产生,对前炎性细胞因子释放具有抑制作用。IL-18可促使白细胞黏附,导致肠道微血管内皮细胞受损,生成较多氧自由基,从而导致肠道微血管内皮细胞坏死[16]。此外,eNO体积分数可反映IBS-D合并SIBO患者的炎性反应程度,分值越高则炎性反应程度越严重。本研究结果显示,C组的治疗后血清IL-1β、IL-18水平及eNO体积分数均低于治疗前本组及治疗后A组、B组,C组的治疗后血清IL-10水平高于治疗前本组及治疗后A组、B组。结果提示利福昔明高剂量给药的效果更优,可有效清除病原菌,改善肠道微环境,并可修复受损的肠黏膜屏障,从而使促炎与抗炎因子的表达恢复平衡。此外,在用药安全性方面,3组的不良反应发生率差异无统计学意义,提示高剂量利福昔明并不会使不良反应发生率升高。
综上所述,与低、中剂量利福昔明联合益生菌相比,高剂量利福昔明联合益生菌治疗IBS-D合并SIBO患者,可在保证用药安全性的前提下获得更好的临床疗效,可明显减轻患者的临床症状,显著缓解炎性反应,并可大幅提高SIBO转阴率。本研究尚存在不足之处,如样本量较小可能使研究结果出现偏倚,临床观察的时间较短,远期疗效尚不明确。今后将扩大样本量、延长临床观察时间,进行深入研究。
