鸡c-myc 原癌基因反义RNA 的鉴定及其抗ALV-J 能力的分析
2022-03-22张瑾麒朱姝桐柴文娴陈绪靖陈世豪耿拓宇崔恒宓胡序明
骆 欢,张瑾麒,朱姝桐,柴文娴,陈绪靖,陈世豪,耿拓宇,崔恒宓*,胡序明*
(1.扬州大学动物科学与技术学院/表观遗传学及表观基因组学研究所,江苏 扬州 225009;2.扬州大学教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009;3.常州市动物疫病预防控制中心,江苏 常州 213002)
禽白血病病毒(Avian Ieukosis virus,ALV)属于禽反转录病毒科C 型肿瘤病毒,由该病毒引起的禽白血病每年给全球养禽业造成严重的经济损失。依据病毒囊膜糖蛋白的抗原性差异、病毒干扰试验和基因组的特性,鸡ALV 可划分为A、B、C、D、E、J 和最新分离发现的K 亚群[1-2]。ALV-J 自1988 年在英国的肉鸡中分离鉴定后迅速蔓延至世界各地,给养鸡业造成了严重的经济损失。我国于1999年从商品化肉鸡中首次分离到ALV-J,并于2004年首次报道商品化蛋鸡ALV-J 感染病例。近年来,ALV-J 株呈现新的变异趋势[3-4]。目前,ALV-J 已成为我国各种类型鸡群中危害最严重的ALV 流行亚群,且至今尚无有效的ALV-J 商品化疫苗和特效药物。
宿主表观遗传调控,特别是非编码RNA,可能与ALV-J 的侵入、感染、复制以及肿瘤发生密切相关。研究发现鸡miR-375 作为一种新的肿瘤抑制microRNA与ALV-J的肿瘤发生密切相关,且参与ALV-J感染和肿瘤发生[5],但常在ALV-J 感染鸡肝脏组织中的表达下调[6];而鸡miR-23b和miR-34b-5p分别通过靶向干扰素调节因子-1(IRF1)[7]和黑色素瘤分化相关基因5(MDA5)[8]促进ALV-J 复制。另外,长链非编码RNA 同样涉及ALV-J 感染。研究还发现表观遗传药物,如DNA 甲基化抑制剂,可以显著激活反义长链非编码RNA lnc-ALVE1-AS1 并抑制ALV-J 的感染和复制[9]。这些研究不仅为理解ALV-J 的致病机制和宿主抗病机理提供了重要线索,还为开发有效的新型疫苗提供重要思路和研究策略。
与ALV-A和ALV-B主要引起淋巴瘤不同,ALV-J感染主要引起髓样细胞瘤。原癌基因c-myc被鉴定为ALV-J 诱导髓样细胞瘤的常见整合位点[10],其异常激活可能是ALV-J 最重要的分子致病机制[11]。因此,推测通过降低c-myc表达是一种抵抗ALV-J 感染及其诱导髓样细胞瘤发生的有效策略,为验证该推测,本研究经PCR 扩增并表达了一种抑制原癌基因c-myc表达的反义RNA:ch-MYC-AS1,进一步分析其过表达对c-myc原癌基因表达和ALV-J 复制的影响,以期为探究c-myc原癌基因反义RNA在ALV-J 致病机理中的作用奠定基础。
1 材料与方法
1.1 主要实验材料鸡巨噬细胞系(HD11)和ALV-J JS09GY3 株由扬州大学秦爱建教授惠赠;真核表达载体pcDNA3.1(+)由本实验室保存。
DMEM 高糖培养基和胎牛血清FBS 购自美国Gibco 公司;SMARTer®RACE 5'/3' Kit 和XfectTMTransfection Reagent 购自TaKaRa 公司;RNA-easy Isolation Reagent、反转录试剂盒HiScript Q RT SuperMIX for qPCR(+gDNA wiper)、荧光染料ChamQ SYBR qPCR、Taq酶和胶回收试剂盒均购自南京诺唯赞生物科技有限公司;超敏ECL 化学发光试剂盒、胰蛋白酶、DH5α 感受态细胞均购自苏州新赛美生物科技有限公司;T4 DNA 连接酶、限制性核酸内切酶HindⅢ、BamH I 和XbaI 均购自美国NEB 公司;质粒抽提试剂盒和DNA 纯化试剂盒购自美国Omega Bio-tek 公司;pGEM-T-easy Vector 购自美国Promega 公司;Anti-c-Myc 抗体购自Abcam 公司;HRP 标记的山羊抗鼠和山羊抗兔IgG,FITC 标记的山羊抗兔IgG 购自Sigma公司;鼠抗HA MAb购自Santa Cruz Biotechnology。
1.2 引物的设计与合成分别参照GenBank 中的鸡c-myc基因序列(NM_001030952.1)、鸡GAPDH 基因序列(NM_204305.1)和ALV-J 病毒JS09GY3 毒株基因序列(GU982308.1),采用Primer premier 6.0 软件设计荧光定量PCR 的引物,序列信息见表1,表中下划线标注的小写字母代表酶切位点序列,未加下划线的小写字母代表HA标签序列。检测引物委托Thermo Fisher Scientific和苏州金唯智生物科技有限公司合成。

表1 本研究所使用的qPCR引物Table 1 The qPCR primers used in this study
1.3 ch-MYC-AS1 的PCR 扩增及其蛋白编码的属性分析
1.3.1 ch-MYC-AS1 的cDNA 末端快速扩增(Rapid amplification of cDNA ends,RACE) 利用TRIzol®Reagent 提取鸡巨噬细胞系HD11 总RNA,经RNasefree DNase I 去除基因组。利用SMARTScribe Reverse Transcriptase(试剂盒提供)将1 μg 去除基因组的RNA反转录合成5'-或3'-RACE 产物。按照SMARTer®RACE 5'/3'Kit的操作说明,采用通用引物UPM分别与5'-末端或3'-末端基因特异性引物(Gene-specific primer,GSP)ch-MYC-AS1-5-race/ch-MYC-AS1-3-race进行PCR扩增,扩增产物由苏州金唯智生物科技有限公司测序分析ch-MYC-AS1的5'末端和3'末端序列。
1.3.2 ch-MYC-AS1 的PCR 扩增 利用RNA-easy Isolation Reagent 提取鸡巨噬细胞系HD11 总RNA,通过反转录试剂盒反转录为cDNA 作为模板,采用引物ch-MYC-AS1-F/ch-MYC-AS1-R,利用常规PCR 扩增ch-MYC-AS1。PCR 产物通过TA 克隆测序分析ch-MYC-AS1 的全长cDNA 序列。
1.3.3 ch-MYC-AS1 的蛋白编码属性分析 为了分析ch-MYC-AS1 是否具有蛋白编码属性,本研究在ch-MYC-AS1 全长扩增上游引物(F)中加入起始密码子ATG +HA 标签序列,HA 标签序列后通过不加T、加1 个T 和加2 个T 以实现ch-MYC-AS1 所有3 种编码蛋白的可能性。以HD11细胞cDNA作为模板,分别采用引物HA-ch-MYC-AS-F/HA-ch-MYC-AS-R、HA-Tch-MYC-AS-F/HA-ch-MYC-AS-R 和HA-TT-ch-MYCAS-F/HA-ch-MYC-AS-R,利用常规PCR 分别扩增
3种全长ch-MYC-AS1,分别克隆至真核表达载体pcDNA3.1(+)中,重组质粒经克隆测序和酶切鉴定正确后分别命名为pcDNA3.1-HA-ch-MYC-AS1、pcDNA3.1-HA-T-ch-MYC-AS1和pcDNA3.1-HA-TT-ch-MYC-AS1。将HEK293T 细胞接种至6 孔细胞培养板中,待其生长至70%融合度后,利用XfectTMTransfection Reagent 分别将pcDNA3.1-HA-ch-MYC-AS1(2 μg)、pcDNA3.1-HA-T-ch-MYC-AS1(2 μg)和pcDNA3.1-HA-TT-ch-MYC-AS1(2 μg)表达质粒转染至HEK293T细胞。同时,转染pcDNA3.1-HA-TP53 质粒作为阳性对照。转染48 h 后收集细胞,以鼠抗HA MAb(1∶1 000)为一抗,HRP标记的山羊抗鼠IgG(1∶10 000)为二抗,经western blot 分析ch-MYC-AS1 编码蛋白情况。
1.4 重组真核表达载体pcDNA3.1-ch-MYC-AS1的构建与鉴定以HD11细胞cDNA作为模板,采用引物ch-MYC-AS1-HindⅢ-F/ch-MYC-AS1-BamH I-R,PCR 扩增ch-MYC-AS1,PCR 产物回收后与pGEM-T载体于16 ℃连接过夜,测序正确的连接产物命名为pGEM-T-ch-MYC-AS1。将该质粒与pcDNA3.1(+)(Invitrogen)过表达质粒载体分别经HindⅢ/BamH I 酶切,回收酶切产物ch-MYC-AS1 和pcDNA3.1(+)载体,利用T4 DNA ligase 于22 ℃连接后转化至大肠杆菌感受态细胞,重组质粒经酶切和测序鉴定正确后,命名为pcDNA3.1-ch-MYC-AS1。
1.5 过表达ch-MYC-AS1 对宿主细胞c-myc原癌基因表达影响的检测
1.5.1 ch-MYC-AS1 过表达后c-myc原癌基因mRNA转录水平的检测 将HD11 细胞铺于6 孔细胞培养板中,待其生长至70%融合度时,采用XfectTMTransfection Reagent 分别转染pcDNA3.1-ch-MYC-AS1(2 μg)和pcDNA3.1-GFP(2 μg)。41 ℃、5% CO2培养48 h后收集细胞,利用RNA-easy Isolation Reagent 试剂盒提取总RNA,采用反转录试剂盒HiScript Q RT SuperMIX for qPCR(+gDNA wiper)将1 μg 总RNA 反转录成cDNA,cDNA 产物稀释后通过荧光定量PCR 检测原癌基因c-myc和内参基因GAPDH 的转录水平,反应程序为:95 ℃30 s;95 ℃5 s,60 ℃34 s,40 个循环。
1.5.2 ch-MYC-AS1 过表达后c-myc原癌基因蛋白水平的检测 按照1.5.1 的操作步骤将pcDNA3.1-ch-MYC-AS1 和pcDNA3.1-GFP 表达质粒转染HD11 细胞。41 ℃、5% CO2培养48 h 后收集细胞,分别以鼠抗c-mycMAb(1∶2 000)和兔抗GAPDH 多克隆抗体(1∶2 000)为一抗,HRP 标记的山羊抗鼠IgG 和山羊抗兔IgG(1∶10 000)为二抗,经western blot 检测ch-MYC-AS1 过表达后对c-myc原癌基因蛋白表达水平的影响。
1.6 过表达ch-MYC-AS1 对ALV-J 复制影响的检测
1.6.1 ch-MYC-AS1过表达后ALV-J p27蛋白表达水平的检测 将HD11细胞铺至6孔细胞培养板,待其生长至70%融合度后,采用MOI 5 的ALV-J(JS09GY3 株)感染细胞,41 ℃、5% CO2孵育4 h 后,采用XfectTMTransfection Reagent 转染试剂分别将pcDNA3.1-ch-MYC-AS1(2 μg)和pcDNA3.1-GFP(2 μg)表达质粒转染至HD11 细胞。41 ℃、5% CO2培养48 h 后,分别收集细胞上清和细胞样品,利用IDEXX 禽白血病抗原检测试剂盒检测细胞上清中ALV-J p27 蛋白表达水平。
1.6.2 ch-MYC-AS1 过表达后ALV-J 囊膜基因表达水平的检测 将1.6.1 收集的细胞样品一分为二,一部分利用1.5.1 中的荧光定量PCR 方法检测ch-MYCAS1 过表达后ALV-J 囊膜基因envmRNA 和内参基因GAPDH 的转录水平。另一部分,以鼠抗ALV-J 囊膜蛋白MAb JE9(1∶300)和兔抗GAPDH 多克隆抗体(1∶2 000)为一抗,HRP 标记的山羊抗鼠IgG 和抗兔IgG(1∶10 000)为二抗,利用western blot 检测ALV-J囊膜蛋白Env 和内参蛋白GAPDH 的表达水平。
1.6.3 ch-MYC-AS1 过表达后ALV-J 效价的检测 于96 孔细胞培养板中,将1.6.1 收集的细胞上清原液按10-1、10-2、10-3、……10-1210 倍倍比稀释后接种鸡胚成纤维细胞DF-1,每个稀释度重复8 个孔,37 ℃孵育4 h,更换新鲜的DF-1 细胞培养液并于37 ℃、5% CO2条件下继续培养5 d~7 d 后,4%多聚甲醛固定,以鼠抗ALV-J 囊膜蛋白MAb JE9(1∶300)为一抗,FITC 标记的山羊抗鼠IgG(1∶2 000)为二抗,进行间接免疫荧光分析,并计算出ALV-J的TCID50。
1.7 统计分析与作图采用GraphPad Prism 5.0 软件对定量数据进行统计学处理和作图,所有数据以t检验比较组间差异。*表示P<0.05,差异显著;**表示P<0.01,差异极显著。
2 结 果
2.1 ch-MYC-AS1 蛋白编码属性分析结果本试验通过RACE 扩增后测序分析结果显示,正确扩增了ch-MYC-AS1 的5'-RACE 序列(图1A)和3'-RACE序列(图1B)。在此基础上,通过PCR 扩增ch-MYCAS1,并进行TA 克隆测序,结果显示,获得了621 bp的ch-MYC-AS1 全长序列(图1C),该反义RNA 定位于鸡2号染色体,且源自c-myc原癌基因外显子3反向序列(图1D)。通过生物信息学分析和蛋白翻译系统分析,结果显示ch-MYC-AS1 不编码蛋白(图1E),属于非编码RNA。

图1 ch-MYC-AS1的PCR扩增鉴定结果Fig.1 The identification results of ch-MYC-AS1
2.2 重组真核表达载体pcDNA3.1-ch-MYC-AS1的构建与鉴定结果通过PCR 扩增获得含有HindⅢ和BamH I 酶切位点的ch-MYC-AS1 全长序列,琼脂糖凝胶电泳结果显示在约600 bp 处可见明显条带,与目的序列大小一致(图2A),测序结果显示其与已鉴定的ch-MYC-AS1 序列同源性达100%,表明正确扩增得到含有HindⅢ和BamH I 酶切位点的ch-MYCAS1 序列。pcDNA3.1-ch-MYC-AS1 重组质粒经HindⅢ和BamH I 双酶切鉴定,结果显示在约5 000 bp 和600 bp处可见目的条带(图2B),测序结果同上。以上结果表明ch-MYC-AS1片段已经正确插入pcDNA3.1真核表达载体,可用于后续实验。
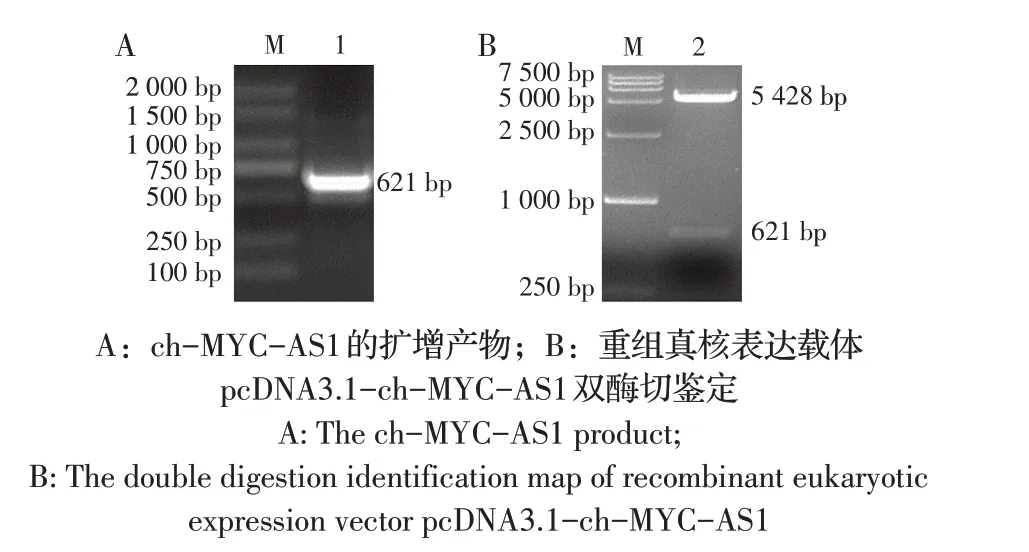
图2 重组真核表达质粒pcDNA3.1-ch-MYC-AS1的构建与鉴定Fig.2 Construction and identification of recombinant eukaryotic expression plasmid pcDNA3.1-ch-MYC-AS1
2.3 过表达ch-MYC-AS1 对c-myc原癌基因表达影响的检测结果将pcDNA3.1-ch-MYC-AS1 真核表达质粒转染HD11 细胞后,利用荧光定量PCR 和western blot 分别检测原癌基因c-myc的转录及表达水平。结果显示,与GFP 对照组相比,c-myc原癌基因mRNA 转录水平和蛋白表达水平在ch-MYC-AS1 转染后48 h的HD11细胞中均显著下调(P<0.01)(图3)。表明过表达ch-MYC-AS1 可以抑制c-myc原癌基因在巨噬细胞HD11 中的转录及表达。

图3 过表达ch-MYC-AS1对c-myc原癌基因转录及蛋白表达的影响Fig.3 The effect of ch-MYC-AS1 overexpression on the expression of c-myc proto-oncogene
2.4 过表达ch-MYC-AS1 对ALV-J 复制影响的检测结果为进一步验证ch-MYC-AS1 是否也具有抵抗肿瘤病毒ALV 增殖的能力,采用MOI 5 的ALV-J感染HD11 细胞后,将pcDNA3.1-ch-MYC-AS1 真核表达质粒转染至HD11 细胞中,转染后48 h 使用IDEXX 禽白血病抗原检测试剂盒检测细胞上清中ALV-J p27 蛋白表达水平,结果显示过表达ch-MYCS1 显著降低细胞上清中ALV-J p27 蛋白表达(P<0.01)(图4A)。进一步利用荧光定量PCR 和western blot 检测ALV-J 囊膜基因env转录和表达水平,结果显示:与GFP 对照组相比,ALV-Jenv基因mRNA 转录水平和蛋白表达水平在ch-MYC-AS1 转染后48 h 的HD11 细胞均显著下调(P<0.01)(图4B、图4C)。利用间接免疫荧光技术检测DF-1 细胞上清中ALV-J 的病毒效价,结果显示:与对照组相比,HD11 上清中的ALV-J的病毒效价在ch-MYC-AS1转染后48 h显著降低(P<0.01)(图4D)。以上结果表明过表达ch-MYCAS1可以抑制ALV-J在巨噬细胞HD11中的增殖。

图4 过表达ch-MYC-AS1对ALV-J复制的影响Fig.4 The effect of ch-MYC-AS1 overexpression on the replication of ALV-J
3 讨 论
研究表明,宿主表观遗传调控,特别是非编码RNA,可能与ALV-J 感染和肿瘤发生密切相关[5,9]。由于ALV-J 是一个禽类致癌反转录病毒,ALV-J 感染引起宿主免疫应答反应同时,也会激活宿主癌基因的异常表达而利于肿瘤的形成。因此,揭示ALV-J 致癌的表观遗传调控机制也是ALV-J 致病机制研究的一个重要科学问题。
反义RNA 是一种普遍存在的内源性调节RNA。能转录反义RNA 转录子的基因无处不在[12-14]。通过生物信息学方法已经证实,小鼠和人存在大量正义-反义转录序列[15]。哺乳动物基因组转录子中,70%的转录子有反义RNA,且反义RNA 的异常能影响正义基因的正常表达[16]。许多反义RNA 属于长非编码RNA,它们主要以RNA 的形式参与多层次的调控,包括表观遗传学调控、转录水平以及转录后RNA 水平的调控。与小非编码RNA 如miRNA 和piRNA 一样,它们是基因信息传递过程中基因表达时空性调控的有效调节因子。本研究团队前期通过筛查反义-正义cDNA 文库发现人原癌基因c-myc存在反义RNA(数据尚未发表)。而致癌基因c-myc的发现途径就是通过对致癌反转录病毒引起的鸡暴发性肿瘤的早期研究开始的[17],那鸡c-myc原癌基因是否也存在反义RNA?如果存在,对c-myc基因和ALV-J增殖有何影响?这些问题尚待研究。
HD11 是重要的免疫细胞,常用于家禽抗病毒研究,且其被禽骨髓细胞瘤病毒MC29 转化,因此具有肿瘤化特性,这种特性与c-myc基因过表达相关。尽管ALV-J 感染主要引起髓样细胞瘤,但与禽骨髓细胞瘤病毒MC29 捕获c-myc形成v-myc 癌基因不同,ALV-J 不携带癌基因,其感染引起的髓样细胞瘤可能与c-myc异常激活有关[11]。因此本研究选择鸡巨噬细胞系HD11 作为体外模型来探索鸡c-myc原癌基因反义RNA 对ALV-J 增殖的影响。本研究团队前期通过构建HD11 细胞双链RNA 文库和高通量测序已发现鸡c-myc原癌基因外显子中可能存在反义RNA,本研究进一步证实鸡c-myc第3 个外显子存在反义RNA,并通过RACE 及PCR 克隆其全长序列,命名为ch-MYC-AS1。
研究发现在ALV 易感品系鸡中,由于“强”病毒启动子的插入,前病毒整合入c-myc原癌基因后[18],由病毒长末端重复序列(Long terminal repeats,LTR)启动子驱动c-myc基因高水平表达,从而诱发法氏囊淋巴瘤[19]。ALV 感染后致癌蛋白MYC 的异常高水平表达影响了鸡法氏囊组织基因的表达,这是导致淋巴瘤发生的重要原因[20]。而在ALV 抗性品系鸡体内,会减少由病毒启动子LTR 驱动的c-myc 基因异常表达[21],以阻止ALV 通过c-myc 原癌基因诱导淋巴瘤[22]。本研究发现在HD11 细胞中过表达ch-MYCAS1 可以显著抑制鸡c-myc基因mRNA 转录和蛋白表达,并且RT-qPCR 和western blot 检测结果发现ch-MYC-AS1 可以显著抑制ALV-J 囊膜基因env转录和蛋白表达水平;病毒效价检测结果也证实了这一点。同时,ELISA 检测结果也证实ch-MYC-AS1可以显著抑制ALV-J 衣壳蛋白p27 蛋白表达。上述实验结果充分说明ch-MYC-AS1 可以抑制ALV-J 在巨噬细胞HD11 中的增殖。因此,推测ch-MYC-AS1 可能主要通过抑制原癌基因c-myc表达来影响ALV-J 的增殖及其诱导的髓样细胞瘤,通过降低致癌蛋白MYC 的表达是一种抵抗ALV-J 感染及其诱导的髓样细胞瘤发生的有效策略。然而,关于ch-MYC-AS1抑制ALV-J增殖的具体机制仍有待进一步深入研究。
综上所述,本研究首次发现c-myc原癌基因反义RNA 可以抑制c-myc表达和ALV-J 增殖,该结果不仅对基础研究和临床医学研究均具重大意义,也对抗肿瘤病毒研究具有重要意义。随着癌基因衍生的反义RNA 在抑制肿瘤细胞和肿瘤病毒增殖中的作用及其表观遗传学机制的逐渐解析,其有望成为新型的抗肿瘤和抗病毒药物。
