siRNA-881 干扰GLS 基因对旋毛虫肌幼虫抗酸能力的影响
2022-03-22刁子洋宋铭忻
孟 诗,张 妍,杨 啸,赵 亚,高 远,王 爽,刁子洋,郭 琨,宋铭忻
(东北农业大学动物源性人兽共患病黑龙江省重点实验室,黑龙江 哈尔滨 150030)
旋毛虫病是一种重要的食源性人畜共患病,分布于世界各地。旋毛虫病不仅给养殖业造成重大经济损失,严重时还危及人类生命健康[1]。感染旋毛虫主要临床表现为胃肠道症状、发热、眼睑水肿及肌肉疼痛等[2]。目前,旋毛虫可大体分为9 个种[3],其中猪旋毛虫(Trichinella spiralis)分布最为广泛,占比达43.3%。旋毛虫虫种分布与自然环境、温度气候及当地居民饮食习惯等因素息息相关。
近年来,微生物与胃肠道、寄生虫与胃肠道之间的致病关系已逐渐成为研究热点。胃液为极酸环境(pH1.5~pH2.5)[4],能够抵御多种病原微生物进入胃肠道从而保护机体免受侵害。然而,大多数食源性致病菌具有耐酸特性,可顺利通过胃液环境进入肠道使机体感染[5]。大肠杆菌(Escherichia coli,E. coli)是日常生活中最常见的食源性病原之一,且致病力较强。目前已知,大肠杆菌中主要存在以下4 种抗酸系统:葡萄糖代谢产物抑制的抗酸系统(AR1)、谷氨酸依赖型抗酸系统(AR2)、精氨酸依赖型的抗酸系统(AR3)、谷氨酰胺依赖型抗酸系统(AR4)。其中AR4 是指大肠杆菌利用其谷氨酰胺酶(GLS)将吸收后的L-谷氨酰胺(Gln),转化成L-谷氨酸(Glu),并释放氨(NH3),游离氨能与细菌内的H+结合从而达到抗酸目的[6]。研究发现旋毛虫肌幼虫中谷氨酸含量较高[7],结合其生活史可知旋毛虫属于食源性感染,经口感染需在胃中停留一定时间后再进入肠道感染宿主,因此,推测旋毛虫可能具有与大肠杆菌AR4 相似的抗酸机制。
小干扰RNA(Small interfering RNA,siRNA)导入机体后能特异性地抑制靶向基因的表达,可以用于对基因功能分析[8]。本实验室前期研究已经表明:极酸性环境可以诱导旋毛虫GLS 基因mRNA 大量表达[9],初步推测旋毛虫中存在类似于大肠杆菌中的AR4。为进一步探究GLS 基因在旋毛虫抗酸过程中发挥的作用,本实验利用RNA 干扰技术沉默旋毛虫肌幼虫的GLS 基因,通过荧光定量PCR、western blot等方法,检测siRNA 分子在酸性环境下沉默TsGLS 基因对旋毛虫肌幼虫抗酸能力影响,以期为旋毛虫病的防治提供新的思路。
1 材料与方法
1.1 主要实验材料猪旋毛虫(T. spiralis)ISS533株,由东北农业大学动物医学学院寄生虫教研室传代并保存。BALB/c 雌性小鼠,购自哈尔滨医科大学动物实验中心。脂质体转染试剂(Lipofectin 2000)购自Invitrogen 公司;TRIzol、BCA 试剂盒和预染蛋白Marker 购自宝生物工程(大连)有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG 和FITC 标记的山羊抗兔IgG 购自北京中杉金桥生物技术有限公司;ChamQ SYBR qPCR Master Mix 购自诺唯赞生物。所用TsGLS 多抗血清为本实验室前期制备并保存。
1.2 最佳干扰效果siRNA 分子的筛选取感染旋毛虫肌幼虫40 d 以上的小鼠迫杀后,采用人工胃液消化法[10]从小鼠肌肉中提取旋毛虫肌幼虫,利用改良后的贝尔曼法收集大量虫体[11],计数后置于4 ℃。根据NCBI 已登录的TsGLS mRNA 序列(XM_003375164),利用在线RNAi 设计平台(http://rnaidesigner.lifetech nologies.com/rnaiexpress/setOption.do?designOption=shrna&p)设计3 条靶向沉默TsGLS 基因的干扰序列(siRNA-419、siRNA-881、siRNA-1429)及1 个阴性对照序列(Control siRNA)(表1)。TsGLS-siRNA 及阴性对照均由上海吉玛制药技术有限公司合成。利用Lipofectin 2000,采用浸泡法[12]将3 条TsGLS-siRNA 以终浓度2 μmol/L转染肌幼虫。设置control siRNA 阴性对照和PBS空白对照。
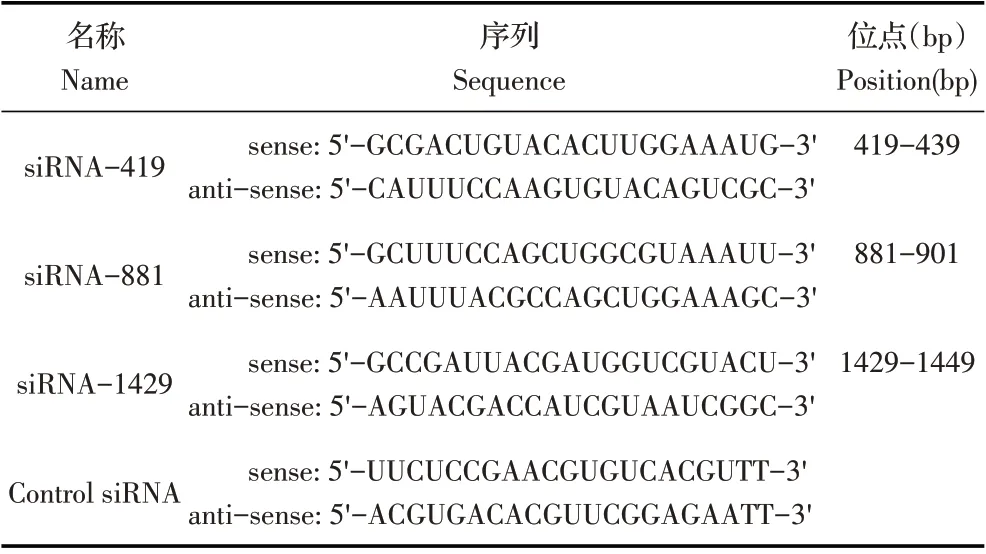
表1 TsGLS的siRNA序列Table 1 siRNA sequences for TsGLS
将上述经siRNA 转染并培养3 d 后的旋毛虫肌幼虫利用TRIzol 法提取总RNA,反转录成cDNA,参照文献[9]引物序列及qPCR 方法检测TsGLS 基因的转录水平,每组设置3 个重复。收集转染后的各组旋毛虫肌幼虫, 以盐析法制备全虫可溶性蛋白,通过BCA 法测定蛋白质浓度。以TsGLS 多抗血清(1∶1 000)作为一抗,兔抗GAPDH MAb(1∶10 000)作为内参一抗,HRP 标记的山羊抗兔IgG(1∶10 000)为二抗,采用western blot 检测各组肌幼虫可溶性蛋白中TsGLS蛋白的相对表达量,筛选干扰效果最佳的siRNA分子。
1.3 干扰条件的优化与干扰效果鉴定根据1.2 中的筛选结果,确定siRNA-881 为干扰效果最佳的siRNA分子。利用Lipofectin 2000,采用浸泡法将不同终浓度的siRNA-881(1 μmol/L、2 μmol/L、4 μmol/L)转染旋毛虫肌幼虫12 h 后,更换培养液后培养3 d,参照1.2 中的方法分别利用qPCR 检测TsGLS 基因的转录水平,采用western blot 检测TsGLS 蛋白的表达,确定最佳转染浓度。按上述最佳浓度转染siRNA-881 后0、1 d、3 d、5 d、7 d 收集旋毛虫肌幼虫,利用qPCR 检测TsGLS 转录水平,确定转染后的最适培养时间。为鉴定siRNA-881 对TsGLS 的干扰效果,设置siRNA-881 转染组、control siRNA 阴性对照组、PBS 空白对照组,根据上述确定的最优干扰条件转染后培养各组旋毛虫肌幼虫,采用qPCR 与western blot检测TsGLS 基因转录与蛋白表达水平。将上述各组旋毛虫肌幼虫固定至粘附性载玻片,以TsGLS 多抗体血清(1∶500)作为一抗,FITC 标记的山羊抗兔IgG(1∶1 000)为二抗,经间接免疫荧光试验(IFA)检测siRNA-881 分子对TsGLS 蛋白表达水平的影响。
1.4 TsGLS 基因沉默对旋毛虫肌幼虫在酸性环境抗酸能力的影响将TsGLS siRNA-881 利用浸泡法导转染旋毛虫肌幼虫3 d 后,分别在pH 值为2.5、4.0、6.6和9.0条件下,于37 ℃,5%CO2培养0.5 h、1 h、2 h后收集虫体,检测各组旋毛虫肌幼虫存活率,存活率=(虫体总数-死亡数)/虫体总数×100%。
1.5 体内实验分组设计将12 只2 月龄左右健康BALB/c 小鼠随机均分为4 组,利用灌胃法分别接种生理盐水及siRNA-881 组旋毛虫肌幼虫、control siRNA 组旋毛虫肌幼虫、PBS 组旋毛虫肌幼虫,接种量为300 条旋毛虫肌幼虫/只。感染后7 d、35 d 分别迫杀各组小鼠,收集小肠与肌肉用于后续实验检测。
1.6 siRNA-881 转染后旋毛虫成虫和肌幼虫感染小鼠的减虫率检测将感染后7 d 的小鼠纵向取出小肠并冲洗干净,切成2 cm~3 cm 的小块,放入含有双抗的无菌生理盐水中,37 ℃孵育3 h,收集成虫并计数后计算成虫减虫率。通过人工胃液消化法分别收集感染35 d 的旋毛虫肌幼虫,计算旋毛虫肌幼虫减虫率。减虫率=(PBS 对照组虫数-siRNA-881 组虫数)/PBS 对照组虫数×100%。
1.7 siRNA-881 转染后的旋毛虫肌幼虫感染小鼠后的保姆细胞壁厚度测定收集感染旋毛虫7 d 的各组小鼠,脱颈法迫杀后取整片膈肌。参照文献[13]进行HE 染色观察保姆细胞壁厚度的变化,并利用Photoshop 测量保姆细胞壁厚度,根据与PBS 组和control siRNA 组的对比结果,分析经siRNA-881 转染后的旋毛虫肌幼虫对宿主的侵袭力。
1.8 TsGLS 基因沉默后子一代肌幼虫TsGLS 基因转录水平检测通过人工胃液消化法收集1.5 中各组的肌幼虫,并置于RPMI 1640 培养基中过夜培养后基更换为pH2.5 的酸性溶液,培养2 h 后,收集各组旋毛虫肌幼虫,提取总RNA并反转录为cDNA,利用qPCR 检测子一代肌幼虫TsGLS 基因转录水平的变化。
2 结 果
2.1 siRNA 分子筛选结果将终浓度同为2 μmol/L的各组siRNA 分子转染旋毛虫肌幼虫后培养3 d,利用qPCR 检测TsGLS 的转录水平。结果显示,siRNA-419、siRNA-881、siRNA-1429转染组的TsGLS mRNA转录水平相对于PBS 对照组分别降低了49.99%、72.82%、60.69%,siRNA-881 介导的TsGLS mRNA 沉默效果最明显;control siRNA 对照组与PBS 对照组相比,TsGLS mRNA 转录水平无明显变化(P>0.05)(图1A)。根据western blot 结果分析灰度值,结果显示,与PBS 对照组相比,siRNA-419、siRNA-881、siRNA-1429 转染组TsGLS 表达量分别降低7.74%、55.44%、35.52%,而control siRNA组相对于PBS组Ts-GLS表达量无明显变化(P>0.05)(图1B)。表明siRNA-881 对TsGLS 基因干扰效果最明显,因此选择其用于后续试验。
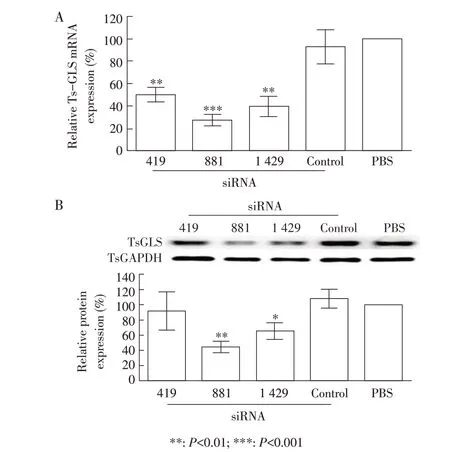
图1 siRNA转染后旋毛虫肌幼虫TsGLS基因转录(A)与蛋白表达(B)的检测结果Fig.1 The gene transcription(A)and protein expression(B)of TsGLS in Trichinella spiralis muscle larvae after siRNA treatment
2.2 干扰条件的优化及干扰效果的鉴定将siRNA-881 利用浸泡法转染旋毛虫肌幼虫,采用不同转染浓度的siRNA-881 和转染12 h 后分别培养不同时间,经qPCR 和western blot 检测TsGLS 基因转录水平和蛋白表达水平,最终确定终浓度为2 μmol/L siRNA-881 转染12 h 后体外培养3 d 为最佳干扰条件(图略)。对其基因沉默效果采用qPCR、western blot 及IFA检测,结果显示(图2),在基因转录水平和蛋白表达水平两方面均体现出siRNA-881 分子对TsGLS 基因的沉默效果(图2),表明优化的条件可用,且效果显著。
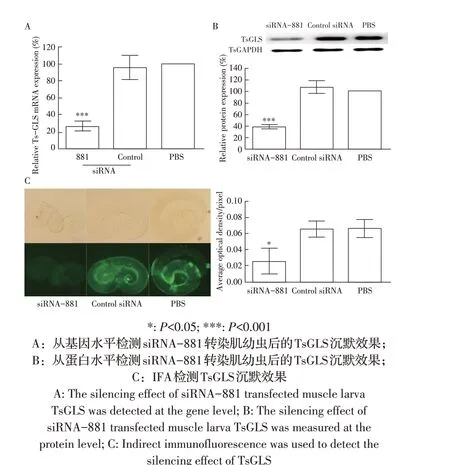
图2 siRNA-881转染肌幼虫后TsGLS沉默效果的检测Fig.2 Silencing of muscle larva TsGLS by siRNA-881 transfection
2.3 酸性条件下TsGLS 基因沉默对肌幼虫抗酸能力的影响经siRNA-881 转染旋毛虫肌幼虫3 d 后,在不同酸性环境中分别培养不同时间,计算各组旋毛虫肌幼虫的存活率,结果显示,同在pH2.5、pH4培养条件下,siRNA-881 组旋毛虫肌幼虫与PBS 对照组和control siRNA 组旋毛虫肌幼虫相比存活率在0.5 h 时降低22.20%、27.52%,在1 h 时降低16.55%、21.87%,在2 h 时降低19.20%、19.08%。在酸性环境中培养时间越长,肌幼虫存活率越低;相同培养时间内,同组旋毛虫肌幼虫在pH6.6的存活率高于其他不同pH值条件下培养旋毛虫肌幼虫的存活率(图3)。上述结果表明,TsGLS 基因沉默会降低旋毛虫肌幼虫的抗酸能力,TsGLS 基因在旋毛虫抗酸过程中起重要作用。
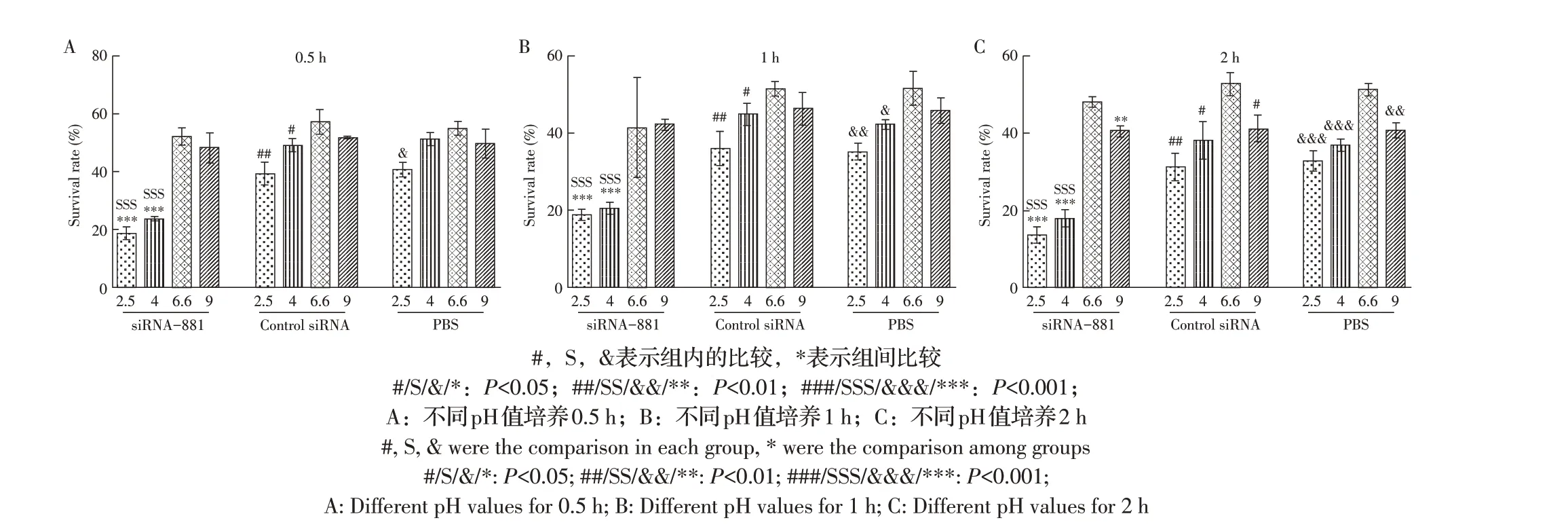
图3 肌幼虫在不同pH、时间内存活率Fig.3 Survival rate of muscle larvae in different pH and time
2.4 减虫率分析统计各组小鼠虫体数后与PBS对照组比较可知:siRNA-881 组小鼠旋毛虫成虫与旋毛虫肌幼虫数量均明显降低,攻虫后第7 d旋毛虫成虫的减虫率为61.64%,攻虫后第35 d旋毛虫肌幼虫减虫率为66.71%,统计数据具有显著性差异(P<0.001)(表2)。表明经siRNA 转染后,旋毛虫肌幼虫的抗酸能力降低,繁殖力也随之减弱。
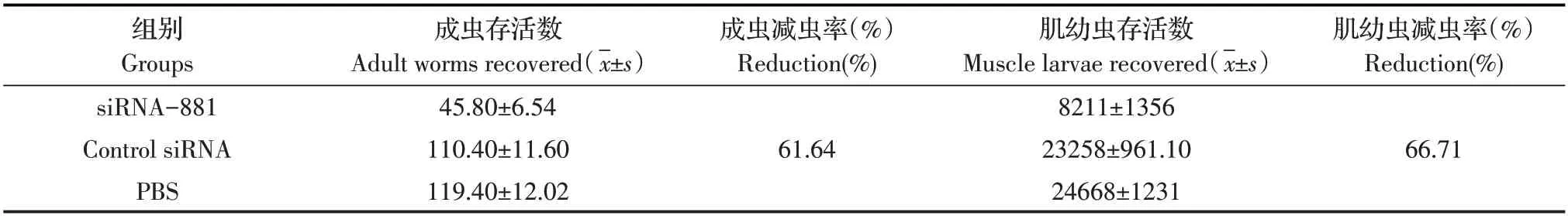
表2 siRNA-881转染的肌幼虫感染BALB/c小鼠后的体内成虫及肌幼虫减虫率Table 2 Reduction rates of worm adult and muscle larvae induced by siRNA-881 treatment of muscle larvae in BALB/c mice
2.5 保姆细胞壁厚度测定结果测量各组保姆细胞壁厚度分析可知,与PBS组(26.40±1.697)对比,siRNA-881 组(15.90±1.301)保姆细胞厚壁度降低了39.78%,且差异极显著(P<0.01);PBS 组与control siRNA 组(24.94±1.511)相比,差异不显著(P>0.05)(图4)。表明经siRNA 转染旋毛虫肌幼虫子一代肌幼虫自身保护能力较差,形成保姆细胞壁厚度较薄,抵抗外界免疫能力较差。
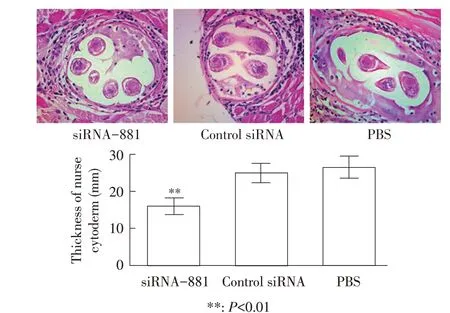
图4 保姆细胞壁厚度分析Fig.4 Analysis of nurse cytoderm thickness
2.6 TsGLS 基因沉默后子一代肌幼虫TsGLS 基因转录水平检测结果经过人工胃液消化法提取子一代旋毛虫肌幼虫,对siRNA-881 转染旋毛虫肌幼虫TsGLS 基因沉默遗传性进行分析,qPCR 结果显示,siRNA-881 组旋毛虫肌幼虫的TsGLS 基因转录水平较PBS 对照组降低42.52%,差异极显著(P<0.01)(图5)。再次表明,TsGLS 基因沉默会导致旋毛虫肌幼虫的抗酸能力降低,使其对宿主的损伤减弱。
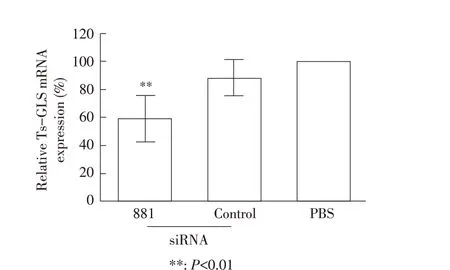
图5 子一代肌幼虫TsGLS基因转录水平的检测Fig.5 Transcriptional level of TsGLS gene in the offspring muscle larvae
3 讨 论
旋毛虫病是一种世界范围内广泛分布的食源性人兽共患寄生虫病。由于食源性病原体致病过程必经胃液的极酸环境决定了其具有耐酸特性,酸性环境条件诱导耐酸基因的表达是食源性病原体致病的关键[14]。谷氨酰胺依赖型抗酸系统(AR4)是大肠杆菌体内起重要作用的耐酸系统之一,通过该系统在大肠杆菌中的转运与催化可维持菌体内环境的酸碱平衡稳态[15]。本实验室前期研究已证实,酸性条件下谷氨酰胺酶基因在旋毛虫肌幼虫中高效表达[9]。
临床研究上,胃肠道病原体进入肠道之前需在pH2~pH3 的胃液环境中停留达2 h 之久[16]。Lu 等人发现,大肠杆菌中的谷氨酰胺酶在pH≤6.0 条件下被激活,且谷氨酰胺酶活性在pH4.0 时达到峰值,pH5.0 和pH6.0 其次,pH6.6 条件下的谷氨酰胺酶活性仅约为pH6.0 条件下的3%[6]。Rowbury 等研究发现,生物机体为抵抗外界环境刺激会产生细胞外诱导成分(Extracellular induction components,EICs),但在pH9.0 条件下,EICs 则会失去活性[17]。本研究在旋毛虫肌幼虫抗酸能力的检测中,将siRNA-881 干扰后的旋毛虫肌幼虫置于pH2.5、pH4、pH6.6、pH9的培养液中进行培养,siRNA-881 转染组旋毛虫肌幼虫存活率明显低于对照组,且同等pH 值环境条件下,旋毛虫肌幼虫存活率随酸处理时间的延长而降低。在培养时间同为2 h 条件下,pH2.5 与pH4 处理组,与PBS 对照组对比,经siRNA-881 转染后的旋毛虫肌幼虫存活率分别降低19.20%、19.08%;且在pH2.5 条件进行培养2 h 后,siRNA-881 转染后的旋毛虫肌幼虫存活率降低至13.67%。可见通过RNA干扰技术可使TsGLS 基因表达量降低,对旋毛虫肌幼虫谷氨酰胺依赖型抗酸系统造成影响,进而影响旋毛虫肌幼虫活性。而在pH6.6 和pH9 条件下,siRNA-881 转染组旋毛虫肌幼虫的存活率与PBS 对照组相比无显著差异,由此推断,当处于pH6.6 和pH9条件时,旋毛虫肌幼虫机体处于较适宜环境,相关抗酸基因的表达量较低,未参与耐酸过程。对于旋毛虫肌幼虫存活率的检测可表明TSGLS 基因的表达与虫体活性存在密切相关性。
利用siRNA-881 干扰TsGLS 基因,检测通过小鼠胃肠道酸性环境后旋毛虫肌幼虫的减虫率可见,siRNA-881 转染组小鼠的旋毛虫成虫数量和旋毛虫肌幼虫数量较PBS 对照组小鼠明显降低,表明Ts-GLS 基因沉默会降低旋毛虫肌幼虫的抗酸能力。Gorden 等人曾将细菌暴露于低于pH2.5 酸性环境2 h后存活率超过10%定义为细菌的耐酸性[5]。而将旋毛虫置于pH2.5 环境培养2 h 后,存活率仍然可达45%[18]。通过检测旋毛虫肌幼虫形成保姆细胞壁的厚度,发现未经siRNA-881 转染旋毛虫肌幼虫感染小鼠形成包囊后的保姆细胞壁厚度明显大于经siRNA-881 转染后感染的小鼠。旋毛虫可通过感染宿主后形成的包囊摄取维持自身生存所必须的营养物质,以抵御外界炎症细胞的侵害[19]。本实验中由于经siRNA-881 转染后的旋毛虫肌幼虫子一代肌幼虫的自身防御能力较弱,则其形成包囊后的保姆细胞壁厚度较薄,对外界环境因素的抵抗能力较弱。检测siRNA-881 转染后旋毛虫肌幼虫感染的小鼠经人工胃液消化法收集的子一代旋毛虫肌幼虫TsGLS 基因转录水平,结果显示子一代旋毛虫肌幼虫的Ts-GLS 基因转录水平与相同条件下的对照组相比降低42.52%,而亲代旋毛虫肌幼虫与对照组相比基因转录水平降低72.82%,可见siRNA-881 对于TsGLS 基因沉默效果随传代而下降,推测基因沉默效果将会于子三代及子四代旋毛虫肌幼虫减至更弱或完全消失,因此,如何在传代过程中保持TsGLS 基因沉默效果将是后续研究的重点。
本研究通过siRNA-881 干扰TsGLS 基因表达首次证实,谷氨酰胺酶在酸性条件下对旋毛虫肌幼虫的耐酸性起重要作用,RNA 干扰技术可使旋毛虫肌幼虫耐酸能力降低,该研究结果为旋毛虫病的预防提供新思路。
