鲍曼不动杆菌耐药性与外排泵机制及群体信号系统基因检测分析
2022-03-22帅朝霞
帅朝霞 钟 峰 许 岩 吴 竞
鲍曼不动杆菌(Acinetobacter baumannii,AB)属专性需氧的非发酵革兰阴性杆菌,广泛分布于自然界并定植在人体体表及与外界相通的呼吸道、消化道等腔道内,是造成院内感染的重要机会性致病菌[1]。通常能够引起患者呼吸系统感染、泌尿系统感染、手术部位及侵入性操作后感染,特别是重症监护病区的患者存在感染多重耐药AB的风险[2-3]。根据全国细菌耐药监测网2019年数据[4]显示,AB对碳青霉烯类药物的耐药率达到56%,部分地区更是达到78.6%,同时,多重耐药率也在逐年上升。AB的耐药机制主要包括产β-内酰胺酶、氨基糖苷修饰酶、16S rRNA甲基化酶,以及主动外排泵机制等[5-6]。 随着临床多重耐药(multidrug-resistance,MDR)、碳青霉烯类耐药(carbapenem-resistance,CR)和泛耐药(extensively drug-resistant,XDR)AB菌株,以及高致病性。高毒力的AB出现,所致的社区及院内感染暴发流行给临床治疗带来了极大的困难,研究抗菌药物的治疗方案已成为全球公共卫生系统关注的重大问题。AB群体感应系统(quorum sensingsystem,QS)主要包括信号分子合成酶(Aba I)和转录调节蛋白(Aba R),目前已有研究[7]表明AB耐药性与QS具有相关性。同时,外排泵系统基因高表达也是AB主要的耐药机制之一。本研究通过分析CR-AB、MDR-AB和非多重耐药AB中主动外排泵基因ade B、ade J、abe S、abe M及QS相关基因Aba I、Aba R的分布,探讨不同耐药AB耐药性与外排泵基因及QS系统的关系特点,为临床制定用药方案及院感防控提供参考和帮助。
1 材料与方法
1.1 菌株来源 采集2018年1月至 2021年7月皖南医学院第二附属医院临床分离的130 株AB菌(去除同一患者同标本重复菌株),其中痰液标本93株、肺泡灌洗液标本10 株、咽拭子标本9株、尿液标本9株、分泌物标本7株、血培养标本2株。临床分离的AB菌株均经全自动细菌鉴定药敏分析仪鉴定。药敏质控菌株:大肠埃希菌 ATCC25922、铜绿假单胞菌(ATCC 27853)、金黄色葡萄球菌(ATCC 29213),均来自安徽省耐药监测中心。
1.2 主要仪器试剂 VITEK2 Compact 全自动细菌鉴定药敏分析仪(法国Bio Mérieux),凝胶成像仪、PCR 仪(美国Bio-Rad),生物安全柜HR40-IIA2(海尔生物医疗),双向电泳分析仪(北京六一仪器厂),高压灭菌锅(上海博迅),PCR 反应试剂(宝生物工程),电泳琼脂糖(上海生工),GN、AST-GN13(法国Bio Mérieux )。
1.3 菌株鉴定和药敏试验 临床分离的130株菌株经 VITEK2-Compact 全自动细菌鉴定药敏分析仪进行鉴定确认为AB后,按菌株的耐药性分为多重耐药AB组31株(23.85%)、碳青霉烯类耐药AB组43株(33.08%)、非多重耐药AB组56株(43.07%)。其中多重耐药鲍曼不动杆菌(MDR-AB)指对3类及3类以上抗菌药物耐药的AB,碳青霉烯类耐药AB(CR-AB)指对亚胺培南或美罗培南任一药物耐药的AB。
1.4 AB外排泵基因及QS系统相关基因检测 采用煮沸法提取二次活化后细菌的DNA,接种环挑取菌落于600 μL缓冲液后震荡混匀,100℃煮沸15 min,冷却后离心10 min,将得到的上清液DNA浓度调整为50~100 ng/μL作为模板备用。PCR反应体系:模板2 μL、上游引物1 μL、下游引物1 μL、Premix 10 μL去离子水6 μL,总反应体积20 μL。扩增反应条件:Aba I 预变性94℃ 5 min,94℃变性30 s,60℃退火30 s,72℃延伸1 min,30个循环后,72℃延伸5 min。Aba R预变性94℃ 5 min,94℃变性30 s,47℃退火30 s,72℃延伸1 min,30个循环后,72℃延伸5 min。ade B 和ade J 预变性94℃ 5 min,95℃变性1 min,54℃退火30 s,72℃延伸1 min,30个循环后,72℃延伸5 min。abe M 和abe S预变性94℃ 5 min,95℃变性1 min,56℃退火30 s,72℃延伸1 min,30个循环后,72℃延伸5 min。所用引物见表1。PCR产物经琼脂糖凝胶电泳恒压120 V,电流70 mA,30 min。取出凝胶放入凝胶成像仪中观察并记录。将扩增阳性产物送到上海生工生物工程有限公司进行测序,测序结果在Gene Bank 比对。

表1 AB外排泵基因及QS系统相关基因引物序列及产物大小
1.5 统计学方法 采用 SPSS 22.0进行统计分析。计数资料以例数或百分比表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同耐药性AB的构成比及药敏分析结果 130株AB中,非多重耐药Ab(56株)对测试药物耐药率均低于15%,其中对氨基糖苷类、碳青霉烯类、四环素类及多肽类抗菌药物均无耐药性。多重耐药AB(31株)对多数抗菌药物均出现较高耐药率,对头孢他啶、复方新诺明、哌拉西林/他唑巴坦的耐药率均大于85%,对替加环素耐药率为14.29%,多粘菌素无耐药性。碳青霉烯类耐药AB(43株)对头孢他啶、头孢曲松、庆大霉素、环丙沙星、哌拉西林/他唑巴坦耐药率较高,均超过85%,对多粘菌素无耐药性。见表2。
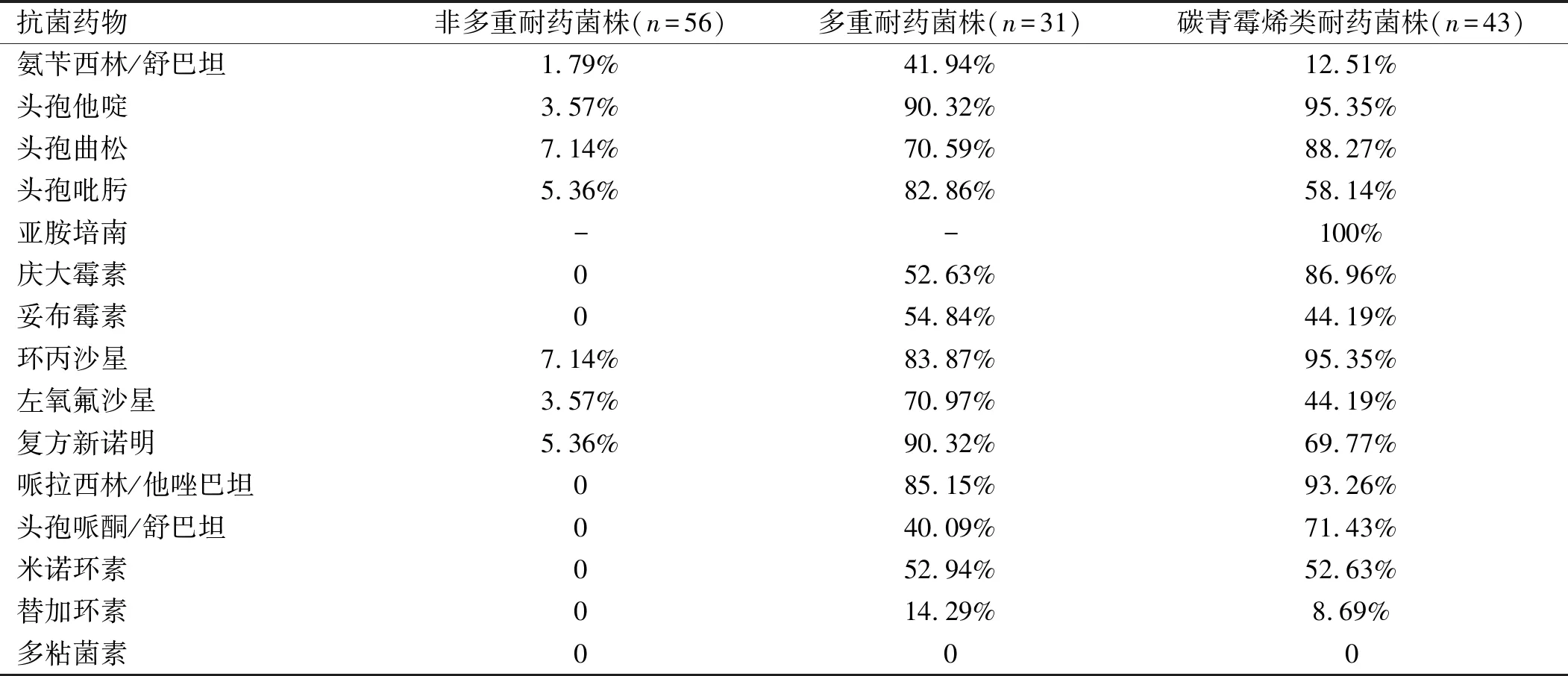
表2 3组不同耐药AB菌株药敏分析
2.2 AB外排泵基因及群体信号系统相关基因分布 PCR检测130株不同耐药AB外排泵基因及群体信号系统相关基因,其中ade B检出率为43.85%(57株),ade J检出率为48.46% (63株), abe M检出率为48.46%(63株),abe S 检出率为46.15%(60株) ,Aba I 检出率为46.15%(60株),Aba R 检出率为48.46%(63株)。见表3。在非多重耐药菌株中,携带外排泵基因及群体信号系统基因率均低于多重耐药菌株及碳青霉烯类耐药菌株。群体信号系统基因Aba I、Aba R在多重耐药菌株中检出率较碳青霉烯类耐药菌株明显增高,差异有统计学意义(χ2=6.049、6.188,P均<0.05)。 PCR 扩增的经琼脂糖凝胶电泳图见图 1。
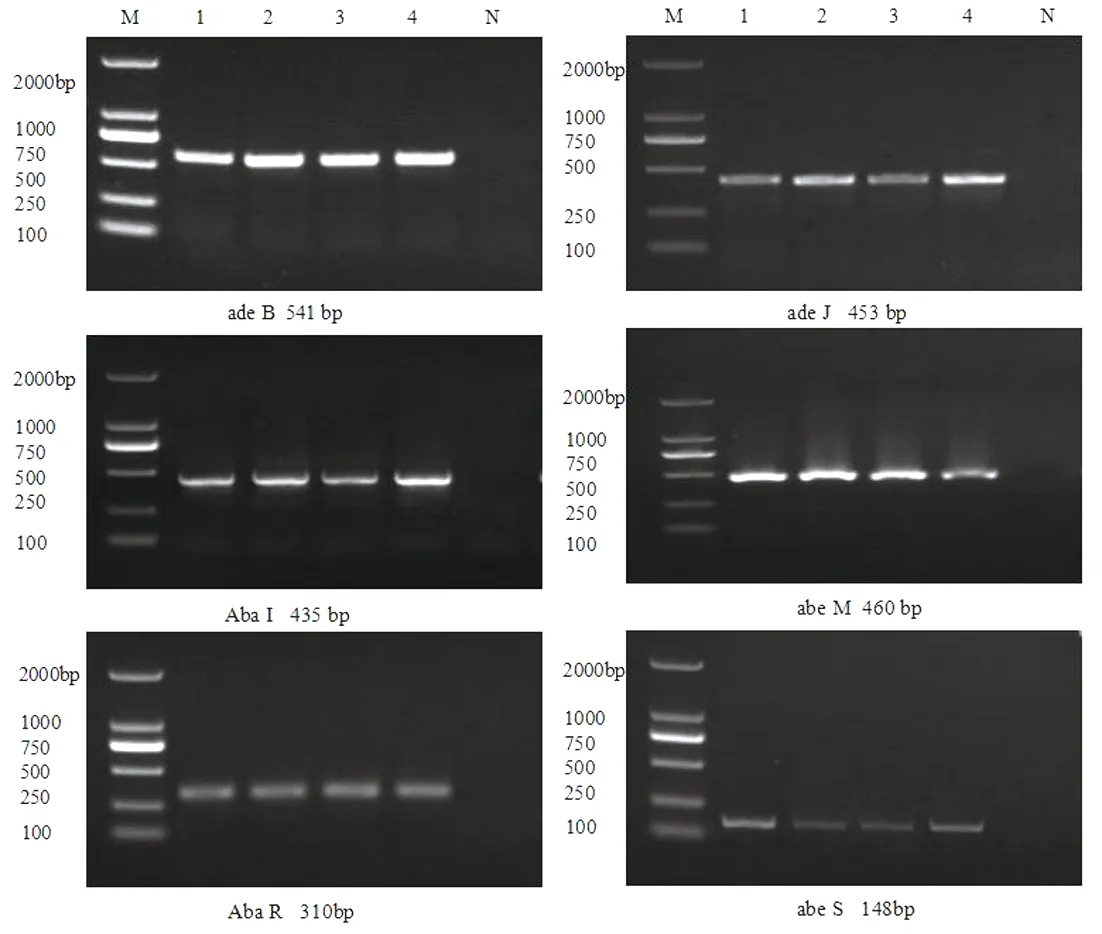
注:M为DNAMarker;N为阴性对照;1~4为DNA扩增阳性菌株。
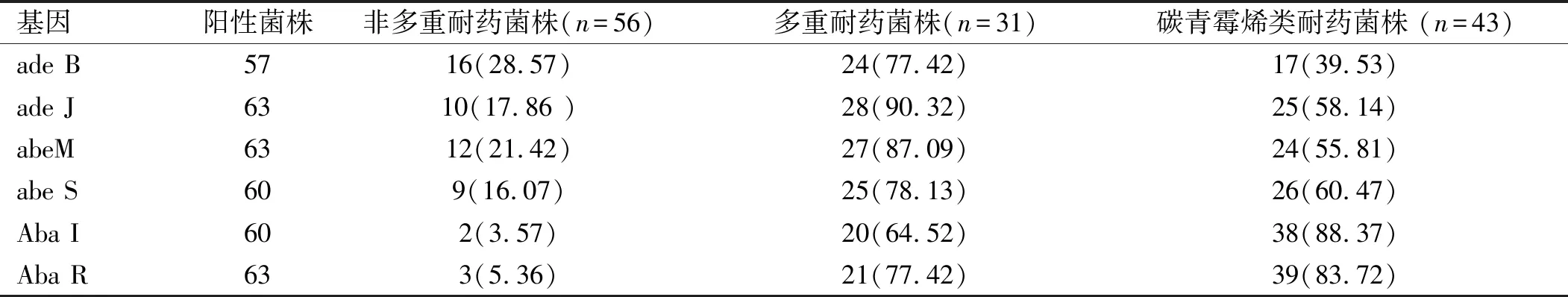
表3 3组外排泵基因及群体信号系统基因分布[株(%)]
2.3 携带外排泵基因及群体信号系统基因AB的耐药性分析 PCR检测130株携带不同外排泵基因及群体信号系统基因的AB耐药性均有差异,其中含有外排泵基因ade B、ade J、abe M、abe S的AB耐药性明显高于不含上述基因的AB,其中以头孢菌素类耐药率的差异最为明显(P均<0.05)。携带有Aba I、Aba R基因的AB对碳青霉烯类抗菌药物的耐药率较不含有该基因AB的耐药率明显增高,差异具有统计学意义(P均<0.01)。见表4。

表4 携带外排泵基因及群体信号系统基因AB的耐药性分析
3 讨论
AB是一种需氧的革兰阴性条件致病菌,广泛存在于医院环境中,由于具有较强的存活力和抵抗力,临床感染已经成为全球医院需要解决的难题。根据全国细菌耐药监测网2014~2019年细菌耐药性监测报告[8],2019年AB对亚胺培南和美罗培南的耐药率为55.5%、57.1% ,且多重耐药和泛耐药的菌株分离率持续增加,同时 SENTRY 耐药监测数据显示,欧洲地区 1997至2016 年AB对亚胺培南和美罗培南的耐药率分别为 60.6%和 64.4%,AB的耐药形势日趋严重[9],已给临床的治疗带来了严峻的挑战。多粘菌素和替加环素是治疗多重耐药乃至泛耐药的AB的“最后防线”,但是目前多粘菌素和替加环素耐药的AB在临床上的分离率正逐渐升高。
目前,在AB中报道的主动外排泵系统有Ade ABC、Ade IJK、Ade FGH、Ade DE、Ade XYZ、Abe M、Abe S 等,外排泵可将已在细菌体内的药物泵出至细菌体外,导致胞内抗生素药物浓度降低,从而导致药物杀菌作用减弱[10-12]。同时,细菌的群体感应系统是一种细菌之间的通信过程,使细菌能够共同改变行为,以响应周围微生物群落的细胞密度和物种组成的变化,AB群体感应系统主要由 Aba I(信号分子合成酶)和 Aba R(转录调节蛋白)构成,当前已有研究[13-16]表明,AB群体感应与其运动性、抗生素抗性、生存特性和生物膜形成有关。本研究发现,多重耐药菌株及碳青霉烯类耐药菌株携带外排泵基因ade B、ade J、 abe M 、abe S 和群体信号系统基因Aba I、Aba R明显高于非多重耐药组,检测出带有Aba I、Aba R基因的AB对碳青霉烯类抗菌药物的耐药率较不含有该基因的耐药率明显增高,差异具有统计学意义(P<0.05),提示外排泵基因ade B、ade J、abe M、abe S及群体信号系统基因Aba I、Aba R与细菌耐药性具有相关性。
综上所述,本院耐药的AB主要集中在携带外排泵基因及群体信号系统基因的菌株中,其中,耐碳青霉烯类菌株的群体信号系统在其耐药性中起到重要的作用,应引起院感防控和临床治疗方面的足够重视。
