氮素营养和根瘤菌接种对大豆结瘤固氮和生长的影响
2022-03-22王晓丽岳爱琴郭数进王利祥杨婷婷张海生张永坡高春艳张武霞牛景萍杜维俊赵晋忠
王晓丽,王 敏,岳爱琴,郭数进,王 鹏,王利祥,杨婷婷,张海生,张永坡,高春艳,张武霞,牛景萍,杜维俊,赵晋忠
(1.山西农业大学 农学院,山西 太谷 030801;2.山西农业大学 基础部,山西 太谷 030801;3.山西农业大学 生命科学学院,山西 太谷 030801)
氮素是植物生长发育所必需的大量元素之一,在植物的生长发育、产量和品质形成过程中起着至关重要的作用[1]。因此,提高氮素吸收效率、适当增施氮肥是大豆高产稳产的重要保障。当氮素供应不足时,植物新陈代谢发生紊乱,体内物质合成和转化受到影响,氮素利用下降,生长发育会受到影响。Chun等[2]研究表明,在低氮诱导下,水稻中叶片的生长素含量上升,另外,根长、根的密度和根冠比增加。低氮胁迫导致植物叶片的光合作用受到抑制,从而导致产量下降。李强等[3]研究表明,耐低氮玉米能够缓解低氮胁迫对光合作用的影响,从而使得较高的氮素含量在植物体内积累。孙年喜等[4]研究表明,不同氮素水平对玉米光合特性具有不同的影响,随着供氮水平的增加,其光合速率和叶绿素值(SPAD值)均呈现逐渐下降趋势。当植物受到低氮环境胁迫时,可将氮素从衰老的叶片中运输到较年轻的叶片中,从老叶中输出的氨基酸用于正在发育中的幼叶中酶、核苷酶、叶绿素和调节蛋白等物质的合成,以维持植物正常生长发育[5]。
豆科植物不仅可以从大气土壤中吸收氮素营养,还能够与根瘤菌共生固氮,为其自身提供氮素。大豆作为重要的共生固氮粮食作物,其生长所需氮素营养的50%~90%是由根瘤菌-大豆共生体系固定的,接种根瘤菌后其种子周围和土壤中的根瘤菌数量增加,其根部能够获得更多根瘤,进而提高作物产量[6]。梁福琴等[7]研究表明,在大豆中,当氮素与根瘤菌共同作用时,其生理指标能够达到最佳值,使得大豆获得丰产。研究表明,大豆播种前施用适量氮肥,能够促进根瘤原基形成和根瘤生长,提高土壤中根瘤菌性能,促进植株生长,为共生固氮提供有效的碳汇和能量汇[8]。因此,在氮素循环中,豆科作物与根瘤菌共生固氮互作体系充当着非常重要的角色。研究发现,轻度缺失硝态氮的情况下能促进根系生长,重度缺失硝态氮或硝态氮浓度较高时会抑制根系生长[9]。而豆科植物共生固氮的特点使其有别于其他植物,Gan等[10]研究不同氮浓度对大豆结瘤性状的影响发现,氮浓度高于10 mmol/L时,无论供氮形式是硝态氮、铵态氮还是硝酸铵,均显著降低了大豆根瘤数、根瘤质量以及总固氮量,硝态氮对根瘤生长发育及固氮酶活性抑制作用较铵态氮更强。
大豆既可通过主动运输的方式吸收利用外界氮素营养,也可通过其根部特化组织根瘤进行共生固氮(Symbiotic nitrogen fixation,SNF),获取氮素营养[11]。目前,豆科植物氮素营养的吸收和根瘤菌接种对大豆结瘤固氮和生长的影响鲜有研究。
本研究通过对大豆不同浓度氮处理及接种根瘤菌剂同时处理,以探究大豆结瘤固氮情况和不同组织器官中氮素积累情况以及对叶表型性状的影响,旨在为大豆氮素高效利用提供科学依据。
1 材料和方法
1.1 试验材料
供试大豆品种为Williams 82;大豆根瘤菌株(Bradyrhizobiumjaponicum)采用中国农业大学CCBAU提供的USDA110。
1.2 试验方法
试验在山西农业大学大豆温室进行。
1.2.1 根瘤菌株的活化 在超净工作台中,用接种环挑取1环甘油菌在YMA培养基上划线,倒置于28 ℃培养箱培养;后挑取1环活化后的菌株接种至装有200 mL YMA培养液的500 mL锥形瓶中,并于28 ℃、160 r/min的恒温振荡培养箱中进行培养,每隔1 d观察根瘤菌株USDA110培养液浑浊情况,需要培养5 d左右。
1.2.2 不同氮浓度处理 根据大豆生长发育所需氮素营养,以KNO3为氮源,分别设置无氮(0 mmol/L,NN)、低氮(0.25 mmol/L,LN)和高氮(10 mmol/L,HN)3个不同浓度的硝酸盐营养液,将Williams 82分别种植在含有不同浓度硝酸盐营养液浸湿的蛭石基质中,均以不接菌为对照,3次重复。
1.2.3 接种根瘤菌处理 蛭石灭菌装入10 cm×10 cm的营养钵中。将大豆Williams 82于92%的酒精中灭菌5 min,再用5%的NaClO进行表面消毒5 min,之后用无菌水清洗10次,于营养液浸湿的蛭石中发芽(基础营养液配制参照文献[12])。7 d之后进行间苗,每个营养钵留有2株长势一致的大豆,放置于光照培养箱中进行培养,16 h光/8 h暗,光照温度25 ℃,黑暗温度16 ℃,光照强度10 000 lx,相对湿度70%;待第1片真叶完全展开后,将大豆慢生根瘤菌USDA110(OD600=0.08)轻轻接在大豆幼苗根系周围,每株大豆接30 mL菌液,分别在接菌后0.5 h(根毛识别根瘤菌)、1 d(根毛卷曲)、4 d(结瘤原基形成)、16 d、28 d(2个结瘤早期发育时期)[13]观察其结瘤情况,取叶片、根、根瘤样品,测定每个植株的根干质量、根瘤数、根瘤干质量,以不接菌为对照,接种USDA110作参照菌株,3次生物学重复。
1.3 测定项目及方法
1.3.1 叶形态特征的测定 植物样品叶片形态特征采用智能叶面积测量系统(YMJ-C/CH)进行测定。
1.3.2 氮含量的测定 试验样品氮含量测定采用国家标准方法凯氏定氮法进行。将样品放置在烘箱中105 ℃杀青30 min,80 ℃烘干,称取等质量样品,用球磨仪将样品粉碎,过200 mm筛备用。取样品0.1 g置于消化管底部,以硫酸铜和硝酸钾作为催化剂,向消化管中加入3 g的混合催化剂,然后加入5 mL浓硫酸摇匀,消解植物样品;待消煮管中液体呈现绿色透明颜色时,将消煮管取下进行凯氏定氮法测定氮含量,在高温下将植物叶片中的含氮化合物转变为硫酸铵,然后用氢氧化钠碱化,加热蒸馏出氨,此时消化管中液体颜色为褐色表明反应完全,经硼酸吸收后,用硫酸标准溶液滴定,计算含氮量。
1.4 数据分析
采用SPSS 19.0和Excel 2016对数据进行统计分析;采用R语言进行作图;使用CS 6.0对试验图片进行编辑。
2 结果与分析
2.1 不同施氮水平接种根瘤菌对大豆根瘤数目、根瘤干质量和根干质量的影响
待第1片真叶完全展开后,对不同氮浓度处理的大豆实生苗接种根瘤菌,28 d后观察其表型,结果显示(图1),接种根瘤菌后的结瘤情况表现为NN>LN>HN,无氮接菌下结瘤数最多,随着氮浓度的增加,根瘤数逐渐减少。此外,不同氮浓度下根瘤数目和根瘤干质量均呈现相同的变化趋势,无氮处理显著高于低氮处理(P<0.05),低氮处理显著高于高氮处理(P<0.05)(表1);而根干质量呈现相反的变化趋势,无论接菌与不接菌,高氮处理下根干质量均显著高于低氮和无氮处理(P<0.05),而在低氮和无氮处理间则不存在显著差异。由不同氮浓度接种根瘤菌对大豆根系的影响数据表明,不同施氮水平对根瘤数目、根瘤干质量和根干质量都有不同程度的影响。
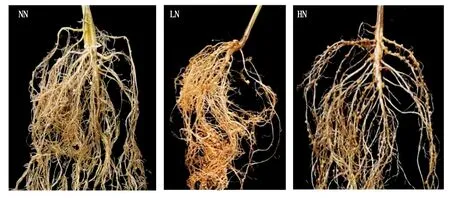
图1 不同氮浓度处理下接种根瘤菌的结瘤情况Fig.1 Nodular situation of rhizobia inoculated under different nitrogen concentrations

表1 不同氮浓度下接种根瘤菌对大豆根部的影响Tab.1 Effect of inoculation of rhizobia with different nitrogen concentration on soybean root
2.2 不同氮水平下接种根瘤菌大豆植株氮素积累变化
在不同施氮水平下,大豆不同器官氮素含量在接种和不接种间表现出不同的变化趋势,且不同器官氮素含量整体呈现叶>根>茎的现象(图2)。对于叶组织中氮素含量而言,无论接菌与不接菌,高氮处理下叶组织的氮素含量均显著高于低氮处理(P<0.05),而在不接菌的情况下,低氮处理下的氮素含量显著高于无氮处理(P<0.05),接菌后二者之间差异不显著;对于茎组织的氮素含量,无论接菌与不接菌,其氮素含量在不同氮浓度处理下表现为相同的变化趋势,即高氮>低氮>无氮,且差异均达显著水平(P<0.05)。根组织中的氮素含量变化趋势与叶组织一致。
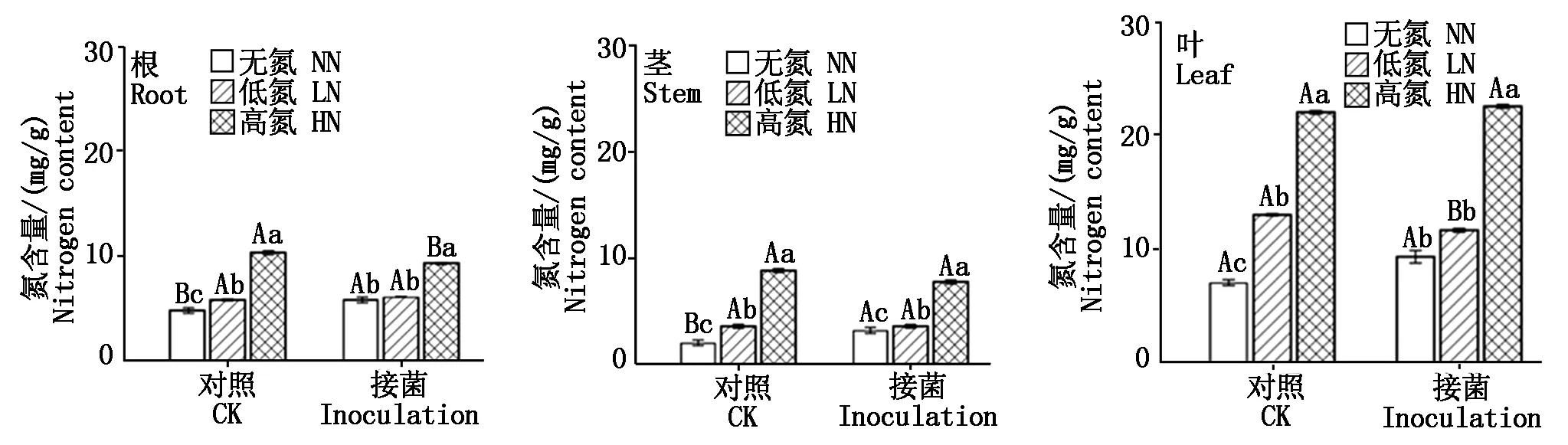
不同小写字母表示接菌或不接菌下不同氮水平上存在显著差异(P<0.05);不同大写字母表示同一氮水平上接菌和不接菌间存在显著差异(P<0.05)。Different lowercase letters indicated significant differences between inoculated and non-inoculated nitrogen levels(P<0.05);Different capital letters indicated significant differences between inoculated and non-inoculated at the same nitrogen level(P<0.05).
2.3 不同氮素水平条件下接种根瘤菌不同叶位叶绿素值(SPAD)的变化
由图3可知,不同处理条件下,不同叶位SPAD值均呈现不同的变化趋势。除了在接菌下,第1叶的SPAD值表现为HN>LN>NN,且存在显著差异(P<0.05)外,其他叶位的SPAD值在不同氮水平处理下均为高氮处理显著高于低氮和无氮处理(P<0.05),而在低氮和无氮处理之间不存在显著差异。此外,不同叶位之间SPAD值在不同氮素水平下也呈现出不同的变化趋势,其中,在无氮水平下,SPAD值依次为第1对真叶>第1叶>第2叶,且彼此之间存在显著差异(P<0.05);无论在接菌还是不接菌在低氮水平下,第1对真叶和第1叶时SPAD值显著高于第2叶(P<0.05),而在第1对真叶和第1叶之间差异不显著;在接菌情况下,高氮处理的SPAD值在第1叶中含量显著高于第1对真叶和第2叶(P<0.05),说明高氮处理可以促进地上部氮素向第1叶转运。无论是在不同氮素水平上,还是不同叶位之间,接菌与不接菌都呈现相同的变化趋势,说明接菌不影响叶片之间氮素的转运。

不同小写字母表示同一氮水平上不同叶位间存在显著差异(P<0.05);不同大写字母表示同一叶位上不同氮水平间存在显著差异(P<0.05)。Different lowercase letters indicated significant differences between different leaf positions at the same nitrogen level(P<0.05);Different capital letters indicated significant differences between different nitrogen levels at the same leaf position(P<0.05).
从图4植株的生长状况也可以看出,高氮处理下植株的长势明显优于无氮和低氮处理,且从叶片的颜色也可以看出,无氮和低氮处理叶片整体发黄,而在高氮处理下,叶片呈现青绿色,尤其是第1叶更为明显,这也与图3结果相吻合。

图4 不同氮水平条件下接菌后的植株生长Fig.4 Plant growth after inoculation under different nitrogen levels
2.4 不同氮素水平下接种根瘤菌叶形态指标的变化
由表2可知,在不接菌情况下,不同叶位在不同氮素水平上叶形态指标均呈现相同的变化趋势,叶面积、叶周长、叶长和叶宽在低氮和高氮处理均显著高于无氮处理(P<0.05);在接菌情况下,第1对真叶形态指标在不同氮素水平上呈现HN>NN>LN,而第1叶叶面积、叶周长和叶宽在不同氮素水平上没有显著差异,第1叶叶长在无氮水平下显著高于低氮(P<0.05)。在不接菌情况下,叶长在低氮和高氮水平下显著高于无氮处理(P<0.05);第2叶的叶面积、叶周长、叶长、叶宽在低氮和高氮水平下均显著高于无氮(P<0.05)。此外,在同一氮素水平上,不同叶位的叶形态也表现出不同的变化趋势,在不接菌情况下,无氮处理条件下除了叶长呈现第1叶>第1对真叶>第2叶外,其他叶形态指标(叶面积、叶周长、叶宽)均表现为第1对真叶和第1叶显著高于第2叶(P<0.05),且第1对真叶和第1叶之间差异不显著;而在低氮和高氮处理下,不同叶位之间的叶形态指标(叶面积、叶周长、叶长、叶宽)均差异不显著;在接菌情况下,在无氮处理下,第1叶的叶面积、叶周长均显著高于第1对真叶和第2叶(P<0.05),第1叶的叶长显著高于第1对真叶,第1叶的叶宽显著高于第2叶(P<0.05),而在高氮处理下,不同叶位之间差异不显著。

表2 不同处理下不同叶位的叶形态指标的变化Tab.2 Leaf morphological indexes changes of different leaf positions under different treatments
3 结论与讨论
有研究表明,根瘤数目和质量与施氮量的增加呈负相关[14];但当外源氮素水平较高时,会对结瘤起到抑制作用[15]。本研究为了研究不同氮素水平下接种根瘤菌对大豆根部及其结瘤的影响,在幼苗期接种根瘤菌28 d后,对根干质量、根瘤性状与植物各组织氮含量进行测定表明,随着施氮量的增加根瘤数逐渐减少,无氮处理下根瘤最多,高氮处理下根瘤最少;在高氮处理下,大豆根瘤出现氮阻遏现象,可能是由于氮素浓度过高,破坏了根瘤菌菌体结构,降低了固氮酶的活性,抑制了根瘤的生长,这与郑永美等[16]的研究结果相一致。此外,过度结瘤会导致中午光合作用降低,从而降低总根向蒸发组织提供水的能力。能够结瘤的豆科植物通过蒸腾作用弥补水分损失的能力有限,导致气孔关闭,从而降低光合速率[17];在这种情况下,寄主植物和根瘤之间争夺碳水化合物的竞争会加剧,导致植物生长和种子产量进一步下降[18]。事实上,大豆结瘤固氮和氨同化需要大量的光合作用产物,以提供根系结瘤所增加的呼吸负担和氮有机合成所需的碳骨架[19]。无氮处理的根干质量最小,根瘤数最多,而高氮处理的根干质量最大,根瘤数最少。随着氮浓度的增加,根干质量与根瘤数呈负相关,这可能与大豆植株结瘤减少了根系生物量有关。有报道表明,根瘤是较强的碳水化合物汇,因此,根瘤可以减少糖向根细胞的转运,减少根系的生长[20]。
大豆在生育前期,子叶所含的氮素不足以支持大豆生长发育,而根瘤的固氮作用尚未完全建成,在短时间内会出现氮素的缺乏,因此,要通过氮素的添加来满足大豆生长发育[21]。本研究表明,无论在根、茎还是叶中,氮含量在高氮处理时均大于低氮处理,低氮处理大于无氮处理。在大豆苗期时,施氮能够明显增加大豆植株前期的氮素积累,氮浓度越高促进效果越明显[22]。不管是接菌还是不接菌处理,叶中氮含量均大于根中氮含量,根中氮含量均大于茎中氮含量。叶绿体是进行光合作用的场所,氮素是叶绿素的重要组成成分,适当增施氮肥有利于叶绿素的合成,研究表明,叶绿素含量越高,氮含量越高[23]。不接菌时,低氮处理的叶和茎的氮含量显著高于无氮处理,接菌后,低氮处理茎的氮含量显著高于无氮处理,此时根瘤开始固氮,并向地上部运输。Sun等[24]研究表明,低氮胁迫会抑制植物叶片的光合作用,叶片所吸收的光能产生了过量的活性氧和丙二醛等物质,使植物体内活性氧代谢失调,生物膜结构系统遭到破坏,植物最终失去光合能力。
有研究表明,较高的叶片氮含量,能够提高叶绿素含量并参与光合电子传递的蛋白质水平,提高初级光化学反应的效率和光合能力[25]。本研究中,在不同叶位,不同接菌处理条件下,高氮处理的SPAD值最大,叶片墨绿,植株高大;低氮与无氮处理,植株矮小,叶片发黄,分枝变少,这是由于当氮素供给不足时,植株体内核酸、叶绿素、蛋白质合成受到阻碍,导致植物出现缺绿症;降低其光合速率及光合产量。研究表明,氮含量越大,叶绿素含量越大,SPAD值越大[9]。在氮诱导下,氮的积累根据植株叶片生长程度的不同而存在差别,具体表现为成长中叶片(第1叶)>新生叶片(第2叶)>成熟叶片(第1对真叶),植株氮素构成的变化直接影响着新生茎、叶氮素构成变化,老叶通过叶肉降解,提供给幼叶营养物质,维持幼叶正常生长发育[26]。无氮处理下,不同叶位的SPAD值自下而上依次递减,此时,由共生固氮合成的氮素逐渐向缺氮部位转运。另外,叶片性状是决定植物品质的重要因素,主要包括叶面积、叶周长、叶长、叶宽等[27]。有研究表明,良好的群体叶面积指数、叶面积持续时间(光合面积持续期)、光合势是大豆获得高产的基础[28]。本研究中,第1叶的叶片性状最好,与其SPAD值相吻合。在无氮处理条件下,接菌之后,不同叶位叶面积均显著增加,高于低氮接菌处理;在低氮和高氮处理条件下,接菌之后,叶面积均减少。研究表明,更多的结瘤提供的更高的氮利用率(氮含量)可以促进植物的生长,因为生物量的产生依赖于氮来合成多种分子,如叶绿素和Rubisco,以及蛋白质、核酸和各种酶辅助因子[29]。
综上所述,大豆共生固氮不需要外界施加过量氮素营养,施氮量越多,根瘤数越少,共生固氮效果越差。根瘤可以减少糖向根细胞的转运,减少根系的生长;施氮量越多,根瘤数越少,根干质量越大。在大豆苗期,施氮能够明显增加大豆植株前期的氮素积累,促进叶表型性状,氮浓度越高促进效果越明显,适当增加氮素营养可以提高大豆各器官中氮素的积累量。
