转录因子SlMYB-related 2对番茄耐冷性的影响
2022-03-22吴红红段学粉郭仰东张喜春
吴红红,段学粉,郭仰东,张喜春
(1.北京农学院 植物科学技术学院,北京市蔬菜遗传育种与生物技术实验室,北京 102206;2.中国农业大学 园艺学院,北京 100094)
番茄(SolanumlycopersicumL.)是茄科(Solanaceae)番茄属(Lycopersicon)一年或多年生植物,在北方日光温室冬春茬番茄生产中,夜间低温是影响番茄植株生长最敏感的因素之一[1-2]。番茄生产经常遭受低温冷害而降低经济效益,影响产业发展[3]。
在植物生长发育过程中,MYB转录因子可以广泛调控植物的生物和非生物胁迫,其可以与其他相关转录因子协同作用,特异激活防御相关基因的表达,在基因调控网络中是其他调控因子的中间靶标。因而,通过调节转录因子活性来改良植物的综合抗逆性是一种很有潜力的方法。CRISPR/Cas9(Clustered regularly interspaced short palindromic repeats/CRISPR associated systems)是来源于原核生物的适应性病毒技术。在自然界中,当病毒入侵时,CRISPR系统表达Cas蛋白和与病毒基因组互补的guide RNA,guide RNA引导Cas蛋白结合到对应病毒基因组切割DNA,进而抑制病毒,起到防御作用[4],近几年在植物基因编辑研究中应用得越来越广泛。2019年,Yuan等[5]率先通过CRISPR/Cas9技术对花生的脂肪酸去饱和酶基因ahFAD2进行突变,实现了对花生的基因编辑。2020年,Dong等[6]通过CRISPR/Cas9技术实现在水稻基因组中的安全位置插入了5.2 kb类胡萝卜素生物合成元件,结果表明,该水稻种子中的类胡萝卜素含量高,并且形态及产量特性与野生型相似,为在作物中精确的基因敲入提供了思路。Zhou等[7]针对J809、L237和CNXJ这3个优质水稻品种进行产量相关性状基因的QTL定位,发现了影响籽粒大小相关的基因GS3、长度和质量相关的基因GW2(Grain width and weight gene 2)和数量相关的基因Gn1a,利用CRISPR/Cas9技术对3个基因进行靶向编辑,使得水稻品种J809和L237的三重突变体的单穗产量分别增加了68%和30%。Zaman等[8]利用CRISPR/Cas9技术定向敲除影响油菜荚果形状和大小的JAG(Jagged gene)同源基因JAG.A08,所得突变体与野生型比较,荚果开裂区发生显著变化,荚果细胞变大,果实凹凸不平,体积变小,抗碎荚性提高了2倍。
病毒诱导的基因沉默(Virus-induced gene silencing,VIGS)是一种快速鉴定基因功能的方法,近年来在植物基因功能研究中应用广泛。宋恬等[9]首次在扁桃花器官上建立了以TRV为载体的VIGS沉默体系,成功用携带pTRV2-AcCBF1的农杆菌侵染扁桃花器官且出现沉默效果。邱润霜等[10]以番茄斑萎病毒(Tomatospottedwiltorthotospovirus,TSWV)N构建到pTRV-PTV00载体上,完成了TSWV介导NVIGS载体的构建,开阔了构建病毒内源基因沉默体系的新思路。CRISPR/Cas9技术实现基因编辑有赖于PAM序列,在附近无PAM序列的区域时无法进行编辑[11]。VIGS具备将cDNA文库整合到病毒载体上进行高通量基因筛选分析的优势[12]。VIGS技术可用于不同蔬菜物种间比较基因组学的研究[13]。
本研究根据低温处理前后辐照诱变的番茄抗寒突变体和对照番茄(CK)的转录组测序结果,筛选响应低温胁迫的差异表达基因SlMYB-related2作为研究对象,通过构建CRISPR/Cas9基因敲除载体获得沉默阳性植株,选取SlMYB-related2基因片段,构建VIGS瞬时干扰沉默体载体,获得转基因再生植株,通过对番茄转基因植株抗寒性的测定,进一步研究SlMYB-related2基因的功能,以期为进一步揭示番茄植株抗寒的分子机制以及为选育番茄抗寒品种提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 植物材料 以俄罗斯栽培番茄品种Bolgogragsky(本实验室种质编号25)为供试材料。该品种具有产量高、番茄红素含量高等优点,但不耐低温,易受冷害危害。
1.1.2 菌株、载体、酶和试剂 大肠杆菌菌株DH5α、农杆菌感受态细胞GV3101购自博迈德生物技术有限公司;CRISPR/Cas载体购自杭州百格生物技术有限公司;TRV载体由本实验室保存;CRISPR/Cas载体构建试剂盒购自杭州百格生物技术有限公司;DNA Marker、pLB克隆试剂盒、质粒提取试剂盒均购自天根生化科技有限公司;DNA胶回收和纯化试剂盒购自美国Omega Bio-Tek公司;XbaⅠ、SmaⅠ、rTaqDNA聚合酶、T4DNA连接酶及各种限制性内切酶、PrimeSTAR Max Premix等均购自宝生物(TaKaRa)工程(大连)有限公司。植物激素为Sigma产品;其他生化试剂由本实验室保存。
1.2 试验方法
1.2.1 CRISPR/Cas9基因敲除载体 通过百格网站(www.biogle.cn)在线生成基因的gRNA序列。CRISPR载体带有U6启动子及CaMV35S启动子,后者表达潮霉素抗性基因,靶点序列一般选择19 bp,然后加上AGG,AGG为PAM序列。CRISPR/Cas9载体示意及sgRNA靶位点信息如图1。通过在线软件查询基因的CRISPR靶点引物,引物序列设计如表1所示。制备引物二聚体,将合成的引物加水溶解至10 μmol/L,按照表2体系混合后,95 ℃加热3 min,然后以约0.2 ℃/s的速度缓慢降至20 ℃(可使用PCR仪)。将Target二聚体构建至CRISPR/Cas9载体,按表3体系在冰上混合各个组分,混匀后室温反应1 h。参考标准步骤转化大肠杆菌及农杆菌,大肠杆菌DH5α的转化方法按照说明书进行操作,将单克隆菌液送至公司测序,测序正确的菌液提取质粒转化农杆菌GV3101。

LB.T-DNA左边界;Cas9.优化Cas9;RB.T-DNA右边界;NOS Ter.NOS终止子;U6.拟南芥U6启动子;35S.CaMV 35S启动子;SG.向导RNA;Hygro.潮霉素选择标记;e35S.增强子35S启动子;Poly Ter.PolyA终止子。LB.Left border of T-DNA;Cas9.Optimized Cas9;RB.Right border of T-DNA;NOS Ter.NOS terminator;U6.Arabidopsis U6 promoter;35S.CaMV 35S promoter;SG.sgRNA;Hygro.Hygromycin selection marker;e35S.Enhanced 35S promoter;PolyA Ter.PolyA terminator.

表1 引物序列Tab.1 Primer sequence

表2 引物二聚体反应体系Tab.2 Primer dimer reaction system
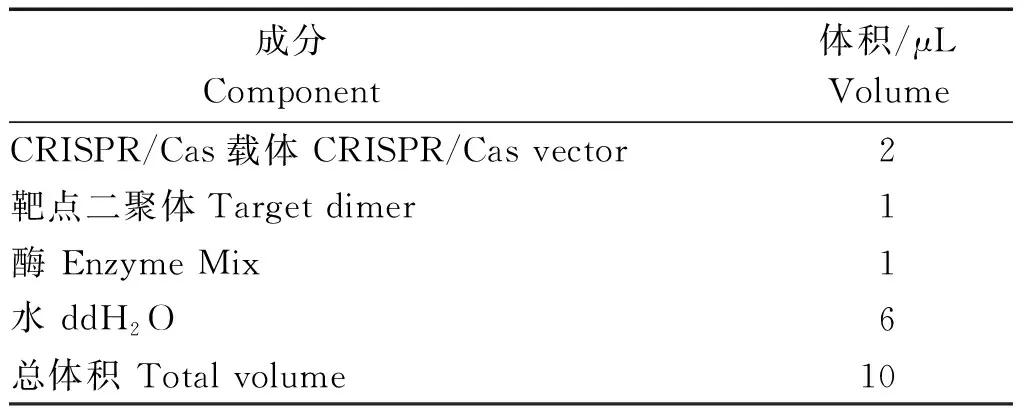
表3 CRISPR双元载体构建Tab.3 Binary vector construction of CRISPR
1.2.2 农杆菌介导法遗传转化番茄 将番茄种子消毒后,播于MS培养基中,于温度25 ℃、光照强度1 600 lx、光照时间16 h/d条件下进行培养,即得无菌苗;于温度25 ℃、光照强度1 600 lx、光照时间16 h/d条件下进行预培养,用MS液体培养基悬浮农杆菌菌体(OD值0.3~0.5)制备成重组菌液;菌液侵染15 min,然后滤纸吸干菌液,放到A2培养基暗培养2 d;然后进行生根培养基的筛选与驯化移栽;最后鉴定并筛选阳性转化苗,进行后续试验。
1.2.3 转基因植株的阳性鉴定 提取再生植株的DNA,以其为模板,根据载体上的潮霉素基因序列设计阳性鉴定引物,进行PCR验证,1%琼脂糖凝胶电泳。
1.2.4 VIGS瞬时沉默表达载体的构建 根据NCBI上提供的番茄SlMYB-related2基因CDS序列,利用Sol Genomics Network在线软件设计SlMYB-related2VIGS特异性表达引物。目的片段用PCR扩增,琼脂糖凝胶电泳回收,回收方法按照试剂盒进行,将纯化回收的目的基因片段转化大肠杆菌DH5α,将菌液送去测序。对测序结果正确的菌液以及含TRV质粒的菌液提取质粒,并用XbaⅠ和SmaⅠ酶切,纯化后用T4连接酶连接,构建TRV-MYB-related2沉默表达载体。质粒提取和纯化方法、酶切和连接体系,转化方法按照试剂盒进行。取3~4叶期番茄幼苗用于VIGS试验,将活化后的菌液用1 mL无针注射器侵染3~4叶期的番茄幼嫩叶片。侵染后,将番茄苗置于人工气候箱中(16 ℃,65%相对湿度)暗培养24 h;后转移至20 ℃、16 h 光照/8 h黑暗、65%相对湿度下培养。侵染植株分组为野生型(WT),野生型携带TRV空载(CK)和SlMYB-related2基因转化组。侵染10 d后,分别提取3组植株嫩叶的总RNA,选取质量较高的RNA进行反转录合成第一链cDNA。以cDNA为模板,以载体上的TRV2F和TRV2R为引物,PCR扩增,验证阳性植株。
1.2.5 低温处理植株的理化指标测定 将番茄植株侵染14 d后,置于4 ℃培养8 h,之后按4 ℃、黑暗8 h/光照16 h、60%相对湿度培养,在低温处理的第0,1,2,3,5,7,9 天分别采集野生型(WT)及其野生型携带TRV空载(CK)、SlMYB-related2基因转化组番茄叶片液氮冻存,用于理化指标丙二醛(MDA)、可溶性糖、游离脯氨酸的测定。丙二醛和可溶性糖含量的测定参照《植物生理学实验教程》[14]和Kong等[15]的方法,略有改动;游离脯氨酸含量的测定参照《植物生理学实验教程》[14]和Ahmad等[16]的方法,略有改动。所有试验均包含至少3个生物学重复,3次数据的平均值即为所得结果。对平均值进行方差分析(ANOVA,F-检验),并且在P<0.05(IBM SPSS®19)水平下使用Duncan多范围测验(DMRT)比较数据的平均值。
2 结果与分析
2.1 CRISPR/Cas9基因敲除载体的构建
将构建好的CRISPR/Cas9基因敲除载体转化大肠杆菌感受态,单菌落进行PCR验证。测序结果准确无误的,提取质粒转化农杆菌。图2为载体测序比对结果,其中未匹配部分为载体序列,选取的基因靶点引物序列为gRNA:5′-CATTGGCATTCCCACCTTGTAGG-3′。

图2 CRISPR/Cas9基因敲除载体序列比对Fig.2 CRISPR/Cas9 gene knockout vector sequence alignment
2.2 CRISPR沉默阳性植株的获得
农杆菌转化结果共获得组培再生植株5株,经PCR验证获得2株阳性植株,结果见图3。引物序列为,F:5′-CGAGAGCCTGACCTATTGCAT-3′和R:5′-CTGCTCCATACAAGCCAACCAC-3′,目标产物长度为481 bp。
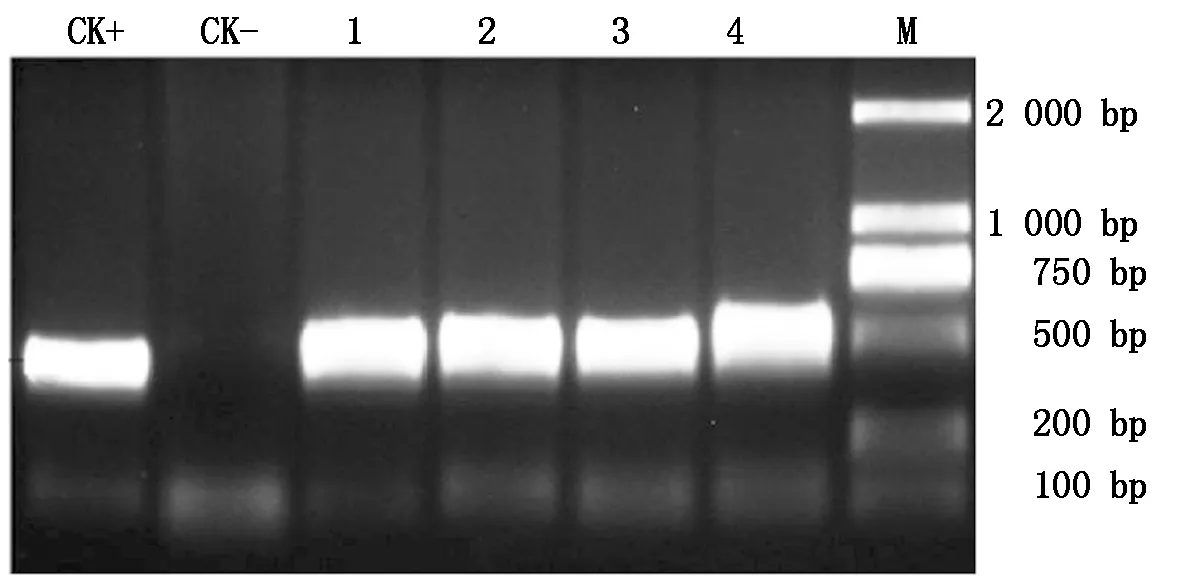
M.Marker;1—2.1号转基因植株;3—4.2号转基因植株。M.Marker;1—2.Transgenic plant 1;3—4.Transgenic plant 2.
2.3 VIGS瞬时沉默表达载体的构建
用XbaⅠ和SmaⅠ酶切野生型携带TRV空载(CK),插入目的基因片段,构建重组表达载体;将载体转化大肠杆菌后,菌液测序结果与基因序列比对无点突变(图4)。

图4 VIGS瞬时沉默表达载体序列比对Fig.4 VIGS transient silence expression vector sequence alignment
2.4 阳性番茄植株鉴定
植株被侵染10 d后,分别提取3组植株上部嫩叶的总RNA,反转录合成cDNA。以cDNA为模板,通过克隆幼苗中的TRV病毒片段来验证阳性植株,用RT-PCR法检测番茄幼苗新生叶中的TRV病毒以验证阳性植株(图5)。经验证,各组阳性植株数量为:携带TRV空载植株(CK)22株;携带TRV-SlMYB-related2质粒植株25株。目的基因长度为520 bp。

M.Marker;1.WT;2、3、4、6、7.TRV阳性;5.TRV阴性。M.Marker;1.WT;2,3,4,6,7.TRV positive;5.TRV negative.
2.5 低温处理沉默转基因植株的理化指标分析
2.5.1 游离脯氨酸含量比较 当植物受到外界低温胁迫时,会加速合成脯氨酸,从而提高植物的抗寒性,脯氨酸含量可作为抗寒育种的生理指标。不同低温处理时间的3组番茄植株的脯氨酸含量的变化水平如图6所示,WT和CK组随处理时间的延长脯氨酸含量逐渐升高,7 d达到最大值且差异显著,然后略有下降,而转基因组的脯氨酸含量1 d达到最大值,之后逐渐下降且均低于WT和CK组。说明转基因组番茄植株遭遇低温胁迫时未能较多地合成脯氨酸,推测SlMYB-related2基因可能与脯氨酸合成有关,通过对SlMYB-related2基因的沉默作用,抑制了脯氨酸的合成。
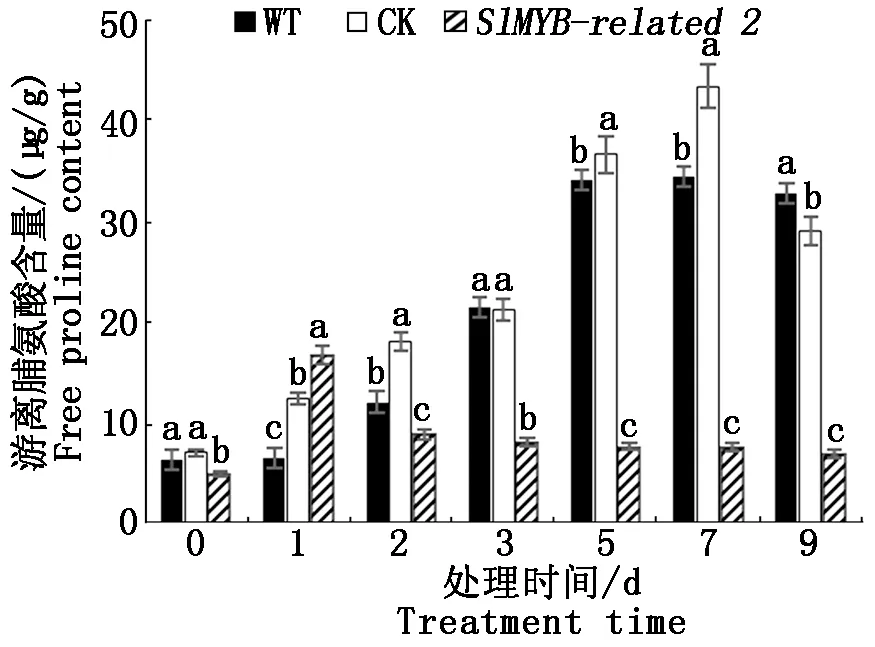
不同小写字母表示0.05水平差异显著性。图7—8同。Different lowercase letters indicate significant differences in0.05 levels. The same as Fig.7—8.
2.5.2 丙二醛含量比较 不同番茄植株在不同低温处理时间下丙二醛含量的变化如图7所示,WT和CK以及转基因组的丙二醛含量均有显著性变化,其中在5~9 d转基因组显著高于WT和CK(P<0.05)。说明转基因组的细胞膜损伤大于野生型和CK,低温胁迫可能在一定程度上诱发了野生型和对照组植株对细胞膜损伤的修复。

图7 不同植株材料丙二醛含量比较Fig.7 Comparison of malondialdehyde content in different plant materials
2.5.3 可溶性糖含量比较 不同番茄植株在不同低温处理时间下可溶性糖含量的变化如图8所示,WT和CK以及转基因组的可溶性糖含量均有显著性变化,其中在处理5,7,9 d,WT和CK均显著高于转基因组(P<0.05)。说明随低温处理时间的延长,转基因组的可溶性糖含量增长趋势慢于WT和CK,即转基因植株的耐寒性低于WT和CK。
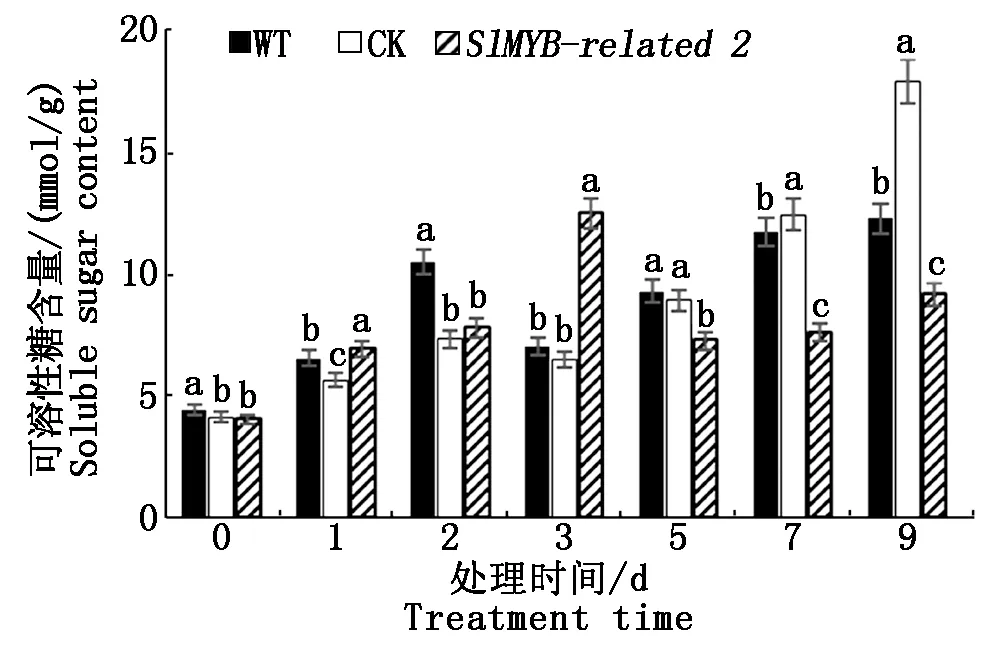
图8 不同植株材料可溶性糖含量比较Fig.8 Comparison of soluble sugar content of different plant materials
3 结论与讨论
CRISPR/Cas9技术已被广泛应用在植物基因工程领域,其通过对作物抗逆基因进行定向修饰,增强植株对环境的抗性,成为作物抗逆育种的一种有效方式。Zhang等[17]利用CRISPR/Cas9技术构建OsRR22基因敲除载体转入水稻中,所得T2突变株与野生型相比,苗期耐盐性显著提高。Liu等[18]从番茄中鉴定出1个LBDⅡ(Lateral organ boundaries domain Ⅱ)型基因家族LBD40(Lateral organ boundaries domain gene 40)基因,该基因能在植物根和果实中高表达,在PEG和盐的诱导下显著表达,利用CRISPR/Cas9技术靶向敲除番茄LBD40基因,获得突变体,干旱胁迫处理后,与野生型相比较,突变体的保水能力提高。在本试验中,也成功利用CRISPR/Cas9系统构建出番茄SlMYB-related2基因的敲除载体,并转化番茄外植体获得阳性植株。
植物受到低温胁迫时会发生膜脂过氧化反应,MDA的积累是植物受活性氧(ROS)毒害作用的表现[19]。MDA被用作判定植物逆境条件下膜脂过氧化强度的指标,而且是衰老的标记[20]。脯氨酸作为一种有机渗透调节物,在植物遭受非生物胁迫时合成[21],其积累能够降低细胞质的水势,保持水分平衡,维持细胞膜的稳定性,同时脯氨酸可以清除羟自由基[22-24],保护蛋白质结构的稳定性。MDA、可溶性糖和游离脯氨酸的含量大小,均可用于鉴定植株耐冷性的强弱。本试验构建VIGS介导的基因瞬时沉默载体并成功转化得到阳性植株,经低温处理后,通过测定VIGS试验植株丙二醛、可溶性糖和游离脯氨酸等指标的变化情况,沉默株系在遭遇低温后较WT和CK丙二醛含量升高,游离脯氨酸含量基本保持不变,可溶性糖含量变化不大,分析结果表明,VIGS试验中SlMYB-related2基因沉默株系确实耐低温性降低,说明SlMYB-related2基因在番茄抗寒过程中起调控的作用。SlMYB-related2基因的沉默使番茄幼苗细胞膜受到了损伤,打破了原有的代谢平衡,影响了对低温的耐受性,可见SlMYB-related2基因在低温胁迫中起到了正调控作用。
本试验只选取了一个野生番茄品种进行该基因的沉默来验证该基因的功能,后续试验可以选用不同的栽培番茄品种,甚至在其他作物中进行该基因在耐低温性性能验证。试验通过VIGS技术和CRISPR/Cas9对SlMYB-related2基因进行了基础研究和初步的探索,可为发掘更多的MYB转录因子功能提供理论基础和参考指导。
