叶片膨压探针诊断植物体水分状况原理及应用进展
2022-03-22郑利剑马娟娟孙西欢郭向红
郑利剑,马娟娟,孙西欢,郭向红
(太原理工大学 水利科学与工程学院,太原030024)
0 引言
【研究意义】准确感知植物水分状况是构建智慧灌溉决策的关键依据[1],构建无损连续监测植物体水分状况的新方法对于农业节水化具有重要促进作用。【研究进展】目前,实现植物水分状况的原位诊断方法基本可分为:①基于植物气孔变化信息如气孔导度(gs)。gs常以气孔计或光合仪间断测量,虽利用gs模型构建、茎流速率换算、稳定同位素监测、气孔开口面积智能识别等方法可间接实现gs连续测定[2-4],但仅依靠气孔变化信息诊断植物水分状况的准确性还有待深入研究。②基于植物器官水分变化信息,如:茎干或叶片含水量、茎干或果实直径微变化、茎干液流、蒸腾速率。其中,直径微变化是极具潜力的植物水分状况诊断方法[5],但其诊断准确性受衍生参数、植物生长模式以及负载量等因素的影响较大;茎流变化是研究植物水分状况的常用指标[6],虽利用新型柔性传感器有望解决探针和植物互容的问题[7],但其在不同植物的适用性上仍需进一步明确。③基于植物物理信号变化信息,如:声发射信号、生物电特性、弹性模量变化[8]。监测植物水分胁迫时介电常数或超声波信号变化,能够无损反映植物水分状况,但其敏感性受测试频率、水分信息滞后效应以及频谱规律量化等方面的影响[9-10]。测定植物弹性模量波动以反映厚度变化的方法则在指示植物新生器官水分状况时更为准确[11]。④随着高光谱、近红外热图像、计算机视觉等技术的兴起,基于叶片温度、冠层体积、植被指数、荧光特性、视觉特征(颜色、形态、纹理)等植物表型参数能够实现植物水分状况的精准诊断,已成为当前的热门研究[12-13]。虽然此类技术对原位监测植物水分状况从植株至作物群体尺度极具优势,但仍有必要同步掌握叶片水分信息如膨压状况以进一步明确植物的气孔变化[14-15]。【切入点】鉴于相关原位水分状况诊断方法在适用性、便捷性以及稳定性上的差异,探寻一种技术操作简单且便于无线连续监测、同时能将叶片气孔和植物器官水分信息耦合的新方法尤其重要。
植物叶片水势,其位于SPAC 系统水势中端,能够对土壤和大气水分变化做出快速反馈,是目前较为准确的植物水分状况诊断指标[16],也是各类诊断指标阐释机理和阈值范围对照的参数之一。常用植物叶片水势的监测方法有压力室、露点冷凝、小液流、木质部探针、压力展平和高光谱分析等[17-19],在实现原位连续监测叶片水势状况上仍有一定困难。随着对细胞层面水分运移的深入研究,单纯依靠叶水势(ΨL)已无法精确指示植物水分状况[20]。因ΨL未发生变化时,水分亏缺可能已造成细胞渗透压(π)变化,导致叶片膨压(PC,PC=ΨL+π)产生响应。从微观视角来看,PC受细胞渗透压、细胞壁弹性、细胞膜通透性(水通道蛋白)以及胞外液体静压力、胞间非原质体渗透压的综合影响[21],对水分状况的敏感性更强;在宏观定量层面,根据PC的计算式(PC=Ψs+π-gs×VPDL/K,其中Ψs 为土壤水势,VPDL为叶片表面与大气的水汽压差,K为土壤与叶片间的水力导度)可知,膨压的变化取决于根系吸水、气孔和细胞渗透压变化,能够综合表征叶片气孔响应与植物器官水分变化[22-23]。因此,利用叶片膨压进行植物水分状况诊断更为科学[24]。叶片膨压探针技术(LPCP)的出现,也使得简单无损且无线连续测定叶片膨压成为可能。
当前,关于LPCP 探针的研究已经历了基本测定原理分析阶段、安装条件测试阶段和植物环境及生理响应阶段,正逐步走向田间灌溉试验。国内外利用LPCP 技术已经在毛白杨、油橄榄、柚、葡萄、香蕉、柿、柑橘、橡树、柠檬、油桃等树木以及西红柿、油菜、玉米、冬小麦等大田作物上进行了诊断植物水分状况的机理探讨,证明了叶片膨压探针在指示不同植物水分状况上的优势和准确性[25]。【拟解决的关键问题】本文侧重于在总结LPCP 技术的基本原理、安装策略和诊断指标选择的基础上,梳理利用LPCP 技术研究叶片膨压变化特征对环境因子及植物水分生理响应的研究进展,阐释其诊断植物水分状况内在机理。
1 LPCP探针基本原理研究
LPCP 技术利用感知叶片在恒定压力下输出压力的信号变化来实现叶片膨压的连续测定[26-27]。如图1所示,其基本原理为:将健康无破损的植物叶片部分夹于2 个圆柱形磁体(面积约10 mm2)之间,上部磁体可通过螺杆上下移动(调节初始压力Pclamp),下部磁体内置高敏感度的压力传感器(与无线传输装置相连,能够实现远程压力值显示)。在测定过程中,确保2 个磁体施加于叶片上的压力Pclamp保持恒定,然后通过测定一定时间间隔(如5 min)所输出Pclamp和叶片膨压(PC)之间的压力信号衰减来反映叶片PC的动态变化,该压力信号变化可称为膨压变化参数PP。因此,当叶片气孔开放或者叶片脱水,实际膨压较低,则膨压变化参数PP较高;而随着气孔关闭或者叶片再水化,膨压较高,则PP值较小。
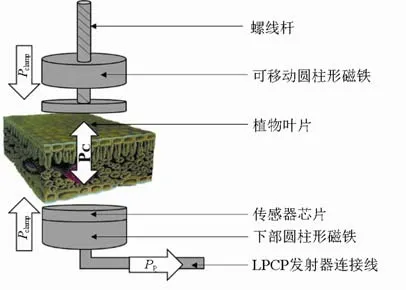
图1 LPCP 探针示意Fig.1 Leaf patch clamp pressure probe
在此基础上,相关研究者进一步确定了相关理论公式。Zimmermann 等[26]通过理论公式推导出了叶片膨压PC与膨压变化参数PP间存在如下关系:

式中:Pclamp为探针施加于叶片的初始磁压力大小,范围为80~400 kPa[28];Fa为压力衰减系数,因考虑到压力传感器和叶片特定结构对压力传递的干扰,实际施加于细胞的恒定压力常呈现一定程度的衰减,相关研究认为其基本范围为0.2~0.4(叶片中脉附近为0.1~0.2,边缘为0.4~0.5),在当叶片膨压≥50 kPa,Fa常为恒定值,而当膨压<50 kPa,此时叶片孔隙将会被大量空气填充,Fa波动较大;a和b为叶片特性常数,其大小取决于细胞壁弹性,受施加压力持续时间影响,当外界压力如Pclamp瞬间施加导致膨压变化时常数较大,而在蒸发条件下缓慢影响膨压变化则常数较小[25]。
由式(1)可知,实际叶片膨压PC与膨压变化参数PP在恒定压力Pclamp下呈稳定的倒数关系。在此基础上,研究者利用微细管压力探针法实测不同植物的叶片膨压值与LPCP 探针获得的膨压变化PP对比,表明二者呈良好的负相关关系(如图2 所示,图中数据利用GetData 软件取自文献[24,26-27,29-31]),表明利用LPCP 技术指示膨压变化的可行性。但不同研究者就不同植物种类和安装高度,得出相关系数a、b和Fa会存在差异。

图2 不同植物间实测叶片膨压PC 与膨压变化参数PP 间的相互关系Fig.2 The relationship between measured leaf turgor PC and leaf turgor change parameter PPamong different plants
由植物细胞力学相关知识表明,细胞体积弹性模量(ε)常用来揭示膨压-体积之间的关系,因此环境温度变化会引起ε发生微小变化,但通过设置不同温度梯度变化(10~30 ℃)得出其探针输出压力变异幅度小于2 kPa[26-27],表明了LPCP 探针自身的稳定性。
2 LPCP探针安装策略研究
LPCP 探针的安装,理论上相对简单,一般是将选定的叶片适宜部位夹于上下探针之间,对齐探针并轻合即可。但在实际研究和应用中,大部分文献为了增强探针测试的准确性和灵敏性,探针安装前需将叶片表面擦拭干净,安装位置选择完全展开的叶片边缘并尽量避开叶片叶脉。但随着应用场景的不断扩展,在测定窄叶时无须避开叶脉其亦可准确测定。同时,考虑膨压代表性和设备感知膨压的敏感程度,部分文献中常将东向叶片作为安装位置。在探针安装前需根据安装时间和不同植物叶片特性选择合理的初始压力Pclamp范围,该范围可通过转动上部磁体调节磁体与底部间的距离实现初始压力的选择。Zimmermann 等[24]认为,当在清晨或叶片膨压较大时,Pclamp宜为10~25 kPa,当在正午或叶片膨压较小时,Pclamp则以50~70 kPa 范围较好。
这里需要注意的是,虽然探针质量较轻(约5 g),但为了更好地维持叶片生长,需将探针与木棒(适宜的支持物)相连以辅助支撑(图3)。同时,当叶片变黄、破损或膨压参数超出测定范围(>500 kPa)时,应及时更换叶片进行测量。

图3 LPCP 探针安装示意Fig.3 Diagram of leaf patch clamp pressure probe installation
3 基于叶片膨压的植物水分状况诊断指标
由于LPCP 探针可连续输出膨压变化参数PP进行植物水分亏缺诊断,但受选取原则、计算方法以及PP与不同植物生理参数相关性的影响,产生了基于PP的不同植物水分诊断指标。目前,可分为3 大类诊断指标用以分析植物的水分状况。
其中,第1 类指标是利用膨压变化参数PP特征值进行植物水分状况的分析。常见的诊断指标有PP最大值、最小值、最大值下降的峰减半时间(τ)、均值、ΔPP/Δt等[32-35]。膨压相对变化速率是由SCALLSI等[36-37]提出的新的诊断指标,其计算式为:

式中:PP2和PP1分别表示t2时刻和t1时刻的实测膨压变化参数PP值。
第2 类指标是基于PP的曲线变化特征来分析植物水分状况,主要包含4 种方法:①相关研究者根据植物在不同水分亏缺条件下的曲线类型[38],将PP变化曲线类型与油橄榄茎水势Ψs变化范围对应,将植物需水程度分为3 种:其中,State1 为轻度水分胁迫(Ψs>-1.2 MPa),PP呈单峰型;State2 为中度水分胁迫(-1.7 MPa<Ψs<-1.2 MPa),PP呈半反转的双峰型,在早上以及傍晚达到峰值,而在正午以及夜晚达到谷值;State3 为严重水分胁迫(Ψs<-1.7 MPa),PP呈完全反转的倒V 型。如图4 所示,在滴灌芹菜叶片膨压的监测研究中也获得了不同的水分状况下,芹菜叶片膨压变化呈类似的3 种曲线类型;②Cheab 等[39]在3 种曲线类型的基础上,提出了累积倒转曲线值(CIV)这一诊断指标的概念,即CIV=0.5D2+1D3,其中D2和D3分别表示为处于State2 和State3 的天数;③基于膨压日变化曲线的面积大小进行不同水分状况的研究[40]。研究者将非充分灌溉下的曲线面积与充分灌溉下的曲线面积进行对比,根据面积占比进行相关水分状况的诊断。④基于叶片膨压与气象因子形成的时滞圈大小进行不同水分状况的区分[41]。膨压变化与气象因子如空气温度、饱和水汽压等在日尺度上存在时滞效应,因此可利用时滞圈的大小来进行水分亏缺的分析[26]。

图4 在滴灌芹菜上的3 种膨压曲线类型Fig.4 Three leaf turgor curves types on drip-irrigated celery
第3 类是基于标准化后的膨压变化参数PP进行分析。为了便于比较不同探针间的差异,将实测PP进行标准化后,再采用第1 类或第2 类的诊断指标进行相关分析。针对不同植物,相关研究者根据自身研究需要制订不同的标准化策略,具体标准化策略见表1。

表1 不同的叶片膨压参数标准化策略Table 1 Standardization strategies of different leaf turgor parameters
4 叶片膨压对环境因素变化的响应研究
明确植物水分状况诊断方法的敏感性首先应阐明诊断指标对环境因素变化的响应机制。以滴灌芹菜为例,受环境因素影响,植物叶片膨压变化参数PP在日尺度呈规律性波动(图4 和图5),常为“昼高夜低”变化[44],并在12:00—14:00 达到峰值;当叶片严重缺水,叶片孔隙包括木质部导管内将会被大量空气填充[31],此时PP变化与水分充足时的完全相反,呈“昼低夜高”。但受植物自身水力调控和环境水分胁迫程度的影响,并非所有植物都会存在此种翻转现象[44,46]。
不同土壤水分管理条件(灌溉、降水、干旱)下,植物PP变化并不一致[33]。土壤干旱时,PP日最大值和最小值均会增加,同时,叶片膨压恢复至原始水平的速率会减弱[14]。当灌溉引起的土壤水分发生变化时,叶片PP曲线特征亦会发生显著变化,且受不同作物种类的影响明显[42]。由图5 可知,滴灌芹菜在充分灌溉处理(每隔10 d 滴灌30 mm/hm2)下的叶片膨压要显著高于控水处理(未灌水处理)。充分灌溉处理下,芹菜膨压变化参数PP的峰值和谷值均较小且相对稳定;而在控水处理下的芹菜叶片膨压整体呈下降趋势且不会在夜间恢复至原水平。Ruger 等[30]也得出灌溉将显著降低PP曲线峰值,而Zimmermann 等[24]则指出灌溉下的PP峰值降低仅发生在温室环境而非大田环境中,Riboldi 等[34]则认为在野外干旱条件下PP可能会维持在一定范围内。

图5 不同灌溉处理下的芹菜10-12 叶期叶片膨压变化参数PPFig.5 Changes in leaf turgor pressure of celery in 10-12 leaves under different irrigation treatments
在不同的环境条件(CO2、光照、湿度、温度)、植物类型(作物、果树)和叶片位置(高度、方位、遮蔽)下,植物叶片膨压变化特征差异性较大[43,47]。受光照、植物水力特性和水分分配策略的影响,东西部的叶片膨压对环境水分变化的响应较南北方向得更为敏感[29]。整体而言,在季节尺度上,叶片膨压与气象参数间存在不同程度的相关性(表2),其中PP与大气温度和饱和水汽压显著正相关,而与相对湿度负相关[48]。

表2 叶片膨压与气象参数及水分生理参数间的相关性Table 2 Correlation between leaf turgor and meteorological parameters and water physiological parameters
Zimmermann 等[24]得出在灌溉条件下,风速能够减弱叶片边界层厚度并起到了冷却叶片、减弱水汽压差的作用,导致蒸腾速率增加、气孔变大,促使膨压减小,使得叶片膨压在风速的影响下产生PP信号振动。在叶片蒸腾、根系吸水和植物水分利用策略的综合调控下,PP日变化与T、RH间的时滞效应与土壤水分的变化存在一定可量化的相互关系。Bramley 等[14]针对玉米的研究表明,在充分供水条件下,叶片PP和T存在时滞现象,即PP和T二者在上午呈线性一致的上升趋势,而在下午由于PP回落较T更迅速,导致二者呈曲线滞后下降变化;反之,当水分亏缺导致根系供水不足时,PP和T在全天均为线性变化,无时滞圈或时滞圈面积较小。而Kant 等[41]在芥花中却得出PP和T的时滞效应在水分亏缺时更为显著的结论,并认为当时滞圈面积占比大于40%(时滞圈面积占最大最小PP值所围成的矩形面积之比)时表明植物受到了水分胁迫,此时的PP在下午的急剧下降并非正常的膨压恢复,而是由于木质部栓塞等植物水力特征的影响[49],甚至出现晚上由于叶片恢复部分水分导致PP增加。
5 叶片膨压变化与植物水分生理的关联性
构建具有高敏感度的植物水分状况诊断方法需将诊断参数与植物水分生理间建立稳定的关系。如表2 所示,通过综合相关文献以及作者在滴灌芹菜上的研究表明,叶片膨压变化参数PP与不同水分生理参数间存在不同程度的相关性,这其中PP与叶水势的相关性最为显著[36]。研究者通过分析基于LPCP探针的单叶尺度膨压变化PP与基于压力室法的多叶平衡压Pb间的关系得出,二者具有较好的一致性,表明了LPCP 探针在指示植物水分状况上的准确性和可行性[48]。在此基础上,利用PP曲线类型的变化能够进行植物水分亏缺的茎秆水势阈值划分[49],但不同的植物其阈值并不一致。Padilla-diaz 等[50]和Sghaier 等[51]均得出橄榄的阈值下限为-1.7 MPa,而Marino 等[45]则将橄榄的阈值下限下移至-2.2 MPa;Martinez-gimeno 等[52]认为柿子树的水分亏缺阈值下限为-1.4 MPa,而Ballester 等[46]则测得该阈值下限为-1.2 MPa。由此可见,针对不同植物的LPCP 诊断阈值具有差异。
叶片膨压变化与叶片气孔导度存在内在联系[47]。植物水分变化将直接影响着叶片膨压和气孔导度变化,同时,气孔的开闭受保卫细胞膨压变化的影响。LPCP 探针技术,进一步利用了PC与gs的互馈机制。Rodriguez-domingue 等[53]利用LPCP 探针得出,叶片膨压变化能够解释87%的由土壤干旱导致的植物气孔导度下降。而当水汽压差(VPD)升高至一定阈值时易造成叶片气孔振荡,这将同步引起膨压的短期振荡变化,并在蒸腾速率等于水分供给时达到稳定(即dPP/dt=0)[35]。受测试方法、测试时间、ABA 量及气孔日变化幅度等因素的影响,也有学者认为PP与气孔导度相关性较差[14],在不灌溉条件下气孔导度并不显著影响叶片PP[24]。气孔变化受环境因素的影响较为复杂,简单的线性关系或单一尺度并不能完全准确地表征二者关系。相关研究表明利用PP和VPD的内在机理关系能够指示gs变化,并在此基础上建立了测定日最大气孔导度的新方法[23]。
由于LPCP 测定的是叶片膨压差连续变化,分析其与植物水分连续性指标的相互关系应更为合理[37]。Rodriguez-domingue 等[54]认为叶片PP和茎流速率日变化规律类似,但二者达到峰值的时间并不完全一致,并可根据PP变化将茎流速率进行不同水分状况的区分;李豆豆等[44]在白杨上也发现二者的类似协同变化关系。Ehrenberger 等[49]认为叶片PP和树干直径微变化呈显著负相关,但膨压在小时尺度上的信号变幅较树干直径微变化更大。Marino 等[42]认为PP与果实直径变化有较强一致性,而与茎流速率间的相关性较弱。
6 存在的问题及展望
应用LPCP 技术诊断植物水分状况极具优势,在国外发展较快,但仍处于机理探索研究阶段,在实际指导灌溉中以地中海地区油橄榄等植物的应用较好,尚需解决的问题为:
1)将对叶片膨压变化特征的研究尺度由单侧拓展向冠层水平。受蒸腾作用和茎秆水分运输的影响,冠层不同位置的叶片水分状况将存在一定差异,这种冠层叶片水分的反馈异质性在高大乔木以及温室番茄的叶片中均有发现。因此,植物单侧叶片的膨压变化能否准确表征植物冠层水平的水分状况仍有待深入探讨,且明确冠层水平的叶片膨压变化能为合理优化LPCP 探针监测位置提供依据。
2)将环境因子对叶片膨压的影响机制研究由单因素定性转向多因素定量分析。关于环境因素和PP的定量研究上,目前还多为单因素的日、季时间尺度拟合,尚无基于综合多因素的分析。针对土壤水分与叶片膨压变化的相互关系,得出了随着土壤水分降低其曲线峰值逐渐增加的定性规律,尚未建立定量函数关系。
3)将叶片膨压变化与植物体水分指标的响应研究由间断性指标向连续性参数拓展。针对LPCP 探针进行植物水分状况诊断的研究,多集中于PP与ΨM和gs等间断性指标的对比分析上,而耦合多源植物连续性水分指标如茎流、茎干直径微变化等,有助于进一步阐明PP与植物水分状况的相互关系并确定其相应的阈值范围。
4)将LPCP 技术研究重点由探究植株生理反馈机制向制订灌溉策略转变。当前,基于PP曲线类型进行实际灌溉的研究多基于少部分地区特定植物,但对于不同植物其应用的准确性和智能性试验工作仍有待积极推进。
