基于生物信息学探索高危原发性胆汁性胆管炎患者潜在发病机制及治疗靶点
2022-03-21龙林竞刘丽玉曲红光黄建伟
龙林竞,刘丽玉,曲红光,黄建伟
(广州医科大学附属第五医院消化内科,广东 广州 510799)
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是一种慢性自身免疫性胆汁淤积性肝病,以肝内小胆管周围单核细胞浸润及肉芽肿形成的慢性非化脓性破坏性胆管炎为主要病理特征,并随着疾病进展发展为肝硬化[1]。PBC的病因和发病机制是多因素且尚未完全阐明的,但在 90%~95% 的 PBC 患者中检测到抗线粒体抗体(anti-mitochondrial antibody,AMA)[2,3]。由于AMA对PBC的高度敏感性及特异性,使其作为PBC主要的诊断条件之一;肝活检并非诊断时所必须的检查,但对于非典型病例及预测患者长期预后有着重要作用[4]。目前,熊去氧胆酸(ursodeoxycholic acid,UDCA)仍是PBC的一线治疗,其疗效和安全性均较为良好[1]。临床上,约 70% 低风险、非进展性的PBC患者对UDCA治疗有反应,而其余 30% 患者则为高风险且对 UDCA 无反应,并最终发展为胆汁性肝硬化[5]。然而,对于此类高风险PBC患者的治疗仍具有挑战,并且其发生及发展的具体机制尚不清楚。
近年来,许多研究基于全基因组关联研究(genome-wide association studies,GWAS)深入探讨PBC的发病机制,并发现一些PBC易感的相关位点,其中白细胞抗原(leucocyte antigen,HLA)-DRB1、HLA-dqa1和HLA-dqb1基因位点与PBC易感性关联最强[6]。此外,免疫反应在PBC发病机制中起着核心作用。抗原呈递和白介素(interleukin,IL)-12产生(IRF5、SOCS1、TNFAIP3、NF-B 和 IL-12A)、T 细胞活化和干扰素-γ途径(TNFSF15、IL12R、TYK2、STAT4、SOCS1、NF-κB 和 TNFAIP3)以及 B 细胞活化和免疫球蛋白的产生(POU2AF1、SPIB、PRKCB、IKZF3 和 ARID3A)在PBC的发病机制中发挥重要作用[4]。因此,目前也有使用JAK1/2抑制剂、CD20单抗和CTLA-4融合蛋白等生物制剂治疗高危PBC的临床研究,但效果仍然不理想,表明现阶段对PBC的免疫分子机制研究尚不明确[7-9]。因此,仍须积极探索高危PBC患者发病的分子机制及治疗相关的分子靶点。
本研究使用生物信息学分析公共数据库中高危PBC患者肝脏基因测序数据,以期寻找高危PBC潜在的生物治疗靶点。
1 材料和方法
1.1 资料源、检索策略和选择标准
采用主题词与自由词相结合的方式进行检索,以“primary biliary cholangitis”、“PBC”、“cholangitis”、“homo sapiens”为检索关键词,从Gene Expression Omnibus基因表达综合数据库(GEO,http://www.ncbi.nlm.nih.gov/geo)下载基因表达文件。纳入标准:①出版日期从建库至2022年;②被诊断为PBC患者;③包含需要行肝移植患者;④包含健康对照组;⑤病例数>3例。排除标准:①数据不完全;②动物和细胞实验。
1.2 数据下载及差异分析
从GEO数据库中下载基因表达矩阵文件(GSE79850[10])。该研究对PBC患者随访至少15年,并定义低风险患者标准为:①对UDCA治疗完全应答并至少保持15年;②不需要肝移植;高危险患者标准为:①UDCA治疗一年后(剂量为13~15 mg/kg)无反应;②在随访中,由于PBC的疾病进展需要肝移植。该数据集包含了8例健康人群肝脏样本(control,CNTL),7例低风险(low risk,LR)及9例高风险(high risk,HR)PBC患者肝脏样本,并检测了784个免疫相关基因。使用R包“limma”进行差异分析,当差异倍数(Fold change,FC)>1.5且P<0.05时,定义为基因表达上调;当FC<0.67且P<0.05时,定义为基因表达下调[11]。利用R包“ggplot2“绘制火山图,应用在线工具”jvenn“(http:∥jvenn.toulouse.inra.fr/app/example.html)绘制韦恩图以寻找二者交集差异基因。
1.3 富集分析
GO是基于已定义的特征提供基因功能的综合信息,主要分为3个部分:分子功能(molecular function,MF)、生物过程(biological process,BP)和细胞成分(cellular component,CC)[12]。为了分析差异表达基因(differentially expressed genes,DEGs)的功能,使用R包“Clusterprofiler”[13]和“org.HS.eg.db”对交集DEGs进行基因本体论(gene ontology,GO)分析。定义调整后P值<0.05为差异有统计学意义。
1.4 加权基因共表达网络分析
加权基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)探讨了转录组构成的概述以及外部生物性状与基因组之间的关系[14]。使用R包“WGCNA”对所有基因进行WGCNA分析。根据无标度拓扑准则选择β=6进行网络构建,采用动态树切割算法(dynamic tree cut algorithm)进行模块识别,模块基因数的最小值为50,并将相似模块合并(截断高度0.35)。在模块-性状分析中,以|基因-性状显著性(gene-trait significance,GS)值|> 0.5和|模块隶属度(module membership,MM)值|> 0.55为阈值。
1.5 蛋白质相互作用分析
为了研究高危PBC特有的DEGs的相互作用关系及探索其关键基因,利用String数据库(https://cn.string-db.org/)对高危PBC特有的DEGs构建蛋白质相互作用(protein-protein interaction,PPI)网络。将所获得的网络导入Cytoscape软件(v3.8.2),删除没有形成闭环的通路,并使用CytoHubba插件中的复杂分子检测法(molecular complex detection,MCC)寻找关键基因。
1.6 统计学分析
应用R语言软件(v4.1.3)对数据进行统计学分析。P<0.05为差异有统计学意义。
2 结 果
2.1 高危PBC患者DEGs鉴定
对所下载的基因表达矩阵进行标准化后行差异分析。与CNTL组相比,LR组中鉴定出103个上调DEGs及110个下调DEGs(图1A),HR组中鉴定出168个上调DEGs及158个下调DEGs(图1B);与LR组相比,HR组则鉴定出99个上调DEGs及106个下调DEGs(图1C)。进一步使用韦恩图探索高危PBC患者特有DEGs(与CNTL和LR相比均显著变化),共鉴定出44个上调(图1D)及54个下调DEGs为高危PBC患者所特有的DEGs(图1E)。以上结果表明,高危PBC患者特有的DEGs可能是导致患者对UDCA治疗无效或疾病进展的主要原因。

注:火山图展示了LR vs CNTL(A)、HR vs CNTL(B)和HR vs LR(C)的差异分析结果;D.上调DEGs的交集情况;E.下调DEGs的交集情况
2.2 富集分析
为了探讨上述高危PBC特有DEGs的免疫过程,我们主要对BP进行分析。结果显示,上调特有DEGs的BP主要涉及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)活性调节、丝氨酸/苏氨酸蛋白激酶活性的调节、白细胞增殖、B细胞活化及T细胞活化(图2A);而下调DEGs的BP主要在补体激活、体液免疫调节、免疫球蛋白调节免疫反应、B细胞调节免疫及对IL-1反应中富集(图2B)。以上结果表明,高危PBC中多种免疫途径均存在异常应答。

注:A:高危PBC中上调特有DEGs的GO分析;B:高危PBC中下调特有DEGs的GO分析
2.3 WGCNA识别高危PBC性状模块
为了探索与高危PBC最为相关的基因模块,我们对所有基因进行了WGCNA分析。我们选择了β=6(scale-free R2=0.85)作为软阈值构建无标度拓扑网络(图3A),并且通过聚类及动态混合切割识别了5个模块(图3B)。其中,turquoise模块与高风险PBC负相关程度最高(R=-0.76,P=2e-5),表明该模块中的基因可能在高危PBC患者中发挥重要作用(图3C)。挑选该模块中|GS|>0.5和|MM|>0.55的基因并与高危PBC特有DEGs取交集,分别鉴定出29个上调和50个下调特有DEGs(图3D)。以上结果表明,上述基因与高危PBC的发生发展最为相关。

注:A:使用不同软阈值幂次的无标度拟合指标,确定β=6(scale-free R2=0.85)即可建立满意的无标度拓扑网络;B:利用动态树切割算法对树形图进行聚类,基因可被分为5类群;C:热图分析模块特征基因与临床特征之间的相关性,MEturquoise与HR患者最为负相关;D:turquoise模块基因与高危PBC特有DEGs的交集情况
2.4 蛋白质相互作用网络构建及鉴定关键基因
将WGCNA中分析得到的高危PBC特有DEGs构建PPI网络及使用CytoHubba插件中的MCC算法探索其中的关键基因,上调DEGs构建的PPI网络共有21个节点(node),56条边(edge),平均每个节点的度(degree)为5.3(图4A);MCC结果显示CD44、CD34、CTLA4、ITGA4、CD24、THY1、MAPK3、VEGFC、PDGFRB和ITGB4是上调DEGs中排名前10的关键基因(图4B),该网络主要与T细胞活化及白细胞增殖相关。下调DEGs构建的PPI网络共有31个节点,185条边,平均每个节点的度为11.9(图4C);MCC结果显示C3、C4B、CFP、MBL2、C1R、C1S、C5、C9、C8B和C6是下调DEGs中排名前10的关键基因(图4D),该网络均与补体激活途径相关。进一步对上述关键基因的表达、WGCNA及PPI中的表现加以总结(表1),发现上述关键基因无论是在表达情况还是与高危PBC的相关性中均有十分显著的差异及关联。以上结果表明,T细胞活化、白细胞增殖及补体激活途径可能是促进高危PBC患者对UDCA治疗无效或疾病进展的关键所在,并且上述关键基因可能是潜在的治疗靶点。
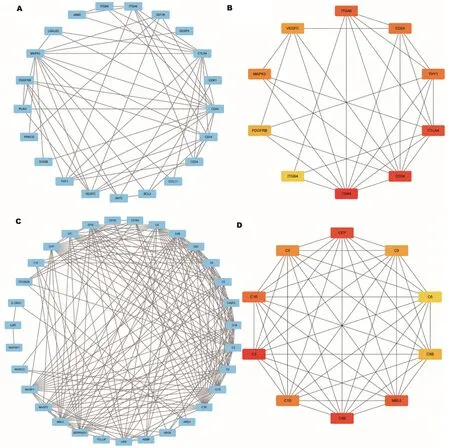
注:A:高危PBC中上调特有DEGs的PPI网络;B:高危PBC上调特有DEGs中的关键基因,该网络主要与T细胞活化及白细胞增殖相关。颜色由黄变红表明蛋白质的MCC排名,红色染色越深,蛋白质排名越靠前;C:高危PBC中下调特有DEGs的PPI网络;D:高危PBC下调特有DEGs中的关键基因,该网络均与补体激活途径相关

表1 关键基因的表达情况、WGCNA和MCC中的表现
3 讨 论
本研究通过分析高危PBC患者的免疫基因转录组,共鉴定出44个上调及54个下调DEGs为高危PBC患者所特有的DEGs(与CNTL和LR相比均显著变化)。进一步通过GO分析发现高危PBC中多种免疫途径存在异常应答,包括白细胞增殖、B细胞活化、T细胞活化和补体激活等途径。随后使用WGCNA及PPI网络分别鉴定出上调和下调DEGs中排名前10的关键基因,这些关键基因与T细胞活化、白细胞增殖及补体激活途径相关。
PBC是一种进行性的自身免疫性疾病,其发生发展过程涉及多种免疫途径异常应答[15]。既往人和小鼠PBC模型研究均发现CD4+及CD8+T细胞在胆道损伤中具有关键作用[16-17]。因此,Bowlus等[8]开展了一项为期36周的CTLA-4融合蛋白(阿巴西普)治疗UDCA不完全反应的PBC患者的开放标签研究,尽管阿巴西普表现出良好的耐受性,但在改善临床生化结果方面无效。本研究中,尽管高危PBC组DEGs提示T细胞活化,并且CTLA-4也被筛选为关键基因,但高危PBC患者上调基因中还存在MAPK通路和白细胞增殖通路的异常激活,表明单单针对T细胞活化是不够的,这也解释了单独使用阿巴西普治疗高危PBC可能效果不佳的可能原因。此外,PBC患者自身抗体可诱导胆管上皮表达CD44,并进一步募集记忆T细胞从而激活集体炎症反应[18]。由于PBC患者中存在着自身抗体的异常表达,B 细胞可促进PBC的发展。研究报道称,CD19+CD24hiCD38hiB细胞与PBC患者肝胆汁淤积正相关[19]。因此,有学者使用CD20单抗(利妥昔单抗)治疗PBC患者,但CD20单抗对UDCA无效的PBC患者疗效十分有限,其作用仅在对UDCA有效的PBC患者早期阶段可改善碱性磷酸酶水平[20,21]。本研究中,我们发现高危PBC患者其体液免疫及免疫球蛋白调节免疫途径下调,表明高危PBC患者的肝脏免疫环境中B细胞可能并不是主要的效应细胞,但在疾病的早期阶段充当着关键作用[22]。VEGFC和PDGFRB的表达均在PBC患者中显著升高,并与PBC的发生和进展相关[23-24]。目前尚缺乏ITGB4、ITGA4、THY1和MAPK3在PBC中的研究,然而上述基因均与炎症激活相关。
此外,本研究发现高危PBC患者肝脏补体激活途径未激活,多种补体mRNA水平显著下调,然而对于补体在PBC中的作用研究十分缺乏。既往研究显示,PBC患者血浆C3和C4水平升高,可能是由于肝脏炎症的急性期反应[25];而在肝硬化PBC患者中,血浆C3及C4水平下降可能反应了肝脏的蛋白质合成能力降低[26];血清凝集素ficolin-1水平降低与PBC疾病进展相关[27]。以上结果表明,补体系统对于PBC的发生发展存在重要作用,但其具体机制尚未完全阐明。补体系统是先天免疫的一部分,过多或者缺乏补体成分均为导致自身免疫性疾病的发生,各种补体途径均有助于凋亡碎片和免疫复合物清除以及调节T/B细胞的功能[28]。因此,靶向补体成分可能是PBC治疗的选择之一,但目前尚未有相关研究。
本研究通过更加细致地筛选高危PBC中的DEGs,发现了多个与高危PBC密切相关且尚未在PBC中报道的免疫相关基因,同时通过分子机制的角度解释了当下生物制剂治疗高危PBC疗效不佳的潜在原因,并且提出靶向补体成分可能是PBC治疗的选择之一,这是本研究的优势所在。本研究主要缺陷为缺乏相关实验的验证,但通过本研究可为PBC未来的研究提供指引。
总而言之,通过生物信息学分析公共数据库中高危PBC患者的肝脏免疫相关基因测序数据,发现高危PBC患者存在多种免疫途径的异常应答,上述关键基因可能是潜在的治疗靶点,靶向补体成分可能是PBC治疗的选择之一。
