84例自身免疫性脑炎疑似患者临床特征及实验室指标分析
2022-03-21钟健彭涣锲曾谞唐浩能
钟健,彭涣锲,曾谞,唐浩能*
(1.中南大学湘雅二医院检验医学科,湖南 长沙 410011;2.中南大学湘雅医学院医学检验系,湖南 长沙 4100131)
自身免疫性脑炎(autoimmune encephalitis,AE)泛指一类由机体免疫系统针对中枢神经系统抗原而产生异常反应所导致的急性或者亚急性起病脑炎[1-2],其中抗N-甲基-D-天冬氨酸受体脑炎(anti-NMDAR Encephailitis)是最主要的AE 亚型[3]。目前AE 的年发病率和患病率均较低,1995年至2015年间AE 发病率仅为0.8/10万人年,但是存在逐年增高的趋势[4]。临床医生在排除其他脑部器质性疾病的基础上,借助脑脊液或者血清相关自身抗体检测阳性结果可特异性地诊断AE[2-3]。然而,AE 相关自身抗体或抗体谱的检测在中国绝大多数医院的普及率不高,不同实验室之间检测标准化差异显著,结果报告方式迥异导致检测结果参比性低等多方面都限制了自身抗体检测在AE 临床早期诊断的价值与应用[5-6]。更重要的是,由于临床表现的相似性,部分疑似AE患者往往在疾病中晚期才进行自身抗体检测,从而延误诊断或免疫治疗,由此可能造成中枢神经系统严重损害、并发肿瘤、疾病复发甚至死亡[7]。若能在早期通过相关的实验室指标进行综合分析,提前预警,则有可能将AE自身抗体检测的时间提前。故此回顾性分析了常规实验室检测指标在AE 早期鉴别诊断中的价值,为临床早期决策提供更多的理论证据。
1 资料与方法
1.1 资料来源
本研究为回顾性研究。从医院病例系统中收集2016年3月至2021年3月就诊于中南大学湘雅二医院并拟诊为AE的患者电子病例资料,主要包括:(1)基本资料:发病年龄、入院日期、入院与出院诊断、既往史、前驱症状、临床表现(精神行为异常、言语障碍、口面部或肢体的不自主抖动、意识水平下降、视力下降、近期记忆力减退、夜间入睡困难、性格改变);(2)实验室指标:血常规、生化常规、凝血常规、脑脊液常规检查。相应的纳入标准和排除标准筛选病例进一步分组,具体流程见图1。本研究已得到中南大学湘雅二医院伦理委员会批准并免患者知情同意。
1.2 诊断标准
基于Graus标准[2]和《中国自身免疫性脑炎诊治专家共识》[3],AE的诊断满足以下4个条件:(1)临床表现:急性(<2周)或亚急性(≤3个月)起病,具备以下1个或多个神经与精神症状或者临床综合征。①边缘系统症状:近事记忆减退、癫痫发作、精神行为异常(出现上述症状1个或多个);②脑炎综合征:弥漫性或者多灶性脑损害的临床表现;③基底节和(或)间脑/下丘脑受累的临床表现;④精神障碍,且不符合非器质疾病;(2)具有以下1个或多个辅助检查发现:①脑脊液异常,包括白细胞增多(>5×106/L)或脑脊液细胞学呈淋巴细胞性炎症或脑脊液寡克隆区带阳性;②神经影像学或电生理异常;③发现AE相关肿瘤;(3)脑脊液和/血清检出AE相关抗体;(4)合理排除其他病因。
1.3 统计学分析
2 结 果
2.1 基本情况
共纳入84例患者,其中38例确诊为AE。对照组中感染性脑炎/脑膜脑炎有19例,病毒性感染为主,见图1。AE组患者以女性为主,中位发病年龄为31.5岁(12~78岁),显著低于对照组的48.0岁(14~83岁),AE 组中自免脑炎抗体以抗 NMDAR 为主,见表 1。两组患者具有较多相似的前驱症状或临床表现,精神行为异常、言语障碍、口面部或肢体不自主抖动更常见于 AE 确诊患者(见表 2)。值得注意的是,精神行为异常查因是AE患者前来就诊最常见的主诉。

表1 AE组自免脑炎抗体分类
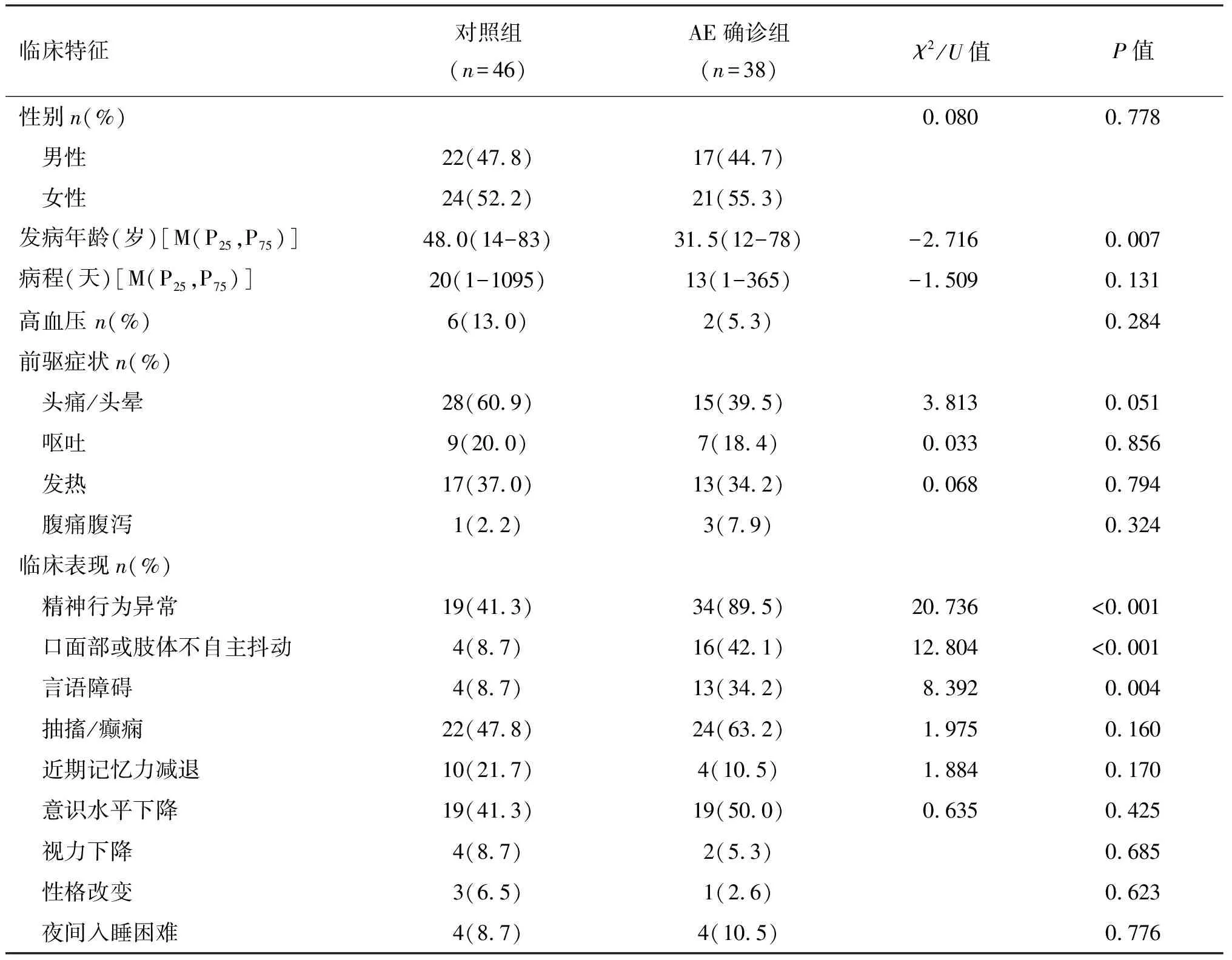
表2 AE疑似患者临床特征

图1 研究对象纳入及分组示意图
2.2 两组患者常见实验室指标的对比分析
84名患者均在入院后三天内行血常规和生化常规检查。与对照组相比,确诊组全血白细胞(WBC)(P<0.001)、中性粒细胞计数(P=0.001)及中性粒细胞比值(P=0.007)和中性粒细胞与淋巴细胞比值(P=0.028)均较高(表3);两组的血清总蛋白、肌酸激酶、N端脑利肽前体水平的差异具有统计学意义(P<0.05)(表3)。脑脊液检查是AE诊断的重要辅助检查之一。AE患者脑脊液白细胞数轻度升高(>5×106/L)的比例高于对照组。此外,确诊组较对照组表现出更高的抗凝血酶Ⅲ、D二聚体和纤维蛋白降解产物水平,见表3。
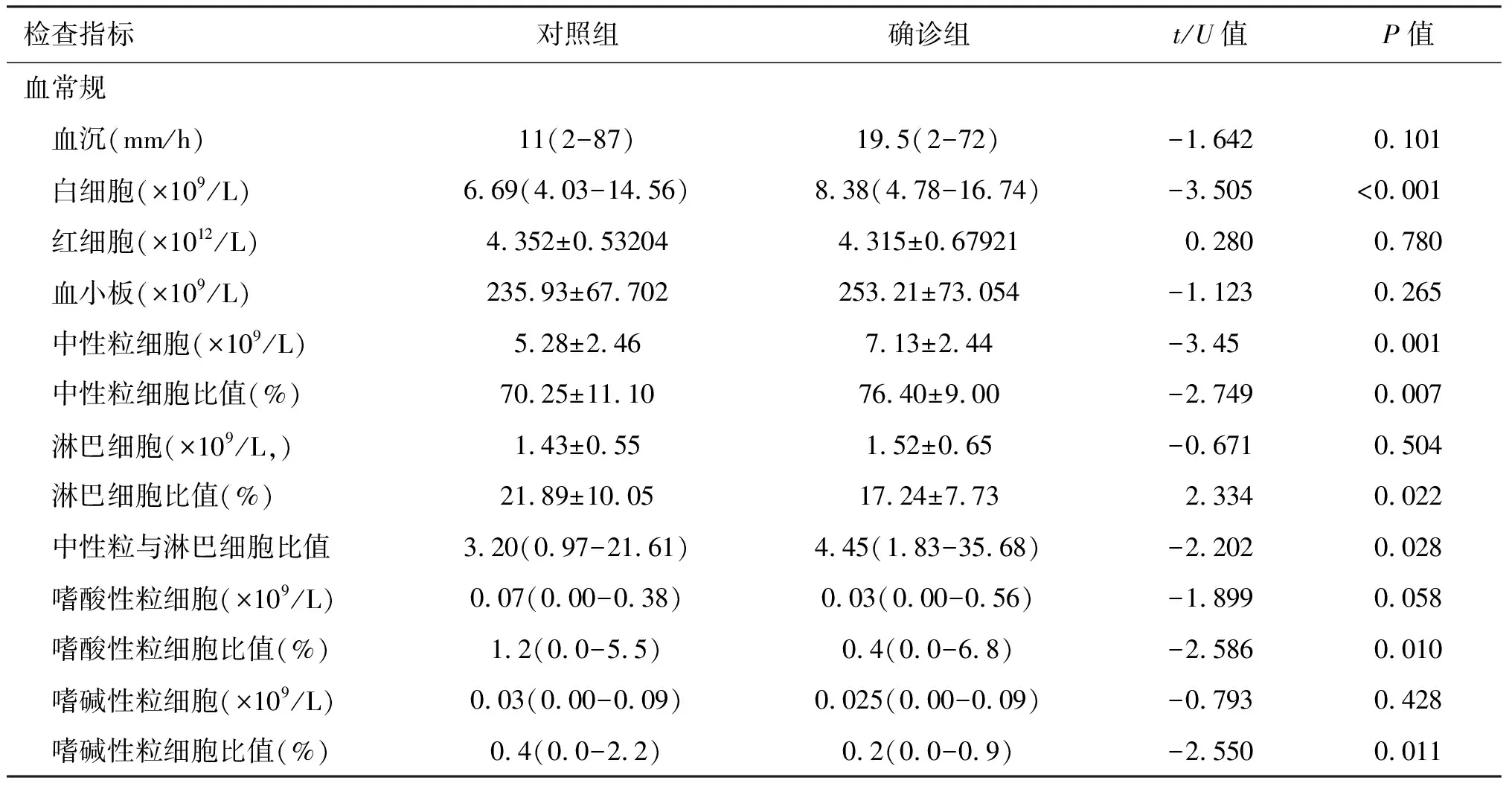
表3 AE疑似患者入院首次实验室检查结果
2.3 疑似患者临床特征及实验室指标与AE发病的关联
以性别、年龄、全血白细胞、中性粒细胞计数、中淋比值、血清总蛋白、脑脊液白细胞、D 二聚体、是否出现头痛/头晕、是否出现精神行为异常、是否出现言语障碍、是否出现抽搐或癫痫、是否出现口面部或肢体不自主运动等指标为自变量,是否确诊为AE 为因变量进行二元Logistic 回归分析,通过逐步回归的方式明确最终的独立因素。结果表明WBC、年龄、精神行为异常和言语障碍是AE 发病的独立相关因素,见表4。

表4 AE发病的独立相关因素分析
将上述指标分别进行ROC 曲线分析显示,WBC有良好的诊断价值(AUC>0.7),但敏感性和特异度一般;因此,进一步针对上述指标进行联合预测,结果显示与单独指标相比,WBC、年龄与精神行为异常和言语障碍四者联合诊断AE的AUC最大(AUC=0.867),约登指数为0.612,对AE 的预测诊断的敏感性和特异性分别达到0.789和0.822(表5、图2)。我们进一步将不同指标联合预测所得的AUC进行两两比较,结果显示3项指标联合预测或4项指标联合预测所得AUC相比2项指标联合预测所得AUC之间的差异有统计学意义(P<0.05),但3项指标联合预测与4项指标联合预测所得AUC之间的差异无统计学意义(P>0.05),见表5。

表5 单指标与多指标联合检测对AE的诊断价值分析

图2 WBC-年龄-精神行为异常-言语障碍模型预测疾病的受试者工作曲线
3 讨 论
本研究综合评估了自身免疫性脑炎患者入院早期的常规检验指标和临床特征,发现多种差异性指标的联合应用可以有效预测AE患病可能,为临床医生提供早期决策的依据。
自身免疫性脑炎是一种以复杂的神经精神症状为表现的急性或亚急性起病的免疫性疾病,亚型众多。不同类型AE的好发人群与年龄不同,本研究AE确诊患者中位发病年龄为31.5岁。抗NMDAR脑炎作为AE的主要类型,多见于45岁以下女性人群[9]。临床表现的异质性和重叠性使得AE 与其他类似神经精神性疾病的早期鉴别变得困难。与之前针对中国[7]或国外[8,10]AE患者的研究结果相符,精神行为异常和抽搐/癫痫发作是最常见的临床表现。但精神行为异常、言语障碍、癫痫发作、不自主抖动等临床表现并非AE的特异性表现。头痛发热、腹泻等前驱症状同样缺乏特异性,可出现于病毒性感染之后[8,11]。考虑到单一表现的低特异性,临床症状的组合可能有助于临床更好的区分AE与感染性脑炎[11]。
AE作为一种急性或亚急性起病的中枢神经系统的炎性疾病,包括中性粒细胞在内的众多炎症指标在AE发病过程中扮演着重要角色[11]。中性粒细胞占白细胞数目的40%-75%,参与固有免疫反应,能对机体炎症会迅速做出反应,淋巴细胞则参与机体的慢性炎症反应、免疫系统的调节[11-12]。本研究中,AE患者的全血白细胞和中性粒细胞显著升高,淋巴细胞数目大多正常,具有更高的中淋比值。已有研究证实了在AE发病中存在异常激活的炎症细胞作用,中性粒细胞作为抗原侵袭时最先受到反应性激活的细胞,可以通过细胞因子的释放激活下游免疫细胞,引起B细胞和T细胞的活化,从而产生靶向特定抗原的抗体或相关细胞因子[12],同时AE患者中淋比值的升高可能预示着不良预后结局[13]。潜在肿瘤的存在[14]和感染[15-16]是诱发AE抗体产生或免疫细胞异常活化的重要因素,炎症因子的大量释放、自身抗体的过量产生或免疫复合物的沉积所引起的炎症反应也推动着AE进展[17]。此外,入院时AE患者血清总蛋白和白蛋白水平较对照组患者低,我们推测病程长短与机体营养的摄入可能是导致该差异产生的原因之一。一项随访研究发现,血清白蛋白低于4.0 g/dL的患者接受免疫治疗后的长期预后不佳,治疗前适当补充白蛋白或许是改善AE短期和长期预后的重要措施[18]。
FDPs是机体纤维蛋白原在纤溶酶作用下降解的产物总称,由包括D-二聚体片段在内的诸多片段组成。本研究发现AE确诊患者的血液抗凝血酶III活性、D二聚体和FDP水平均高于对照组。尽管目前尚未有类似研究报道,但我们的结果提示AE确诊患者可能更容易出现高凝状态和继发性的纤维蛋白溶解亢进,因此需要更加关注患者并发血栓性与出血性疾病的风险。临床上曾经发现1型单纯疱疹病毒性脑炎出现非典型脑室出血的少见并发症[19],同时感染性脑炎容易继发AE[19-20],D-二聚体和FDP的升高可能也与并发感染存在关联。脑脊液检查可以辅助诊断AE[2,3,5,21],诸如脑脊液白细胞>5×106/L,脑脊液寡克隆区带检测阳性或细胞学呈淋巴细胞性炎症。本研究中AE确诊患者脑脊液白细胞增多患者比例更高,其中4例脑脊液白细胞数>100×106/L。少数患者早期脑脊液检查可以无明显异常,因此阴性结果不能排除AE可能。
多因素logistic回归分析表明全血WBC、年龄、精神行为异常和言语障碍是疾病预测的独立相关因素。然而通过ROC曲线分析发现上述指标单独对AE进行预测诊断时,诊断效能都较低。因此进一步对上述指标联合预测诊断的价值进行评估后发现联合全血白细胞、年龄、精神行为异常和言语障碍四个指标对AE发病的预测诊断价值最高,即当全血白细胞计数>7.4 ×106/L,年龄<37.5岁、存在精神行为异常和言语障碍的疑似AE患者最终被诊断为AE的可能性高。进一步分析发现3项指标联合预测与4项指标联合预测所得AUC差异无统计学差异,但综合考虑特异性和敏感性的情况,我们建议首选联合上述4项指标进行综合判断;然而在临床实际应用中,如果只满足其中3项(如WBC、年龄和精神行为异常或WBC、精神行为异常及言语障碍)时,也应高度怀疑AE;尤其对于年龄>37.5岁的患者,综合考虑其他3项指标依然具有一定的诊断价值。当然,该预测模型需要得到进一步的证实。尽管目前尚未有类似的AE预测模型的研究,但对于难以独立开展自身抗体检查的医疗机构而言,本研究结果或许可为AE的早期诊断提供新的思路,对于疑似AE患者而言,基于其血常规指标与特征性临床表现进行综合评估,有助于尽早识别AE患者和开展早期的免疫治疗,使患者受益。
本研究存在一些局限性:回顾性分析的固有缺陷,研究纳入样本量有限,缺乏更多免疫学实验室指标数据。因此研究结论有待更大样本量的研究证实。
综上所述,自身免疫性脑炎临床表现多样,在自身抗体检测无法有效实施前,联合多种常规实验室指标及其特征性临床表现,有助于对AE疑似患者做出早期诊断和干预。
