罗格列酮干预对HSC-T6细胞增殖及细胞PPARγ和HO-1 mRNA水平的影响*
2022-03-21时扣荣顾伟鹰翟巧利
时扣荣,顾伟鹰,刘 娟,罗 兰,翟巧利,范 伟
肝纤维化是各种慢性肝病发展成为肝硬化的必经病理学过程,主要是由于肝星状细胞(HSCs)的过度增殖和活化造成细胞外基质(ECM)过度沉积[1]。研究证据[2,3]表明,肝纤维化过程是可以逆转的,抑制HSCs增殖或诱导其凋亡是阻止肝纤维化发展的潜在的治疗策略。多条信号通路参与了肝纤维化的发生过程,其中最经典的为转化生长因子β(transforming growth factor-β,TGF-β)信号通路,后者可促使HSCs转化为肌成纤维细胞,合成ECM,导致肝纤维化,而HSCs又可释放大量的TGF-β1,促进ECM的合成,加速推动肝纤维化进展[4]。过氧化物酶体增殖物激活受体γ(peroxisome proliforator-activated receptor-γ,PPAR-γ)是TGF-β信号通路中的重要细胞因子。研究[5]指出,PPAR-γ可抑制TGF-β1信号通路,从而抑制ECM的合成,延缓肝纤维化的发生。血红素加氧酶-1(hemeoxygenase-1,HO-1)是PPAR-γ的目的基因,其转录受PPAR-γ的调控[6]。罗格列酮(rosiglitazone,RGZ)属于PPAR-γ激动剂,可抑制HSCs的增殖和迁移,有效抑制肝纤维化的发生和发展[7],但罗格列酮的作用机制尚不清楚。本研究分析了罗格列酮干预对HSC-T6细胞增殖及细胞PPARγ和HO-1 mRNA水平的影响,旨在为深入阐明罗格列酮抑制肝纤维化发生的分子机制。
1 材料与方法
1.1 细胞、试剂与仪器 大鼠HSC-T6细胞购自上海钰博生物科技有限公司,本实验室自行保存、传代培养,备用。罗格列酮购自上海皓元生物医药科技有限公司(取RGZ 0.5 mg,溶于二甲基亚砜溶液100μL,配制成5 mg/mL的储存液,保存于-80℃备用。使用时,用10%胎牛血清稀释成15μmol/L工作液);DMEM培养基、10%优质胎牛血清购自美国Gibco公司;0.25%胰蛋白酶购自赛默飞世尔生物化学制品(北京)有限公司;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)试剂盒购自广州杰特伟生物公司;AnnexinV/PI细胞凋亡检测试剂盒购自上海翊圣生物科技有限公司;总RNA提取试剂盒购自中国天根生物有限公司;cDNA反转录试剂盒、SYBR Green PCR Master Mix购自南京诺唯赞生物科技有限公司;BCA蛋白浓度测定试剂盒购自北京碧云天生物技术研究所;兔抗鼠α-肌动蛋白(α-smooth muscleactin,α-SMA)、抗Ⅰ型胶原(collagen Ⅰ,COLⅠ)、抗Ⅲ型胶原(collagen Ⅲ,COLⅢ)和抗TGF-β1单克隆抗体购自英国Abcam公司;抗β-actin单克隆抗体购自沈阳万类生物科技有限公司;辣根过氧化酶标记的羊抗兔IgG抗体购自北京中杉金桥生物技术有限公司;离心机购自上海天本公司;实时荧光定量PCR扩增仪购自美国Thermo公司。
1.2 细胞培养与处理 取适量的HSC-T6细胞,接种于10 cm培养皿,培养液为DMEM培养基(含有10%优质胎牛血清),培养条件为37℃、5% CO2的加湿培养箱,48 h换液一次。72 h传代一次。当细胞生长状态良好时,进行后续相关实验。将细胞分为对照组、RGZ处理组和RGZ联合HO-1抑制剂ZnPP-IX处理组。在对照组,不予任何处理,在实验组,分别给予15μmol/L RGZ干预或RGZ联合10μmol/L ZnPP-IX干预。
1.3 HSC-T6细胞增殖检测 采用MTT法,取对数生长期的HSC-T6细胞,用0.25%胰蛋白酶1 mL消化,制备成细胞悬液,调整细胞数为1×104个/mL。取100 μL细胞悬液,接种于96孔板,置于37℃、5% CO2的培养箱中培养24 h。当细胞贴壁生长至融合度为 50%后,换用无血清培养基继续培养12 h,按以上要求分别加入RGZ或/和ZnPP-IX干预,每组设置8个复孔,继续培养72 h。每孔加入MTT(5 mg/mL)溶液20μL,再继续培养4 h,终止培养。每孔加入二甲基亚砜溶液150 μL,震荡混匀10 min,于酶标仪490 nm处检测各孔吸光度(absorbance,A)值,计算细胞生长抑制率,即细胞生长抑制率=[对照组A值-实验组A值]/对照组A值×100%
1.4 细胞凋亡检测 使用流式细胞仪检测,细胞处理同上,培养72 h后收集细胞上清,采用不含EDTA的胰蛋白酶消化,1000 r/m离心5 min,各组分别取1 ml加入2 mL离心管中,离心、混匀,并取PI 5μL和AnnexinV-FITC 10μL,充分混匀,置于室温下避光孵育15 min,上流式细胞仪检测,并应用Cell Quest软件计算各组细胞凋亡率。
1.5 细胞PPARγ和HO-1 mRNA水平检测 采用RT-PCR法检测,细胞分组和处理同上。采用总RNA提取试剂盒提取细胞总RNA,使用分光光度计在260 nm和280 nm处测定RNA纯度和浓度。使用cDNA反转录试剂盒合成cDNA,再根据SYBR Green PCR Master Mix说明书进行RT-PCR检测,引物见表1,以β-actin为内参,采用2-△△Ct法计算细胞PPARγ和HO-1 mRNA水平。
1.6 细胞纤维化因子蛋白表达检测 采用Western Blot法,细胞处理同上,收集细胞,加入RIPA蛋白裂解液,提取细胞总蛋白,采用BCA法测定蛋白浓度。取蛋白样品行SDS-PAGE凝胶电泳,再电转移至聚偏二氟乙烯(PVDF)膜上,加5%脱脂奶粉封闭1.5 h,用TBST清洗3次。分别加入一抗(工作浓度 均为1:1000),4℃孵育过夜,用TBST清洗,加入辣根过氧化酶标记的羊抗兔IgG(工作浓度为 1:5000),室温孵育1 h,用TBST再次清洗。以β-actin为内参蛋白,采用ECL化学发光试剂盒显影,在BIO-RAD 成像仪拍照,应用Image J 18.0软件分析目的条带灰度值,即目的蛋白的相对表达量=目的蛋白灰度值/内参蛋白灰度值。

表1 RT-PCR引物序列
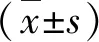
2 结果
2.1各组HSC-T6细胞增殖率比较 本研究对照组A值为(1.0±0.1),RGZ干预组为(0.6±0.1),较对照组细胞增殖活性降低了38.4%(P<0.05),而RGZ联合ZnPP-IX处理组为(0.8±0.1),较对照组降低了17.2%(P<0.05),较RGZ组显著升高(P<0.05),提示RGZ干预可显著抑制HSC-T6细胞增殖,而加入ZnPP-IX干预却能够显著削弱这种抑制作用。
2.2 各组HSC-T6细胞凋亡率比较 RGZ干预组细胞凋亡率显著高于对照组(P<0.05),RGZ联合ZnPP-IX组细胞凋亡率显著高于对照组(P<0.05),但显著低于RGZ组(P<0.05,图1)。
2.3 各组HSC-T6细胞PPARγ和HO-1 mRNA水平比较 RGZ处理细胞PPARγ和HO-1 mRNA水平显著高于对照组(P<0.05),而RGZ联合ZnPP-IX处理细胞 HO-1 mRNA水平显著低于RGZ组(P<0.05,表2)。
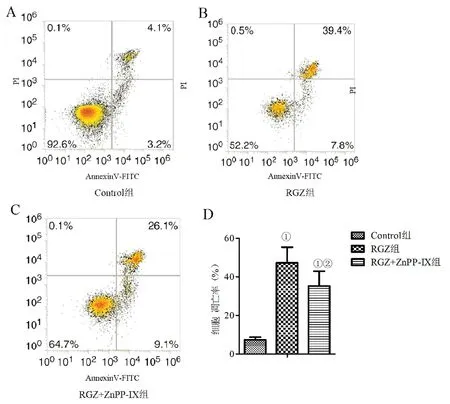
图1 各组HSC-T6细胞凋亡率比较A~C:流式细胞仪检测HSC-T6细胞凋亡;D:RGZ组细胞凋亡率显著高于对照组(①P<0.05),RGZ联合ZnPP-IX组细胞凋亡率显著高于对照组(①P<0.05),但显著低于RGZ组(②P<0.05)
表2 各组HSC-T6细胞PPARγ和HO-1 mRNA水平比较
2.4 各组HSC-T6细胞纤维化因子相关蛋白表达比较 RGZ处理细胞α-SMA、COLⅠ、COLⅢ和TGF-β1蛋白表达显著低于对照组(P<0.05),而RGZ联合ZnPP-IX处理细胞 α-SMA、COLⅠ、COLⅢ和TGF-β1蛋白表达显著高于RGZ组(P<0.05,图2)。
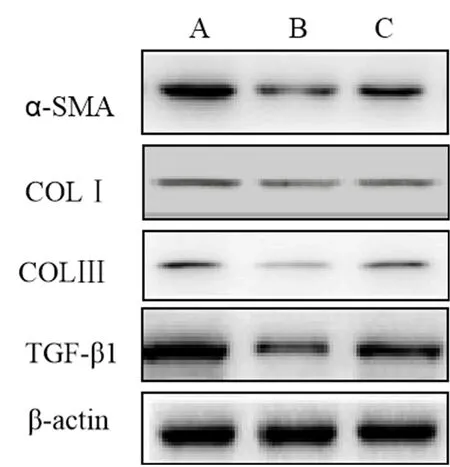
图2 各组HSC-T6细胞相关蛋白表达比较 A:对照组;B:RGZ处理组;C:RGZ联合ZnPP-IX处理组
3 讨论
PPARγ是一种配体激活的转录因子,可调节正常细胞和癌细胞的生长和分化[8-12]。PPARγ在肝脏内主要表达于星状细胞(HSCs),但在活化的HSCs和肌成纤维细胞中缺乏表达[13]。研究[14]指出,PPARγ信号通路的激活能够抑制HSCs的活化,延缓肝纤维化进展,PPARγ有可能作为治疗肝纤维化的一种新的药物作用的靶点。RGZ为胰岛素增敏剂,亦为PPARγ的有效激动剂,近年来其抗纤维化作用越来越受到关注。RGZ能够与PPARγ发生特异性结合,进而抑制TGF-β信号通路,减少炎性细胞因子的分泌、释放,最终发挥抗纤维化作用[15]。为进一步探讨RGZ的抗纤维化作用,本研究采用RGZ干预HSC-T6细胞,结果表明RGZ可显著抑制细胞增殖,并促进细胞凋亡。同时,RGZ干预还可显著降低纤维化因子α-SMA、COLⅠ、COLⅢ和TGF-β1蛋白表达,这些结果均提示RGZ具有抑制细胞增殖、诱导凋亡和抗纤维化的作用。
HO-1是一种限速酶,可催化血红素转化为胆绿素、一氧化碳和游离铁,具有很强的抗氧化、抗炎和调节细胞凋亡的作用[16]。HO-1又被称为热休克蛋白32,是一种HO同工酶,其在正常肝脏中表达于枯否细胞,处于应激状态时肝脏实质细胞和非实质细胞HO-1均呈现高表达[17]。报道[18,19]表明,HO-1在肝脏缺血再灌注损伤、急性肝脏损伤、脂肪性和酒精性肝病等疾病中均可发挥一定的肝细胞保护作用,是一种有应用前景的肝脏疾病治疗靶点。因此,在各种慢性肝病患者,诱导HO-1产生可能对于预防肝纤维化的发生具有重要的意义。HO-1与PPARγ之间存在协同调节作用。一项血管内皮细胞HO-1与PPARγ相互作用的研究[20]表明,HO-1酶活性可介导PPARγ配体的抗炎和抗增殖作用,且HO-1启动子区基因多态性显著影响了PPARα和PPARγ的转录活性。既往研究[21]也显示,HO-1可能通过增加肝组织PPARγ的表达来预防肝纤维化。本研究结果表明,经RGZ干预的HSC-T6细胞PPARγ和HO-1 mRNA水平均显著升高,而在加入HO-1抑制剂ZnPP-IX干预后,HSC-T6细胞HO-1 mRNA水平显著降低,同时HSC-T6细胞增殖和纤维化相关因子的表达亦受到显著抑制,细胞凋亡显著增加。文献报道[22]也表明,RGZ可通过调控PPARγ和HO-1表达,抑制HSCs增殖,减少胶原蛋白分泌和释放。RGZ作为PPARγ的特异性和高效激动剂,可显著上调PPARγ mRNA水平,同时上调HO-1 mRNA水平,而ZnPP-IX是一种选择性的HO抑制剂,可通过阻断一氧化氮的产生和限制血红素向胆绿素转化而抑制HO活性,抑制HO-1 mRNA水平,PPARγ mRNA水平亦有一定幅度的降低,表明PPARγ和HO-1存在双向调控作用。以上结果提示RGZ干预上调PPARγ表达可能是通过调控HO-1表达来发挥抗炎、抗氧化应激和诱导细胞凋亡的作用,进而抑制HSC-T6细胞增殖和纤维化的形成。
