内镜黏膜下剥离术治疗表浅食管鳞癌和癌前病变的长期疗效
2022-03-20陈亚杰罗丽娜常钰朋谭雪娇陈卫刚尚国臣田书信
魏 银,陈亚杰,罗丽娜,常钰朋,谭雪娇,陈卫刚,尚国臣,刘 浩,田书信
(1.石河子大学,新疆 石河子 832000;2.石河子大学医学院第一附属医院,新疆 石河子 832000)
食管癌(EC)是起源于食管上皮组织的恶性肿瘤,在2018年全球癌症统计中,食管癌新发病例占第7位,病死率占第6位[1]。中晚期食管癌5年生存率不足20%,而早期食管癌治疗后5年生存率可达90%[2],因此对早期食管癌及其癌前病变进行有效的切除可显著降低食管癌的致死率。表浅型食管癌(SEC)指的是局限于黏膜层和黏膜下层、无论有无淋巴结转移的食管癌。内镜黏膜下剥离术(ESD)近年发展迅速,逐渐成为表浅食管癌和癌前病变的主要治疗方法之一。本研究探讨ESD治疗表浅食管鳞癌及其癌前病变的疗效和安全性。
1 资料与方法
1.1一般资料:本次研究经过本院医学伦理委员会同意。收集2008年1月~2016年12月在本院消化内镜中心经ESD治疗的表浅食管癌及癌前病变患者66例,男37例,女29例,年龄46~82岁,平均(63.8±8.2)岁。纳入标准:①根据2018年食管癌诊疗规范[3]诊断为表浅食管鳞癌或癌前病变;②术前诊断符合ESD适应证[4];③术后病检为食管表浅鳞癌或癌前病变;④患者临床、病理及随访资料完整。排除标准:①有淋巴管、血管浸润或转移的患者;②有严重心肺功能疾病、严重凝血障碍者(服用抗凝剂者需停药至少1周);③有全身麻醉及内镜操作禁忌证者;④未接受ESD治疗患者。
1.2评价标准:ESD前后标本由经验丰富的病理科医师重新阅片,结果无误入选,诊断有争议的经3位高年资病理医师商定。根据2000年WHO肿瘤分类,将轻度和中度不典型增生归类为低级别上皮内瘤变(LGIN),重度不典型增生和原位癌归类为高级别上皮内瘤变(HGIN)。
1.3随访方法:术后分别隔3个月、6个月、12个月门诊复查胃镜或超声内镜,并行肿瘤指标和相关影像学检查。无残留或复发者以后每年1次连续随访,有残留或复发者视情况继续行内镜下治疗或追加外科手术切除。末次随访日期为2020年12月,或以患者死亡为终点。
2 结果
2.1患者的一般情况:纳入66例患者,7例有2处病灶,检出73处病灶。位于颈段1处(1.4%),食管胸上段10处(13.7%),胸中段43处(58.9%),胸下段19处(26.0%);内镜下巴黎分型Ⅰ型2处(2.7%),Ⅱa型6处(8.2%)Ⅱb型58处(79.5%)Ⅱc型2处(2.7%)混合型5处(6.8%);病变平均长径2.53 cm,最大长径5.2 cm。有66处病灶范围小于全周的 1/2,5处病变范围在环1/2和3/4周之间,2处病变范围到达或超过环3/4周。
2.2ESD术中情况:所有患者均顺利完成手术。1例于剥离过程中见外膜,考虑穿孔,使用钛夹闭合创面。1例术中见贲门黏膜撕裂,用钛夹闭合。术中少量渗血使用热活检钳止血,病变位置出血使用止血夹5处,出血发生率6.8%(5/73),未发生术中大量出血。整块切除率90.4%(66/73),完全切除率89.0%(65/73),治愈性切除率79.5%(58/73)。
2.3ESD术前后病理结果比较:术后病检出表浅食管鳞癌14处(14/73,19.2%),高级别上皮内瘤变36处(36/73,49.3%),低级别上皮内瘤变23处(23/73,31.5%),术前诊断符合率分别为85.7%(12/14)、80.6%(27/36)、91.3%(21/23)。术前活检总准确率为82.2%(60/73)。
2.4ESD术后及随访:术后感染2例,为HGIN患者,给予抗感染治疗后无其他并发症。食管狭窄3例,2例发生于术后6个月内,1例于术后6个月复查发现,行球囊扩张术或支架置入术,无迟发性出血病例。术后3个月复查发现同时性多原发食管癌1例,距瘢痕边缘2 cm发现小片状卢戈染色浅染色区域,活检为高级别上皮内瘤变。1例复发再次行ESD手术。发现异时性多原发食管癌6例,分别发生于术后16个月、42个月、58个月、61个月、84个月、87个月,其中4例通过再次ESD切除病灶,1例因复查活检发现肿瘤浸润至SM2层给予放疗,1例复查发生淋巴结转移死亡。截至2020年12月,随访时间8~138个月,随访中位数76个月,有6例患者死亡,见表1。总死亡率9.1%。统计5年整体生存率96.5%,肿瘤特异性生存率97.0%。
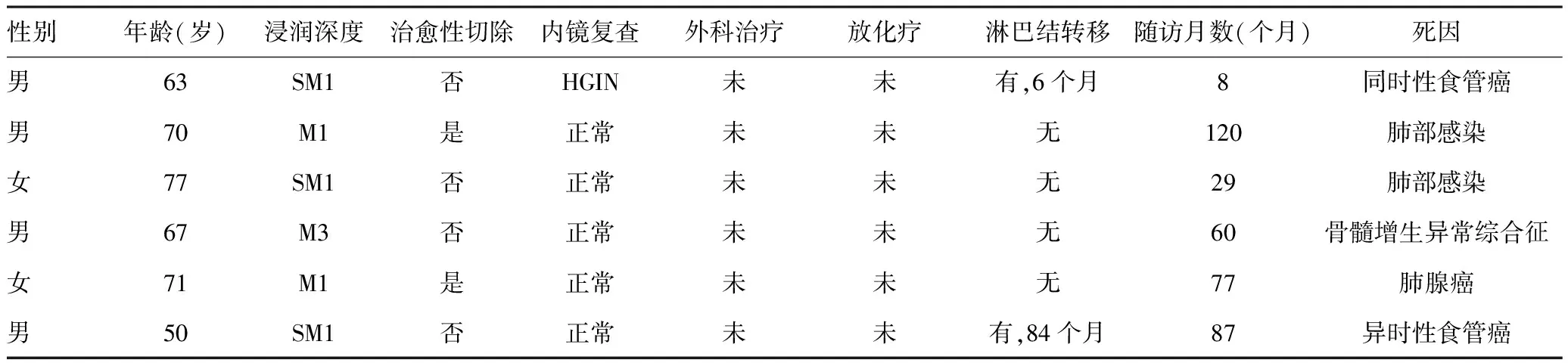
表1 6例患者死亡原因分析
3 讨论
我国是食管癌高发国家,食管癌死亡率位居我国恶性肿瘤第4位[4]。我国以鳞癌为主,胸中段食管多见,颈段最少。内镜技术的发展使食管癌的早期诊断率不断提高,如今无论是外科根治手术,还是内镜下手术,早期食管鳞癌5年生存率均可达到85%以上[4-6]。
相比于外科手术,内镜下治疗早期食管癌并发症更轻,住院时间更短,花费少,术后能提供完整病变标本行病理评估。尽管内镜下治疗的术式现在已经发展出很多种,使用最多的还是内镜下黏膜切除术(EMR)和ESD。ESD由EMR发展而来,两者相比,ESD能够切除的病变层次更深、范围更大,所以切除更完整。一项对1 462名患者的荟萃分析发现,ESD组整块切除率和完全切除率明显高于EMR组,而局部复发率明显低于EMR组[7]。但ESD的优势也为它带来了更易出血和穿孔的弊端,同时ESD较大面积的切除也使得愈合时的疤痕更大,术后更易发生管腔狭窄,国内食管ESD的出血、穿孔、术后食管狭窄率分别为4.88%、11.5%、9.4%[8]。本研究出血率稍高,考虑可能与病变部位、大小和类型、剥离层次、病变的粘连程度、血管分布、操作者的熟练程度等因素相关。穿孔作为食管ESD最严重的并发症之一,容易造成术后食管瘘或纵隔感染,本研究中1例穿孔患者,在术中及时发现并处理,避免了更大的损伤。1例患者术中出现贲门黏膜撕裂,考虑可能与术中充气过度导致胃内压过高有关。有文献证实,病变大小、浸润深度以及创面的环周比例和纵向长度对食管内镜切除术后狭窄发生率影响较大,其中切除范围大于3/4环周和浸润深度超过M2是发生术后狭窄的独立危险因素[9]。本研究中7处病变范围到达或超过环食管1/2周,术后均给予口服激素预防狭窄处理,但仍有3例术后食管狭窄患者,1例病变范围在环1/2到3/4周之间,1例超过环3/4周,需要扩张或置入支架治疗。相较于胃,食管ESD术后迟发性出血发生概率较低,一方面因食管黏膜下组织疏松,不易粘连,另一方面可能与食管相对平直,病变易于剥离有关[10],还有较为少见的食管动力改变,在本研究中均未出现。
内镜活检标本由于取材部位、取材深度及标本数量、大小等的局限,在诊断效能上低于术后病理活检。本研究中术前活检有17.8%(13/73)与术后病检不一致,2处食管早癌和9处高级别上皮内瘤变术前被低估,2处病变的术后病理较前减轻,分析原因可能病变是微小病灶,取样时被活检钳取出。
整块切除是指病灶在内镜下被整块切除并获得单块标本。完全切除是指切除标本的水平和垂直切缘均为阴性。治愈性切除是指切除整块标本的水平和垂直切缘均为阴性且无淋巴结转移风险。国内相关研究报道ESD的整块切除率为80%~100%,完全切除率为75%~100%[11]。本研究中病变整块切除率90.4%(66/73),完全切除率89.0%(65/73),与以上研究接近。非治愈切除相关研究较少,有文献发现黏膜下浸润、非ESD绝对适应证和术中抬举征阴性为非治愈性切除的独立危险因素[12]。随访研究发现非治愈性切除的患者长期生存率明显小于治愈性切除的患者,但在非治愈性切除组中,ESD术后未追加其他治疗患者与追加开放性手术或者放疗患者的生存率差异无统计学意义[13]。另一项类似研究却发现未经治愈性切除的早期食管癌患者也可表现出良好的长期生存状况[14]。推测对于非治愈性切除的早期食管癌患者,密切随访可能也是一种选择,但该结论还需更大样本量研究支持。
同时性多原发食管癌是指内镜治疗后12个月以内在原切除部位1 cm以外发现的新食管癌病灶,本研究中该例患者半年后发现淋巴结转移,推测原因可能为治疗时遗漏的微小癌灶[15]。异时性多原发食管癌是指内镜治疗后超过12个月在原切除部位1 cm以外发现的新食管癌病灶。研究发现,肿瘤患者更易发生异时性癌[16],但治疗后异时癌预后与单发癌无差异,长期随访异时癌与首发癌预后相当[17]。本研究中4例异时性癌患者及1例复发患者再次行ESD,术中及术后均未出现严重并发症。术后随访2例患者死于转移性食管癌,1例为同时性癌患者,建议外科手术治疗,患者因故未及时手术,出现淋巴结转移;1例为随访87个月的异时性癌患者,因后期未重视复查,发现时已出现淋巴结转移,这提示我们无论何时都应重视早诊早治工作,食管癌高危患者更要按时复查胃镜,对早期肿瘤及癌前病变提早干预治疗。1例死于肺部感染患者生存时间较短,考虑可能与术后反复食管狭窄所致营养状况差、吸入风险高有关。
综上所述,ESD是一项安全、有效的治疗食管表浅病变的方法,值得临床推广,同时,密切且规范地随访也是至关重要的。然而本研究为单中心回顾性研究且例数有限,出现严重术后并发症例数较少,其结论有待多中心大样本量的随机对照试验等论证强度较高的研究方案证实。
