血清Perlecan DV与急性脑梗死患者预后的关系
2022-03-19田章林魏有东
熊 密,田章林,龙 波,魏有东
(重庆医科大学附属第一医院神经内科,重庆 400016)
急性脑梗死是最常见的脑血管疾病类型,具有高病死率和致残率[1]。在脑梗死发生后早期进行预后评估有助于制定治疗方案、合理分配卫生资源及优化护理[2]。
Perlecan是一种细胞外基质蛋白聚糖,包含5个不同的蛋白结构域,其中结构域V(domain V,DV)为Perlecan C端部分片段[3]。在脑梗死后1~2 h至7 d,Perlecan在蛋白酶水解作用下产生Perlecan DV(PDV),其浓度稳定而持续升高[4]。LEE等[5]发现,PDV上调大脑内皮细胞中血管内皮生长因子(VEGF),其与VEGF受体结合具有神经保护、促进神经再生、血管生成等作用。此外,血脑屏障的完整性在发生脑梗死后遭受破坏[6-7]。NAKAMURA等[8]发现,阻断小鼠大脑中动脉血流后PDV募集周细胞向被破坏的血脑屏障迁移,维持并修复血脑屏障的完整性。作为一个潜在的内源性保护因子,目前尚无临床研究证实PDV与脑梗死的关系。本研究旨在验证PDV在急性脑梗死患者血清中的表达,探讨其与脑梗死90 d后预后的关系。
1 资料与方法
1.1一般资料 前瞻性选取2020年6月至2021年3月本院神经内科收治住院的发病72 h内的新发急性脑梗死患者131例(脑梗死组),其中男77例(58.8%),女54例(41.2%);平均年龄(65.9±12.6)岁。同时选取与脑梗死组患者性别、年龄相匹配的健康体检者30例作为对照组,其中男17例(56.7%),女13例(43.3%);平均年龄(61.6±12.8)岁。排除脑卒中、蛛网膜下腔出血、脑创伤病史、帕金森病、阿尔茨海默病、颅内感染或其他中枢神经系统疾病史、合并恶性肿瘤或其他终末期疾病等。本研究经本院伦理委员会批准(审批号:2020-593),并获得研究对象知情同意。
1.2方法
1.2.1资料收集 收集2组研究对象基线资料,包括年龄、性别等人口学特征,病史(糖尿病、高血压、冠心病等)及入院常规实验室检查结果,如血常规、炎症指标、肝肾功能、电解质、心肌酶谱和凝血功能等。
1.2.2高胆固醇血症、高血压、糖尿病诊断标准 (1)总胆固醇大于5.2 mmol/L定义为高胆固醇血症;(2)高血压、糖尿病的诊断参照相关指南[9-10]。
1.2.3计算脑梗死体积及白质病变分级 (1)测量头颅磁共振DWI序列上病灶长径(A)、短径(B)、层高(C),并使用ABC/2公式计算脑梗死体积[11];(2)根据Fazekas分级,在T2WI或Flair图像上将白质病变分级为0~3级[12]。
1.2.4病情严重程度评估及分型 使用美国国立卫生研究院卒中量表(NIHSS)评估脑梗死患者病情严重程度,根据急性卒中Org10172治疗试验分型标准分为大动脉粥样硬化(LAA)、心源性栓塞(CE)、小血管闭塞(SVO)、其他原因型和不明原因型[13]。
1.2.5血清PDV水平测定 采集2组研究对象上午8:00肘静脉血,3 000 r/min离心5 min,将获得的血清储存在-80 ℃的冰箱中,并保存至检查。使用酶联免疫吸附试验试剂盒测定血清PDV水平,灵敏度为0.1 ng/mL。
1.2.6预后评估 通过电话或门诊评估脑梗死患者3个月后改良Rankin量表(mRS)得分。mRS为7级评分量表,从完全无症状(0级)至死亡(6级),mRS≤2分表示预后良好,mRS>2分表示预后不良。
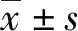
2 结 果
2.12组研究对象一般资料比较 2组研究对象年龄、性别比较,差异均无统计学意义(P>0.05)。脑梗死组患者NIHSS评分为4.0(2.0,9.3)分,发病时间为12(5.0,27.0)h,梗死体积为3.2(0.4,9.2)mL,Fazekas分级为1.0(1.0,2.0);LAA型61例(46.6%),CE型24例(18.3%),SVO型38例(29.0%),其他原因型4例(3.1%),不明原因型4例(3.1%)。
2.2预后良好组和预后不良组患者一般资料比较 131例脑梗死患者中预后良好77例(58.8%,预后良好组),预后不良54例(41.2%,预后不良组),包括死亡患者15例(11.5%)。预后不良组患者年龄、冠心病、心房颤动(房颤)、NIHSS评分、梗死体积、Fazekas分级、空腹血糖、D-二聚体均明显高于预后良好组,差异均有统计学意义(P<0.05);预后不良组患者PDV水平与预后良好组比较,差异无统计学意义(P>0.05)。见表1。

续表1 预后良好组和预后不良组患者一般资料比较
2.32组研究对象血清PDV水平比较 与对照组比较,脑梗死组患者PDV水平明显升高,差异有统计学意义(P<0.05)。LAA、CE、SVO组患者PDV水平均明显高于对照组,但LAA、CE、SVO组患者PDV水平比较,差异无统计学意义(P>0.05)。见图1。

与对照组比较,aP<0.05。
2.4脑梗死患者PDV与其他连续变量的关系 脑梗死组患者PDV与年龄呈正相关(r=0.205,P=0.019);与NIHSS评分、发病时间、梗死体积、Fazekas分级均无关。≤66岁患者PDV水平与大于66岁患者比较,差异无统计学意义(U=-1.853,P=0.064)。
2.5急性脑梗死患者预后的影响因素 PDV与预后无关(OR=0.999, 95%CI:0.996~1.003,P>0.05)。年龄、吸烟史、冠心病、房颤、NIHSS评分、梗死体积、Fazekas分级、白细胞、超敏C反应蛋白、D-二聚体为急性脑梗死患者预后的影响因素,差异均有统计学意义(P<0.05)。见表2。NIHSS评分、Fazekas分级(OR=1.252、2.322,95%CI:1.079~1.454、1.046~5.154,P=0.003、0.038)为急性脑梗死患者预后的独立影响因素。

表2 单因素logistic回归模型分析
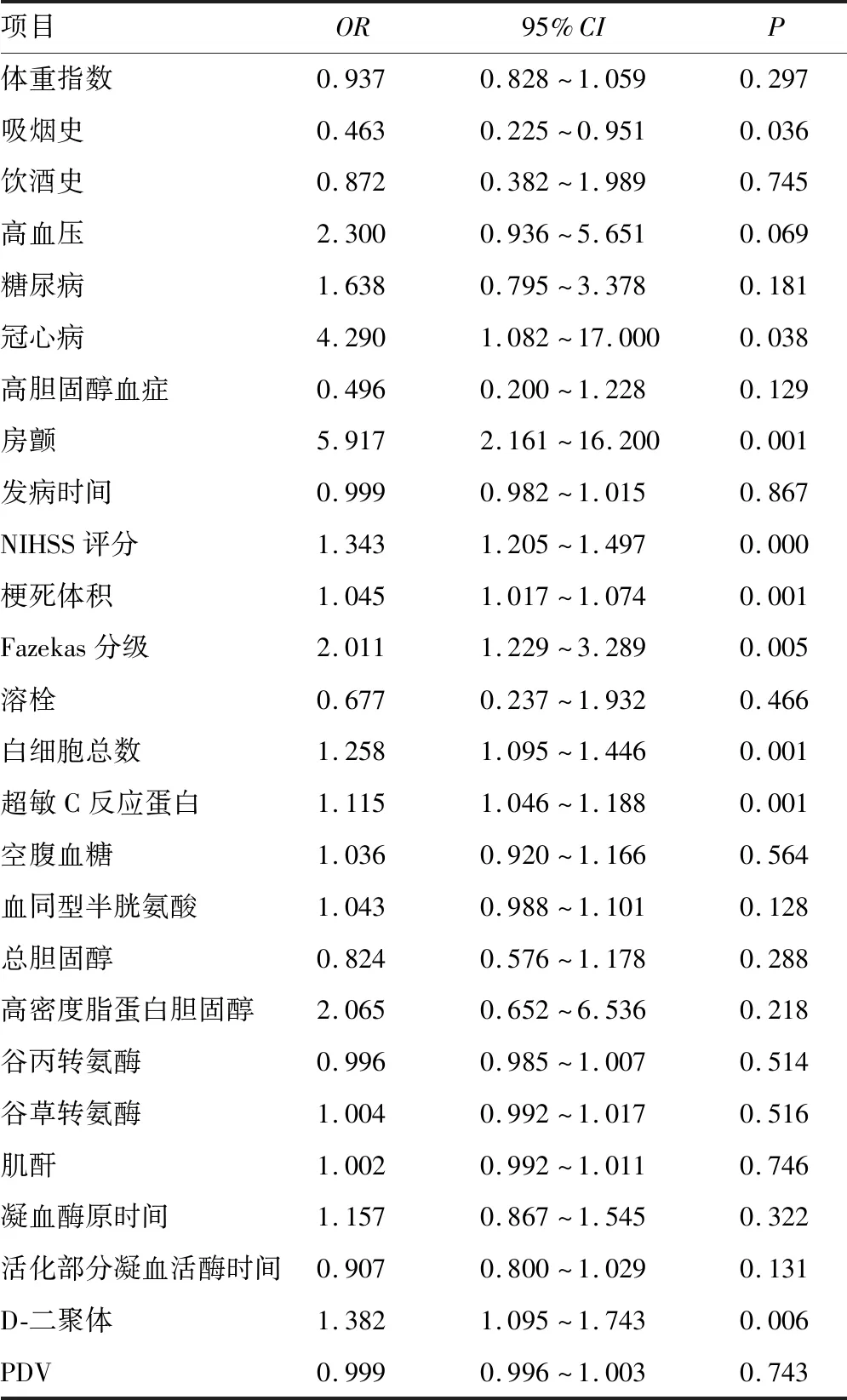
续表2 单因素logistic回归模型分析
3 讨 论
目前,脑梗死的治疗主要包括急性期静脉溶栓和机械取栓;二级预防包括血压管理、降脂、抗血小板、针对病因的抗凝、颈动脉内膜切除术等[14]。然而,在充分的治疗下脑梗死患者致残率、病死率、复发率仍居高不下,故急需寻找新的治疗方式。从研究发生脑梗死后自身修复机制出发,寻找内源性保护因子不失为一种思路。在小鼠及大鼠模型中梗死后脑组织损伤导致PDV升高,PDV具有神经保护属性。PDV通过与整合素α5β1结合,上调大脑内皮细胞VEGF表达,进而与VEGF受体结合具有神经保护、神经再生、血管生成等作用[5]。此外,PDV通过协同血小板源性生长因子受体β和整合素α5β1作用募集周细胞向被破坏的血脑屏障迁移,从而维持和修复血脑屏障的完整性[8]。LEE等[5]在小鼠脑梗死后24 h向循环中注射PDV,PDV可从外周循环到达梗死部位及其周围血管区域,小鼠运动功能得到迅速改善。故假设PDV为急性脑梗死预后的有益因素。
本研究结果显示,与对照组比较,脑梗死患者血清PDV水平更高。然而,预后良好组患者PDV水平与预后不良组比较,差异无统计学意义(P>0.05),且PDV与急性脑梗死患者预后无关。对此解释如下:本研究测定了血清游离PDV水平,而此前的研究证实的是动物脑组织中PDV的表达。PDV在人体脑组织中及脑脊液中的浓度,以及PDV是否与血液中其他物质结合,从而影响游离PDV水平尚需进一步研究。此外,VEGF作用具有双重性,一方面,增加血脑屏障通透性,造成脑水肿和梗死面积扩大;另一方面,促进血管生成,发挥神经保护作用[15]。LEE等[5]发现,注射PDV后脑梗死小鼠运动功能得到改善,但其最长观察期仅为15 d,结合VEGF的双重作用,推测VEGF在急性期发挥保护作用以改善早期运动功能,但因其同时具有增加血脑屏障通透性等有害作用,对长期预后没有影响。
此外,本研究发现,高NIHSS评分、严重白质病变与急性脑梗死患者预后不良相关。与之前相关研究结果一致[16-17]。本研究Spearman相关分析表明,年龄与PDV呈正相关,然而进一步的亚组分析没有发现年龄较小组(≤66岁)与年龄较大组(>66岁)PDV水平的差异。外周血PDV表达是否受年龄影响尚需进一步研究。
本研究存在如下缺点:(1)仅测量了一个时间点的PDV水平,需对PDV进行多次测量,观察其动态改变;(2)本研究为单中心研究且样本量较少,PDV与急性脑梗死患者预后的关系尚有待于进行大样本、多中心研究。
综上所述,本研究首次从临床方面探讨了血清PDV与急性脑梗死患者预后的关系。结果显示,与对照组比较,急性脑梗死患者血清PDV水平明显升高。然而,血清PDV水平对急性脑梗死患者的预后无明显的预测价值。
