1株白魔芋软腐病病原菌鉴定及其室内药剂筛选
2022-03-18罗林丽赵兴丽周罗娜贺圣凌刘思睿周玉锋
罗林丽,赵兴丽,周罗娜,贺圣凌,刘思睿,张 欣,罗 可,周玉锋
(1贵州省农业科学院生物技术研究所, 贵州 贵阳 550006;2贵州省农业生物技术重点实验室,贵州 贵阳 550006;3贵州省农业科学院茶叶研究所, 贵州 贵阳 550006)
0 引言
【研究意义】魔芋(Amorphophallus)是天南星科魔芋属多年生草本植物的总称,栽培学上属薯芋类作物,葡甘聚糖型魔芋是目前发现的仅有几种能合成葡甘露聚糖(Konjac glucomannan,KGM)的经济作物之一(刘佩瑛,2004;代雪凤等,2021)。魔芋KGM因独特的理化特性已被广泛用于食品、医疗、日用化工和农业等领域,具有广阔的市场前景(Yuan et al.,2018;Zhang et al.,2018;李嘉欣等,2020;Du et al.,2021;夏玉婷等,2022)。白魔芋(A.albus)为我国特有种,自然分布于四川南部和云南北部的金沙江干热河谷地区(刘佩瑛,2004),与传统种植的花魔芋(A.konjac)和珠芽魔芋(A.bulbifer)相比,白魔芋在KGM含量和品质上更具优势,且因其在耐热性、抗病性、抗褐变等方面强于花魔芋和珠芽魔芋,所以近年来被引种到贵州、湖北、云南、重庆等地(刘二喜,2016)。近年来,随着魔芋市场需求的不断增长,魔芋人工种植呈现规模化,魔芋病害也越来越严重,软腐病、根腐病等多种病害严重制约着魔芋产量的提高,其中以魔芋软腐病最严重。魔芋软腐病是一种细菌性病害,其侵染性强,魔芋整个生活周期均可染病,该病害传播快、防治难,迄今为止尚无特效防治方法(徐佳欣等,2018)。因此,明确魔芋软腐病病原的种类,并针对性地开展药剂筛选,对魔芋软腐病的田间防控具有重要意义。【前人研究进展】已报道的魔芋软腐病病原主要是果胶杆菌属(Pectobacterium)和迪基氏菌属(Dickyeya)菌株。最早的研究认为魔芋软腐病病原菌为胡萝卜欧文氏菌胡萝卜亚种[Erwinia carotovorasubsp.carotovora,后更名为胡萝卜果胶杆菌胡萝卜亚种(P.carotovorumsubsp.carotovorum)],该菌株会因宿主作物的不同而表现出不同强弱的致病力(沈业寿和储苏,2002;刘佩瑛,2004)。随着分子生物学的发展,相关研究在形态和生理生化分析的基础上,结合16S~23S rDNA转录间隔区的序列分析鉴定花魔芋软腐病的病原菌主要是胡萝卜果胶杆菌胡萝卜亚种和菊果胶杆菌[P.chrysanthemi,后被更名为菊迪基氏菌(D.chrysanthemi)]2种(修建华等,2006;王健等,2009;Wu et al.,2011;孙苗苗,2019;Sun et al.,2019)。近年又发现了其他的魔芋软腐病病原,魏环宇等(2020)基于形态学观察和生理生化及16S rDNA序列分析,将从云南珠芽魔芋分离到的软腐病致病菌鉴定为环状果胶杆菌(P.aroidearum);Wei等(2020)首次报道环状果胶杆菌引起花魔芋软腐病;崔双等(2021)从云南魔芋产区的发病植株中分离到3株魔芋软腐病致病菌,通过形态、致病性和分子特征分析鉴定3株菌株均为环状果胶杆菌;李珩珺(2021)分别从患病的珠芽魔芋和花魔芋中分离软腐病菌,经形态学观察和16S rDNA鉴定确定环状果胶杆菌为花魔芋的致病菌,而导致珠芽魔芋患软腐病的是一株未知菌株,尚未确定。在生产实践中,魔芋软腐病的防治存在一定困难,通过合理密植、轮作、间套作等栽培措施,可在一定程度上降低发病率。实际生产中魔芋软腐病防治主要依赖化学药剂,但多选用广谱杀菌剂,存在一定盲目性,常用药剂有各种含铜制剂、异氰尿酸类杀菌剂、噻唑类等(古洪辉等,2018;王红岩等,2019)。李江涛(2014)研究表明72%农用硫酸链霉素灌根处理对魔芋软腐病的防治效果达89%。和积飞(2018)通过田间药效试验发现20%叶枯唑可湿性粉剂和20%噻菌铜悬浮剂对魔芋软腐病的防治效果优于72%硫酸链霉素可溶性粉剂和53.8%氢氧化铜水分散粒剂。【本研究切入点】本课题组在前期的调查中发现贵州省兴义市安龙县白魔芋种植基地出现了一种细菌性病害,而白魔芋一直被认为是抗病性较强的品种,目前未见白魔芋软腐病方面的研究报道,因此有必要开展白魔芋软腐病病原菌鉴定和防治药剂筛选工作。【拟解决的关键问题】采用平板划线分离法对白魔芋软腐病病原菌进行分离纯化,结合形态、致病性和分子生物学分析鉴定病原菌种类,并探究13种杀菌剂对病原菌的室内抑制活性,以期为白魔芋软腐病田间防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 病样来源 病样于2020年6月采自贵州省兴义市安龙县白魔芋种植基地发生软腐病的田块。
1.1.2 培养基 NA培养基:牛肉浸膏3.0 g/L,胰蛋白胨5.0 g/L,葡萄糖2.5 g/L,琼脂15.0 g/L,pH 7.0。LB固体培养基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠10.0 g/L,琼脂15.0 g/L,pH 7.0;LB液体培养基不加琼脂。
1.1.3 供试药剂 室内抑菌试验的供试药剂见表1。
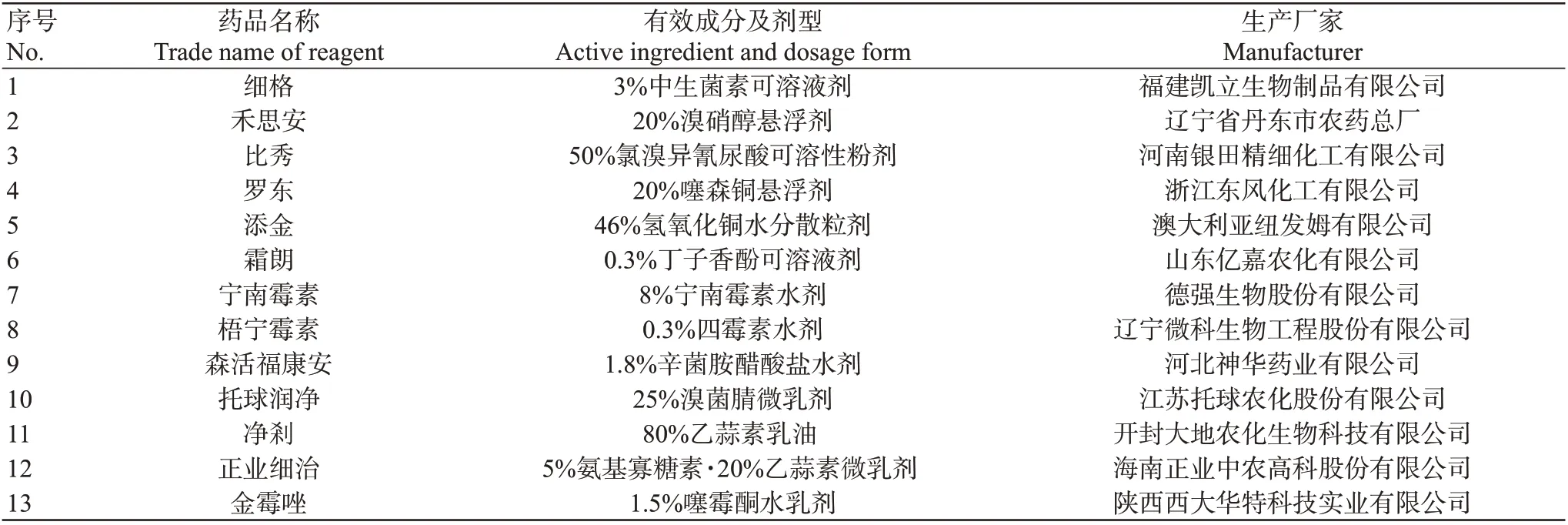
表1 供试药剂Table 1 Experimental reagents
1.2 试验方法
1.2.1 病原菌分离纯化 利用平板划线分离法分离病原菌(林可竟等,2021)。取发病白魔芋植株茎部组织的病健交界处切成小块,利用75%医用酒精进行表面消毒2 min,用无菌去离子水漂洗3次,随后将病样组织置于盛有1 mL无菌水的10 mL离心管中捣碎,使病样组织中的细菌流出,制成细菌悬浮液,利用无菌接种环取细菌悬浮液在NA培养基上划线,置于28 ℃培养24 h,根据菌落的形态特征,继续挑取单菌落进行纯化培养,转接纯化3次后的纯培养物于4 ℃保存备用。
1.2.2 致病性测定 将分离得到的菌株接种于LB液体培养基中,于28 ℃下180 r/min培养24 h,得到菌悬液。分别对健康白魔芋盆栽植株和新鲜健康白魔芋球茎进行人工接种,接种前用75%医用酒精对魔芋植株接种茎干和球茎表面擦拭消毒,晾干后用无菌针刺伤魔芋茎干和球茎的表皮层,然后取10 μL菌悬液接种到针刺伤的伤口处,每天观察记录发病情况,设接种无菌水为对照。从接种发病的魔芋茎干和球茎组织中重新分离病原菌,利用柯赫氏法则对病原菌进行验证。
1.2.3 病原菌形态观察 观察并记录病原菌株在LB固体培养基上的菌落形态特征,在扫描电子显微镜观察病原菌的形态特征、菌落形状、大小等。
1.2.4 分子生物学鉴定 将2次分离得到的病原菌菌株接种于LB液体培养基中,28 ℃下200 r/min培养24 h,利用细菌基因组DNA提取试剂盒DP302[天根生化科技(北京)有限公司]提取菌株的总DNA。采用16S rDNA的通用引物27F/1492R(Osborne et al.,2005)对病原菌菌株的基因组进行PCR扩增,扩增酶为PrimeSTAR®HS DNA Polymerase(TaKaRa公司)。PCR产物电泳检测后送北京擎科新业生物技术有限公司进行序列测定。测序结果经校验后提交GenBank数据库,并利用MEGA 6.06构建系统发育进化树。
1.2.5 杀菌剂对病原菌的室内抑菌试验 参照冯迪南等(2018)采用抑菌圈法开展不同杀菌剂对病原菌的抑菌试验。将病原菌单菌落接种于50 mL LB液体培养基中,28 ℃下200 r/min摇床培养24 h,调整OD600约为0.5,同时将LB固体培养基高温高压灭菌后冷却至50 ℃左右,每100 mL加入1 mL病原菌菌液,充分混匀后倒入90 mm无菌培养皿中,制成每皿20 mL的含魔芋软腐病病原菌的LB平板,待含菌LB平板凝固后,用5 mm打孔器在平板上打孔,并在孔内加入50 μL杀菌剂,每个药剂浓度3次重复,以无菌水作对照。28 ℃培养20 h后,测量抑菌圈直径,并计算杀菌剂对病原菌生长的抑制率。抑制率(%)=(处理组抑菌直径-对照组抑菌直径)/处理组抑菌直径×100。针对有抑菌效果的杀菌剂,在DPS 7.05进行一元回归分析,以杀菌剂的有效成分浓度的对数为自变量x,对应的抑制率的几率值为因变量y,得到毒力回归方程,并比较不同杀菌剂的抑制中浓度(EC50)和相关系数(r)。
1.3 统计分析
利用DPS 7.05对室内毒力测定的试验数据进行方差分析,采用Duncan’s新复极差法比较各药剂在不同浓度下的抑制率,进行显著性分析。
2 结果与分析
2.1 田间病害特征
田间调查发现,白魔芋软腐病多发生在植株茎干部位,整个生长期均可发病,病害初期在茎干上出现小面积的水渍状斑点,病斑会不断扩大导致茎干部组织腐烂,有汁液流出,伴随有臭味,最终导致整株倒伏(图1)。

图1 白魔芋软腐病的发病症状Fig.1 Symptoms of soft rot on A.albus
2.2 病原菌分离与鉴定结果
2.2.1 病原菌的分离与致病性验证 从采集的白魔芋病样组织中共分离得到6株菌株。取分离得到的菌株分别对健康白魔芋盆栽植株和新鲜健康白魔芋球茎进行人工接种,其中仅有菌株XYmy-A1对白魔芋产生病症。将菌株XYmy-A1回接到魔芋植株的茎干上,48 h开始出现水渍状斑点,随后不断扩大,第6 d整株倒伏(图2-A);将菌株XYmy-A1接种到刺伤的白魔芋球茎表面,48 h后接种部位出现轻微水渍状,随后开始腐烂、变软,腐烂部位不断扩大,并伴有恶臭味,将球茎切开可看到脓状的腐烂组织(图2-C-1和图2-C-2);对照组均无症状(图2-B和图2-D),说明菌株XYmy-A1在白魔芋茎部和球茎部均可致病。发病后从发病组织上重新分离的菌株与接种菌株XYmy-A1一致,说明该菌株为白魔芋软腐病的病原菌。

图2 白魔芋植株和球茎接种菌株XYmy-A1后的软腐病病症Fig.2 Soft rot symptoms on A.albus plants and corms after inoculation with strain XYmy-A1
2.2.2 菌株XYmy-A1的形态特征 菌株XYmy-A1在LB固体培养基上为乳白色的菌落,菌落表面光滑,中间隆起(图3-A),革兰氏染色为阴性(图3-B)。扫描电镜下观察,菌株XYmy-A1呈短杆状,两头钝圆,具有多根鞭毛(图3-C)。
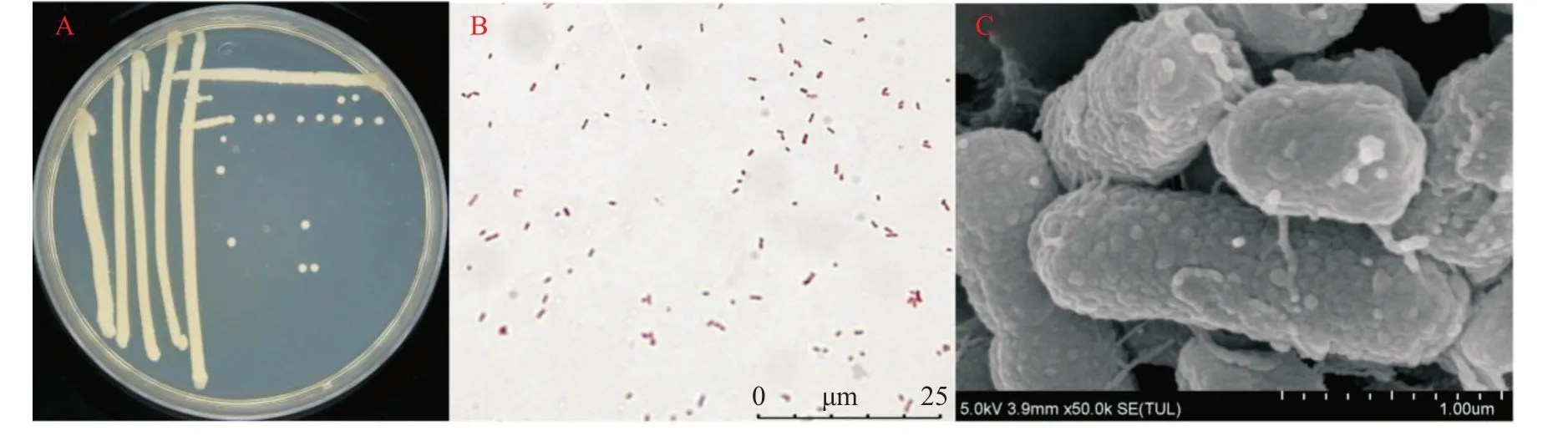
图3 菌株XYmy-A1的形态Fig.3 Morphological characteristics of strain XYmy-A1
2.2.3 菌株XYmy-A1分子生物学鉴定 测序结果显示,菌株XYmy-A1的16S rDNA序列长度为1451 bp(GenBank登录号:OM721736)。NCBI序列比对结果显示,菌株XYmy-A1的16S rDNA序列与已报道的菌株Pectobacterium aroidearumstrain SCRI 109(NR159926.1)的相似性为99.72%。以迪基氏菌属(Dickeya dieffenbachiae)为外群,构建基于16S rDNA序列的系统发育进化树,结果(图4)显示,菌株XYmy-A1与环状果胶杆菌(P.aroidearum)聚为一个类群,而与胡萝卜果胶杆菌(P.carotovorum)、马蹄莲果胶杆菌(P.zantedeschiae)、黑腐果胶杆菌(P.atrosepticum)和山葵果胶杆菌(P.wasabiae)的亲缘关系较远。

图4 基于16S rDNA序列构建的菌株XYmy-A1系统发育进化树Fig.4 Phylogenetic tree of strain XYmy-A1 constructed based on 16S rDNA sequence
结合形态、致病性和16S rDNA序列系统发育分析结果,确定引起白魔芋软腐病的病原菌XYmy-A1为环状果胶杆菌。
2.3 杀菌剂对菌株XYmy-A1的室内抑菌活性
室内平板抑菌试验结果(表2)显示,供试的13种杀菌剂中,只有80%乙蒜素乳油、5%氨基寡糖素·20%乙蒜素微乳剂、25%溴菌腈微乳剂、3%中生菌素可溶液剂、0.3%四霉素水剂、1.5%噻霉酮水乳剂和1.8%辛菌胺醋酸盐水剂7种杀菌剂对病原菌的生长具有抑制作用,且不同杀菌剂的抑制效果存在差异。80%乙蒜素、5%氨基寡糖素·20%乙蒜素微乳剂、25%溴菌腈微乳剂、3%中生菌素可溶液剂和0.3%四霉素水剂5种杀菌剂在5个梯度浓度下均有明显的抑制效果,而1.5%噻霉酮水乳剂和1.8%辛菌胺醋酸盐水剂只有在高浓度时才具有抑菌效果。7种杀菌剂室内毒力测定结果(表3)显示,0.3%四霉素水剂对菌株XYmy-A1的抑制活性最强,其EC50较低,为0.1980 mg/L,说明病原菌株对该杀菌剂最敏感,5%溴菌腈微乳剂次之,其EC50为9.1359 mg/L,1.8%辛菌胺醋酸盐水剂对病原菌的抑制作用最差,其EC50较高,为654.5806 mg/L。

表2 不同杀菌剂对菌株XYmy-A1的抑菌效果Table 2 Inhibitory activity of different bactericides against the pathogen strain XYmy-A1
3 讨论
果胶杆菌属的菌株高度异质化,目前已被报道的有10多种,其宿主范围广泛,可引起多种植物的软腐病(Ma et al.,2007;商雨等,2015;冯洁,2017;Portier et al.,2019)。Nabhan等(2013)基于表型、DNA-DNA杂交、16S rDNA和多位点序列分析等将环状果胶杆菌从胡萝卜果胶杆菌中分离出来,确立为一个新种,认为该菌株主要侵染和引发单子叶植物细菌性软腐病,随后,该物种首次在我国报道为大白菜软腐病的病原菌,并发现在人工接种条件下该菌株还可侵染多种单、双子叶植物(李晓颖等,2018;Xie et al.,2018)。该病原菌的已知寄主范围不断扩大,近年来在天南星科如半夏、芋头、合果芋、花魔芋和珠芽魔芋等多种作物上均有发现由环状果胶杆菌侵染引起的软腐病(魏环宇等,2020;Wei et al.,2020;Xu et al.,2020;Wang et al.,2021;赵玳琳等,2022),但目前尚无针对白魔芋软腐病的相关研究报道。本研究分离、鉴定白魔芋软腐病病原菌菌株XYmy-A1,其引起的病症与其他魔芋软腐病的发病症状相似,系统进化树分析显示其与环状果胶杆菌的相似性最高,但与已报道的引起魔芋软腐病的病菌环状果胶杆菌不同(孙苗苗,2019;Sun et al.,2019;魏环宇等,2020;Wei et al.,2020;崔双等,2021),推测可能是病原菌适应不同环境因素及宿主作物不同,使得不同环境因素及宿主作物的优势病原菌株也存在差异。
杀菌剂对病原菌的室内毒力是衡量药剂对病原菌毒力大小的一个重要指标,能直接体现药剂对病原菌的抑制或致死能力(赵洪涛等,2019)。本研究的室内毒力测定结果显示,80%乙蒜素乳油、5%氨基寡糖素·20%乙蒜素微乳剂、25%溴菌腈微乳剂、3%中生菌素可溶液剂和0.3%四霉素水剂5种杀菌剂在供试浓度下对白魔芋软腐病病原菌生长具有抑制作用,1.5%噻霉酮水乳剂和1.8%辛菌胺醋酸盐水剂只有在高浓度下对白魔芋软腐病病原菌生长具有抑制作用,其余杀菌剂均无抑制效果。有抑制效果的杀菌剂可大致分为三类:化学杀菌剂(25%溴菌腈微乳剂、1.5%噻霉酮水乳剂和1.8%辛菌胺醋酸盐水剂),新型植物仿生农药(80%乙蒜素乳油和5%氨基寡糖素·20%乙蒜素微乳剂)以及农用抗生素类(3%中生菌素可溶液剂和0.3%四霉素水剂)。溴菌腈是一种广谱性杀菌剂,尤其是对炭疽病的防治效果较好(肖敏等,2017;韩文启等,2018),蒙姣荣等(2015)发现溴菌腈对桑树细菌性枯萎病菌有一定的抑制效果;叶火春等(2020)发现丙硫唑与溴菌腈以质量比1∶2混配对杧果细菌性角斑病菌田间防效高达80%。本研究中白魔芋软腐病病原菌XYmy-A1对25%溴菌腈微乳剂的敏感性很高,1600倍液(有效浓度156.25 mg/L)时的抑制率达71.95%,EC50为9.1359 mg/L。噻霉酮多用于防治真菌病害,近年来也有少量利用噻霉酮防治细菌性病害的研究,范可地等(2018)发现3%噻霉酮可湿性粉剂在田间能有效防治水稻细菌性条斑病,尤其是与20%噻唑锌悬浮剂或20%噻菌酮悬浮剂复配使用的效果更佳;冯迪南等(2018)发现1.5%噻霉酮水乳剂对马铃薯软腐病病原菌具有平板抑菌效果,但本研究发现1.5%噻霉酮水乳剂在高于推荐使用浓度时才对菌株XYmy-A1有抑制效果。乙蒜素是大蒜素的同系物,其作为一种植物仿生农药被广泛应用于防治棉花枯萎病等,近年来也有少量关于其对细菌性病害的防治研究,如张京等(2021)通过室内和田间药效试验发现,80%乙蒜素乳油可作为防治大豆细菌性斑点病的首选药剂。本研究中白魔芋软腐病病原菌对80%乙蒜素乳油和5%氨基寡糖素·20%乙蒜素微乳剂的敏感性也较高,80%乙蒜素乳油在2000倍液(有效成分浓度为400.00 mg/L)时的抑制率可达60.00%以上,EC50为99.9482 mg/L,因此,乙蒜素是一种对抑制白魔芋软腐病病原菌有效的杀菌剂,但其与氨基寡糖素复配使用能否协同增效还有待田间进一步验证。农用抗生素类杀菌剂0.3%四霉素水剂与3%中生菌素可溶液剂相比,0.3%四霉素水剂在1000倍液(有效成分浓度为3.00 mg/L)时对菌株XYmy-A1的抑制率可达65.71%,EC50为0.1980 mg/L,而3%中生菌素可溶液剂在1000倍液(有效成分浓度为30.00 mg/L)时的抑制率为35.44%,EC50为102.5101 mg/L,因此,0.3%四霉素水剂可作为一种首选药剂与其他药剂交替使用以防治白魔芋软腐病。本研究仅限于室内平板筛选的毒力测定结果,有一定的局限性,如铜制剂、内吸性杀菌剂氯溴异氰尿酸等在平板上的抑菌效果虽然未体现出来,但也不能否定其田间的利用效果,且不同的杀菌剂在植物上的作用机理不同,其对病害的防治效果也不同(张卢慧等,2021)。因此,筛选获得的杀菌剂还需进一步开展田间试验确定其防治效果及最适浓度,以便为田间病害防控提供依据。
4 结论
引起贵州省安龙县白魔芋软腐病的病原菌为环状果胶杆菌,可首选0.3%四霉素水剂和25%溴菌腈微乳剂进一步开展田间防效试验,1.5%噻霉酮水乳剂、3%中生菌素可溶液剂、80%乙蒜素乳油和5%氨基寡糖素·20%乙蒜素微乳剂可作为备选药剂。
