肿瘤相关巨噬细胞与弥漫大B细胞淋巴瘤预后的关系
2022-03-18罗燕珍周达陈思静廖成成王明月谭晓虹柯晴岑洪
罗燕珍 周达 陈思静 廖成成 王明月 谭晓虹 柯晴 岑洪
弥漫大B细胞淋巴瘤(diffuselarge B-cell lymphoma,DLBCL)是临床上最常见的非霍奇金淋巴瘤病理亚型,目前临床上广泛使用国际预后指数(international prognostic index,IPI)判断DLBCL患者预后,但DLBCL是一组异质性很大的疾病实体,IPI已不能满足临床需求[1]。因此,亟需开发新的预后指标以指导临床诊疗。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)是肿瘤相关微环境的主要成分,在癌症的起源以及发生和进展中起重要作用。TAMs可通过产生大量的细胞因子和生长因子诱导血管生成,抑制抗肿瘤免疫激活,增强肿瘤细胞生长、侵袭能力,以及介导肿瘤产生耐药性和免疫逃逸[2]。目前常用的TAMs检测方法,一是通过免疫组化法检测肿瘤组织中CD68和CD163的表达,以评估肿瘤微环境中的TAMs水平[3];二是通过基因表达谱分析来明确淋巴瘤组织中TAMs的浸润水平。大量研究表明,高TAMs浸润水平与肿瘤不良预后相关,但在DLBCL中,TAMs与患者预后的关系尚存在争议[4-6]。随着基因表达谱芯片广泛用于临床肿瘤研究,以及生物信息学分析技术的进步,可通过现有的数据分析肿瘤组织中免疫细胞成分的浸润水平,探讨其对肿瘤患者预后的影响及两者内在的生物学联系[7]。本研究拟通过传统免疫组化法检测TAMs标志物CD68、CD163的表达水平量化TAMs的浸润水平,再利用生物信息学分析技术分析公共数据库DLBCL相关基因表达数据集中的M2型TAMs的含量,旨在探讨DLBCL组织中TAMs浸润水平与患者临床特征及预后的关系。此外,利用ssGSEA分析TAMs中M2型浸润水平与免疫相关信号通路的关系,进一步探索其在DLBCL中的生物学作用。
1 材料与方法
1.1 样本来源
收集2015年7月至2018年5月于广西医科大学附属肿瘤医院诊治的95例DLBCL患者的临床资料和组织石蜡标本。纳入标准:⑴所有患者病理诊断至少由2位病理专家行组织学及免疫组化确诊;诊断标准参照WHO(2016年)对DLBCL亚型的诊断标准;⑵临床资料完整,包括年龄、性别、有无B症状、血清乳酸脱氢酶(lactate dehydrogenase,LDH)和β2-微球蛋白(β2-microglobulin,β2-MG)水平、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、结外累及情况、AnnArbor分期、有无大肿块、有无骨髓受侵等;⑶均接受利妥昔单抗治疗。排除合并其他肿瘤患者。本研究通过本院伦理委员会批准,所有患者均签署知情同意书。
1.2 免疫组化法检测CD68、CD163的表达水平
所有组织标本用多聚甲醛溶液固定,常规石蜡包埋,4 μm连续切片,采用免疫组化链霉素抗生物素蛋白-过氧化物酶连接法(SP)染色,严格按照说明书操作步骤检测病理切片CD68、CD163的表达。兔抗CD163、CD68单克隆抗体购自Bioss公司。结果判读:CD68、CD163主要表达于巨噬细胞胞浆内,染色阳性细胞内出现棕黄色或棕褐色颗粒,且明显高于背景。参照CENCINI等[8]评分及分组标准,首先在低倍镜(×100)视野选取明显着色区域,然后使用高倍镜视野(×400)选取5个视野,连续计数CD163、CD68阳性表达细胞数,根据阳性染色细胞数占总细胞数比例的平均值分为两组:低浸润组(<25%),高浸润组(≥25%)。所有病例均由2名病理科医师进行双盲评估。
1.3 基因表达数据采集及分析
在GEO公共数据库(https://www.ncbi.nlm.nih.gov/gds)搜索公开发表的DLBCL基因表达数据集,筛选包含样本量较大、临床信息完整的GSE10846和GSE31312数据集,分别纳入414例、469例样本进行分析。基于M2型TAMs对应的基因表达特征,通过xCell算法(https://xcell.ucsf.edu/)得出GSE10846和GSE31312数据集中每个癌症样本中M2型TAMs的相对浸润水平,使用“survminer”R包surv_cutpoint函数获取M2型TAMs浸润水平对预后的最佳节点,并分为高浸润组和低浸润组,同时使用Kaplan-Meier法进行生存分析。采用GSVA(gene set variation analysis)R包进行ssGSEA(single sample gene set enrichment analysis)分析,探索 M2型TAMs高浸润及低浸润水平在16条肿瘤相关免疫信号通路的富集情况,其中以P<0.05和FDR<0.25判定为差异有统计学意义的通路[9]。
1.4 随访
采用电话、门诊或住院复查等方式随访。以患者确诊日为随访起点,随访截至2019年9月,随访时间为4~50个月,中位随访时间为25个月。随访期间出现结局事件34例(35.7%),无失访病例。无进展生存期(progression-free survival,PFS)定义为确诊至末次随访、疾病发生进展或者死亡的时间。
1.5 统计学方法
采用SPSS22.0软件、R 3.6.1软件进行数据分析。分类资料组间比较采用χ2检验;采用Kaplan-Meier进行生存分析,并进行Log-rank检验;采用Cox比例风险回归模型进行多因素分析,以CD68+TAMs和CD163+TAMs高、低浸润水平以及可能影响患者PFS的因素,如年龄、AnnArbor分期、有无B症状、LDH、ECOG评分、结外累及情况、有无骨髓受侵等作为协变量,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 CD68+TAMs、CD163+TAMs在DLBCL中的表达
免疫组化法检测结果显示,CD68、CD163主要表达在巨噬细胞的胞浆内,呈棕黄色或者棕褐色。纳入研究的95例患者中,CD68低表达50例(52.6%),高表达45例(47.4%),见图1;CD163低表达34例(35.8%),CD163高表达61例(64.2%),见图2。
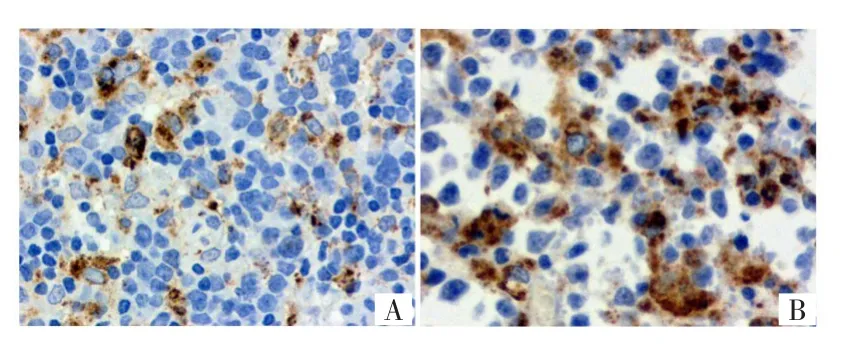
图1 DLBCL组织中CD68的表达(SP×400)Fig.1 Expression of CD68 in DLBCL tissues(SP×400)

图2 DLBCL组织中CD163的表达(SP×400)Fig.2 Expression of CD163 in DLBCL tissues(SP×400)
2.2 CD68+TAMs、CD163+TAMs浸润水平与DLBCL患者临床病理参数的关系
CD68+TAMs浸润水平与LDH水平、AnnArbor分期、骨髓受侵相关(均P<0.05);而与性别、年龄、B症状、β2-微球蛋白、ECOG评分、结外病变数量、有无大肿块均无关(均P>0.05)。CD163+TAMs浸润水平与性别、年龄、B症状、LDH水平、β2-微球蛋白、ECOG 评分、结外病变数量、AnnArbor分期、有无大肿块、骨髓有无受侵等均无关(均P>0.05)。见表1。

表1 DLBCL组织中CD68+TAMs、CD163+TAMs浸润水平与患者临床病理特征的关系[n(%)]Tab.1 Relationship between CD68+TAMs and CD163+TAMs infiltrating levels in DLBCL tissues and clinicopathological features of patients[n(%)]
2.3 CD68+TAMs、CD163+TAMs浸润水平与DLBCL患者PFS的关系
生存分析结果显示,95例DLBCL患者中,CD68+TAMs高浸润组患者1年、3年PFS率分别为79.2%、55.4%,CD68+TAMs低浸润组患者1年、3年PFS率分别为91.6%、74.6%,两组PFS曲线比较差异有统计学意义(Log-rank χ2=4.127,P=0.042),见图3A;CD163+TAMs高浸润组患者1年、3年PFS率分别为82.9%、37.4%,CD163+TAMs低浸润组患者1年、3年PFS率分别为90.9%、73.2%,两组PFS曲线比较差异有统计学意义(Log-rankχ2=5.976,P=0.015),见图3B。多因素Cox回归分析结果显示,CD163+TAMs高浸润是DLBCL患者预后的独立危险因素(HR=2.695,95%CI:1.126~6.455,P=0.026),见表2。

表2 影响DLBCL患者预后的Cox回归多因素分析Tab.2 Cox regression multivariable analysis of DLBCL patients

图3 CD68+TAMs、CD163+TAMs浸润水平与PFS的关系Fig.3 Relationship between CD68+TAMs and CD163+TAMs infiltrating levels and patients'PFS
2.4 GSE31312、GSE10846数据集中淋巴瘤组织M2型TAMs浸润水平与患者总生存期的关系
根据“survminer”R包surv_cutpoint函数分别计算GSE31312、GSE10846基因数据集M2型TAMs浸润水平,得出对预后的最佳节点,分别为0.1106、0.1336,据此将DLBCL患者分为高浸润组与低浸润组。GSE31312数据集中高浸润组115例,低浸润组354例;GSE10846数据集中高浸润组62例,低浸润组352例。2个数据集的生存分析显示,M2型TAMs高浸润与不良预后相关(P<0.05)。见图4。

图4 GSE31312、GSE10846数据集中M2型TAMs浸润水平与OS的关系Fig.4 Relationship between infiltration level of M2-type TAMs in GSE31312 and GSE10846 data sets and patients'OS
2.5 免疫相关信号通路在M2型TAMs高浸润和低浸润组的ssGSEA分析
分别对GSE31312和GSE10846数据集基因表达数据进行ssGSEA免疫相关通路富集分析,观察淋巴瘤组织中M2型TAMs高浸润组与低浸润组富集情况。结果显示,GSE31312富集到6条通路有差异(均P<0.05,FDR<0.25),GSE10846富集到9条通路有差异(均P<0.05,FDR<0.25),其中2个数据集富集分析结果显示,趋化因子信号通路、TCR信号通路、Ⅰ型干扰素信号通路、Treg分化信号通路、MHCⅠ类抗原呈递信号通路、适应性免疫系统通路均在低浸润组中显著富集。见图5。

图5 免疫相关信号通路在M2型TAMs低浸润组的ssGSEA分析Fig.5 ssGSEA analysis of immune-related signaling pathways in the M2-type TAMs low infiltration group
3 讨论
肿瘤微环境在肿瘤的发生和进展中起重要作用,而DLBCL是一种异质性和侵袭性极高的恶性肿瘤,其微环境更复杂。巨噬细胞在不同的细胞因子刺激下,主要极化为M1和M2两种表型。M1型巨噬细胞通过分泌促炎因子如白介素1(interleukin-1,IL-1)、IL-12、IL-23、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和各种趋化因子配体参与抗肿瘤炎症免疫反应,而M2型巨噬细胞通过释放高水平的IL-10、低水平IL-2,以及释放血管生成因子、前列腺素E2和基质金属蛋白酶(matrix metalloproteinase-9,MMP-9)而参与免疫抑制,增强肿瘤细胞增殖、侵袭能力等。一般狭义的TAMs即指发挥免疫抑制及促瘤作用的M2型TAMs[2]。本研究通过免疫组化法检测由 CD68、CD163标记的TAMs在DLBCL组织中的浸润情况,结果发现,CD68+TAMs浸润水平与LDH水平、AnnArbor分期、骨髓受侵相关,生存分析显示,CD68+TAMs、CD163+TAMs高浸润组患者的PFS率明显低于低浸润组,提示CD68+TAMs、CD163+TAMs与DLBCL预后有关。进一步进行多因素分析发现CD163+TAMs高浸润水平是DLBCL预后的独立危险因素,而CD68+TAMs浸润水平不是其独立预后危险因素。以往研究关于CD68+TAMs在DLBCL中的作用尚存在争议,如 HASSELBLOM等[10]发现CD68+TAMs浸润水平与DLBCL预后不相关。而CAI等[11]发现CD68+TAMs高浸润提示DLBCL患者不良预后;NAM等[12]在109例接受R-CHOP治疗的DLBCL患者研究中发现CD68+TAMs高浸润与较长的生存时间相关,而在56例仅接受CHOP治疗的患者中表现为相反结果。分析造成各研究结果不一的可能原因是目前的研究样本量有限。另外,CD68能标记部分具有抗肿瘤作用的M1型巨噬细胞,其与表达CD68蛋白的M2型巨噬细胞功能相反,这也可能限制CD68+TAMs在预测DLBCL患者预后中的作用。而CD163主要在M2型巨噬细胞表达,M1型巨噬细胞则不表达[13]。此外,本研究发现CD163+TAMs浸润水平与DLBCL患者临床病理特征均不相关,CENCINI等[8]研究也得出相似结果。同时,多数研究也认为评估肿瘤组织CD163+TAMs的浸润水平能更好地识别预后不良人群[14-15],这也与本研究结果一致。随着基因表达谱芯片广泛用于临床肿瘤研究,以及生物信息学分析技术的进步,目前使用基于一组免疫特异性标记基因或表达特征的计算方法可以从大量肿瘤基因表达数据中表征各种免疫细胞的浸润水平,迄今为止,已有大量研究使用生物信息技术免疫浸润分析方法探讨肿瘤免疫细胞之间的关系及其对肿瘤患者预后的影响[16-17]。xCell是一种基于ssGSEA方法评估免疫细胞类型的丰度评分,其显示出与真实细胞比例的高度相关性[18]。本研究为了进一步验证CD163+TAMs与DLBCL患者预后的关系,同时利用公共数据库的2个DLBCL基因表达数据集(GSE10846、GSE31312)进行分析,并基于M2型TAMs对应的基因表达特征,利用xCell算法评估M2型TAMs的浸润水平,也发现DLBCL组织中M2型TAMs高浸润提示DLBCL患者预后不良。
在DLBCL微环境中,免疫效应细胞、免疫抑制细胞与间质细胞微环境之间是相互联系、相互调节的整体,共同决定肿瘤的发展和转归。NAM等[12]研究发现M2型TAMs与DLBCL预后和免疫调节T细胞浸润水平有关。本研究基于xCell算法评估DLBCL组织中M2型TAMs浸润比例,GSEA分析发现DLBCL组织中M2型TAMs浸润水平与6条免疫信号通路相关,包括MHCⅠ类抗原呈递信号通路、TCR信号通路、趋化因子信号通路、Treg分化信号通路、Ⅰ型干扰素信号通路、适应性免疫系统通路。据研究报道,在肿瘤微环境中,M2型TAMs通过表达非经典MHC-I分子、细胞毒性T淋巴细胞抗原4等分泌一系列细胞因子、趋化因子和酶,从而影响这些信号通路的激活,然后直接或间接抑制CD4+T和CD8+T细胞的效应功能细胞活化[19]。KUSANO等[20]发现,DLBCL组织中CD4+T细胞浸润低与患者不良预后相关。因此推测,在DLBCL中,M2型TAMs可能通过下调抗肿瘤炎症反应激活通路塑造利于肿瘤细胞生长与侵袭的免疫微环境。这一结果为DLBCL靶向TAMs的治疗提供重要信息。但是,本研究仅在理论层面进行分析,未来还需开展大量的基础实验进一步研究。
综上所述,本研究表明CD163+TAMs高浸润是DLBCL患者预后的独立危险因素,为其诊断、治疗和构建更好的预后评估系统提供新的思路。而CD68+TAMs与DLBCL的预后关系仍需进一步研究。此外,还发现TAMs可能通过下调抗肿瘤炎症反应激活通路塑造利于肿瘤细胞生长与侵袭的免疫微环境,这为研究免疫微环境在DLBCL中的作用机制提供重要的理论依据。
