MLH1表达对胃癌患者预后及术前新辅助化疗反应的预测价值
2022-03-18周高云林龙林进维苏德文
周高云 林龙 林进维 苏德文
胃癌是全世界癌症相关死亡的主要原因之一[1]。根治性手术切除是胃癌重要的治疗方法,但术后复发率较高[2];对于可手术的晚期患者,术前和/或术后辅助化疗是常规的辅助治疗方案[3]。准确评估患者的化疗反应对制定后续治疗方案尤为重要,但是目前仍缺少理想的预测生物标志物。癌症基因组图谱研究网络曾对胃癌进行了全面的分子表征,并提出微卫星不稳定性(microsatellite instability,MSI)可作为基因组亚型的依据[4]。在结直肠癌中,高MSI或MSI-H是遗传性非息肉性结直肠癌的特异性特征[5]。高MSI或MSI-H主要是由错配修复(mismatch repair,MMR)基因之一的种系突变导致的错配修复缺陷(mismatch repair deficiency,MMRd)引起,而mutL同源物1(mutL homologous gene 1,MLH1)是主要的修复基因。此外,有研究报道,由幽门螺杆菌感染引起的MLH1基因启动子区域的高甲基化与胃癌中的MMRd密切相关,且导致MSI-H状态[6]。在结直肠癌中,也有研究报道MSI-H状态与良好预后和基于氟尿嘧啶辅助化疗的不良反应有关[7-8]。关于可切除胃癌进行辅助化疗的随机对照试验也显示,MSI-H状态可能是辅助化疗预后获益的危险因素[9-10]。然而,MSI-H与胃癌患者化疗敏感性的相关性尚未清楚。本研究旨在检测MLH1在胃癌中的表达及其与MSI状态的关系,并探讨其作为预测预后标志物的价值。
1 资料与方法
1.1 研究对象
收集2010年1月至2016年12月于海南省中医院行胃癌根治术的323例患者为研究对象,男性221例;平均年龄(62.8±11.8)岁。其中行术前化疗125例,采用S-1+顺铂+多西他赛方案42例,S-1+奥沙利铂+多西他赛方案33例,S-1+顺铂方案26例,其余方案24例。所有患者均经病理组织学诊断为胃腺癌。排除接受非治愈性切除(R2)患者。本研究经本院伦理委员会批准(审批号:2010011539),样本和数据的使用均经患者书面知情同意。
1.2 组织学反应评估
术前化疗的组织学反应根据存活癌细胞的比例进行评估,分为5个等级:3级,无存活肿瘤细胞;2级,存活的肿瘤细胞在肿瘤范围内小于1/3;1b级,存活的肿瘤细胞在肿瘤范围内超过1/3但小于2/3;1a级,存活的肿瘤细胞在肿瘤范围内大于2/3以上;0级,没有治疗效果[11]。本研究中3级组织学反应的患者因为无法评估切除标本中的MLH1表达被排除,其中将组织学分级2级或1b级的患者定义为反应者,1a级或0级患者定义为无反应者[12]。
1.3 免疫组化法检测MLH1和PD-L1的表达水平
标本均经10%中性福尔马林固定、脱水、透明、浸蜡、包埋,4 μm厚连续切片。操作过程由同一病理科人员严格依据北京中杉金桥生物公司免疫组织化学SP法试剂盒说明书步骤进行。MLH1单克隆抗体、PD-L1单克隆抗体浓度均为1∶100,以已知抗体阳性标本作为阳性对照,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。MLH1正常表达定义为存在肿瘤细胞核染色,与正常上皮细胞和阳性对照的核染色进行比较评估每个癌细胞的核染色。当任何肿瘤细胞中不存在核染色时,MLH1表达为阴性。
每张切片选取连续5个高倍视野,每个视野计数200个细胞,对其中所有阳性染色细胞分别计数,计算阳性细胞率。⑴按照阳性细胞率进行评分,0%~5%计0分,6%~25%计1分,26%~50%计2分,>50%计3分;⑵按照细胞染色强度进行评分,细胞未着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。将上述2种评分相乘,对于MLH1,0~1分定义阴性表达,其余定义为阳性表达;对于PD-L1,0~1分定义低表达,其余定义为高表达。
1.4 MSI状态评估
为了仅在免疫组化结果MLH1阴性表达的肿瘤中评估MSI状态,使用QIAampDNAFFPE组织试剂盒(Qiagen)从MLH1阴性表达的组织中提取DNA。MSI状态使用5种单态单核苷酸标记判定:BAT-25、BAT-26、NR-21、NR24和 MONO-27(PromegaMSI分析系统,Promega公司),其中5个标记中有2个及以上不稳定的肿瘤被归类为MSI-H,仅1个的归类为低微卫星不稳定性(MSI-L),没有的归类为微卫星稳定(MSS)。
1.5 随访
所有患者术后以电话或门诊方式进行随访,随访时间自确诊之日起,截至2021年2月。前3年每1~3个月随访1次,第4~5年每6个月随访1次,之后每年随访1次。无复发生存期(recurrence-free survival,RFS)定义为从手术日到复发或因任何原因死亡的时间间隔。以患者复发或死亡为终点事件,观察胃癌患者在随访结束时的生存状况。
1.6 统计学方法
采用SPSS 20.0软件进行数据分析。计量资料采用均数±标准差描述,组间比较采用独立样本t检验;分类资料采用n(%)描述,组间比较采用卡方检验或Fisher精确概率法。采用Kaplan-Meier法估计累积生存率,组间比较采用Log-rank检验。采用Cox回归分析影响RFS的独立因素,计算风险比(HR)及95%可信区间(CI)。本研究所有假设检验均为双侧,以P<0.05为差异有统计学意义。
2 结果
2.1 MLH1在胃癌组织中的表达
免疫组化法检测结果显示,胃癌组织中MLH1的表达主要位于细胞质,部分位于细胞核(图1)。在323例患者中,MLH1阴性表达32例(9.9%),MLH1阳性表达291例(90.1%)。
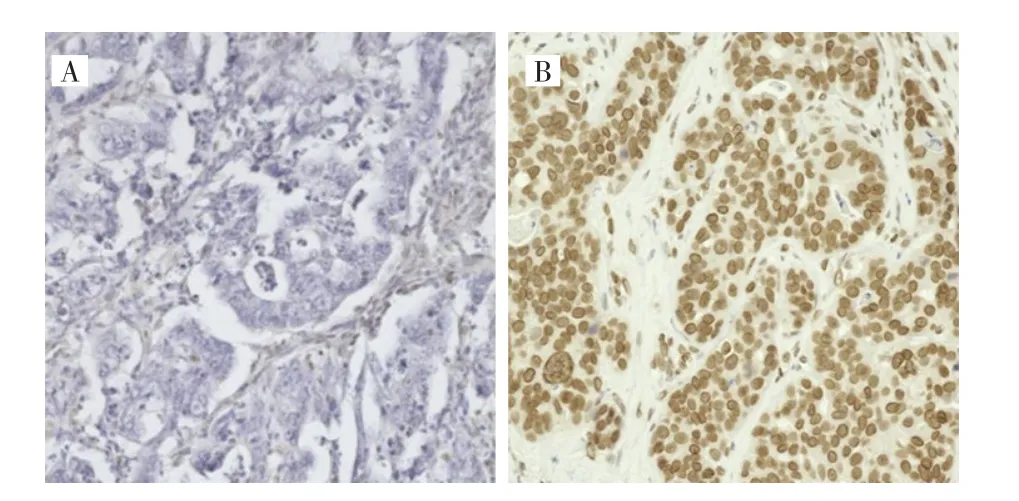
图1 MLH1在胃癌中疫组化染色代表图(200×)Fig.1 Representative immunohistochemical staining of MLH1 in gastric cancer(200×)
2.2 MLH1表达与胃癌患者临床病理特征的关系
MLH1表达与肿瘤发病部位、病理N分期、PD-L1表达有关,其中与MLH1阳性组相比,MLH1阴性组中肿瘤位于胃体下部的患者比例更多(P=0.024),病理N分期中pN3期的患者比例也更多(P=0.024)。在MLH1与PD-L1表达的相关性方面,MLH1阴性组PDL1高表达患者比例明显高于MLH1阳性组(56.2%vs21.0%,P<0.001)。见表1。
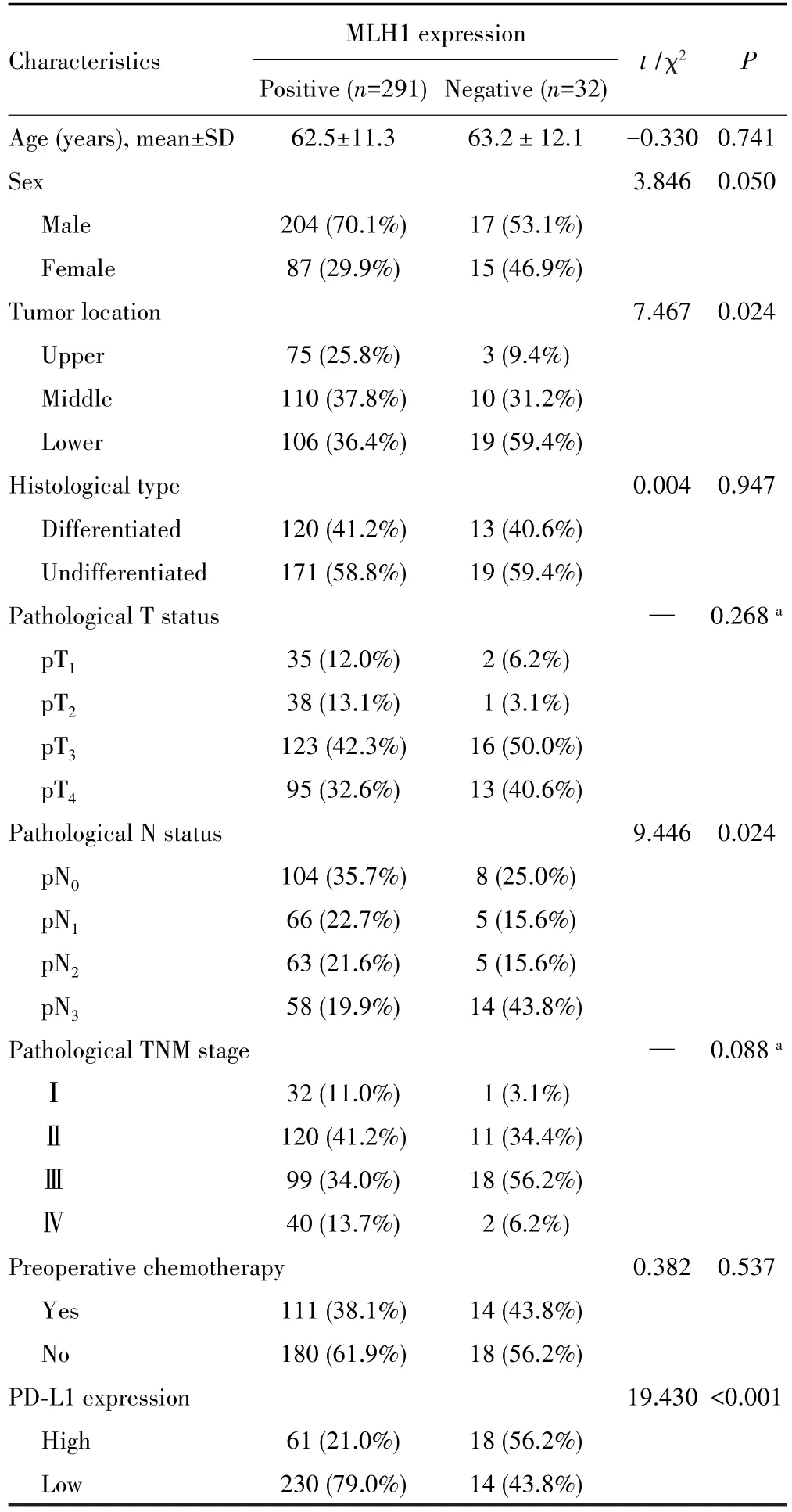
表1 MLH1表达的与临床病理特征的关系*Tab.1 Relationship between MLHL expression and clinicopathological characteristics*
2.3 MSI状态与术前化疗的组织学反应
在32例免疫组化结果为MLH1阴性表达的患者中,27例(84.3%)为MSI-H,5例(15.7%)为MSS/MSI-L。323例患者中,125例(43.8%)接受术前化疗,其中反应者70例(56.0%),无反应者55例(44.0%)。MLH1阴性组的反应者比例低于MLH1阳性组(21.4%vs60.4%,P<0.001)。
2.4 无复发生存情况
中位随访59.5个月(范围:2~75个月)。在未进行术前新辅助化疗的患者(n=198)中,MLH1阴性组(n=18)的RFS较MLH1阳性组(n=180)长,差异有统计学意义(P<0.001),见图2A。在术前新辅助化疗的患者(n=125)中,MLH1阴性组(n=14)的RFS与MLH1阳性组(n=111)比较,差异无统计学意义(P=0.352),见图2B。
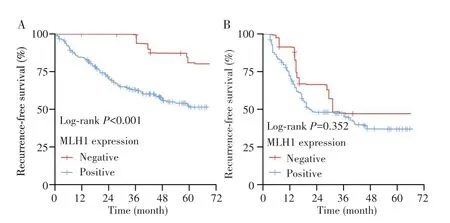
图2 根据MLH1表达的Kaplan-Meier无复发生存曲线Fig.2 Kaplan-Meier recurrence-free survival according to MLH1 expression
多因素Cox回归分析显示,病理T分期、病理N分期、术前新辅助化疗以及MLH1阳性表达是影响RFS的独立危险因素(均P<0.05),其中MLH1阳性表达患者的复发风险较MLH1阴性表达患者高(HR=2.45,95%CI:1.06~5.67,P=0.037),见表2。
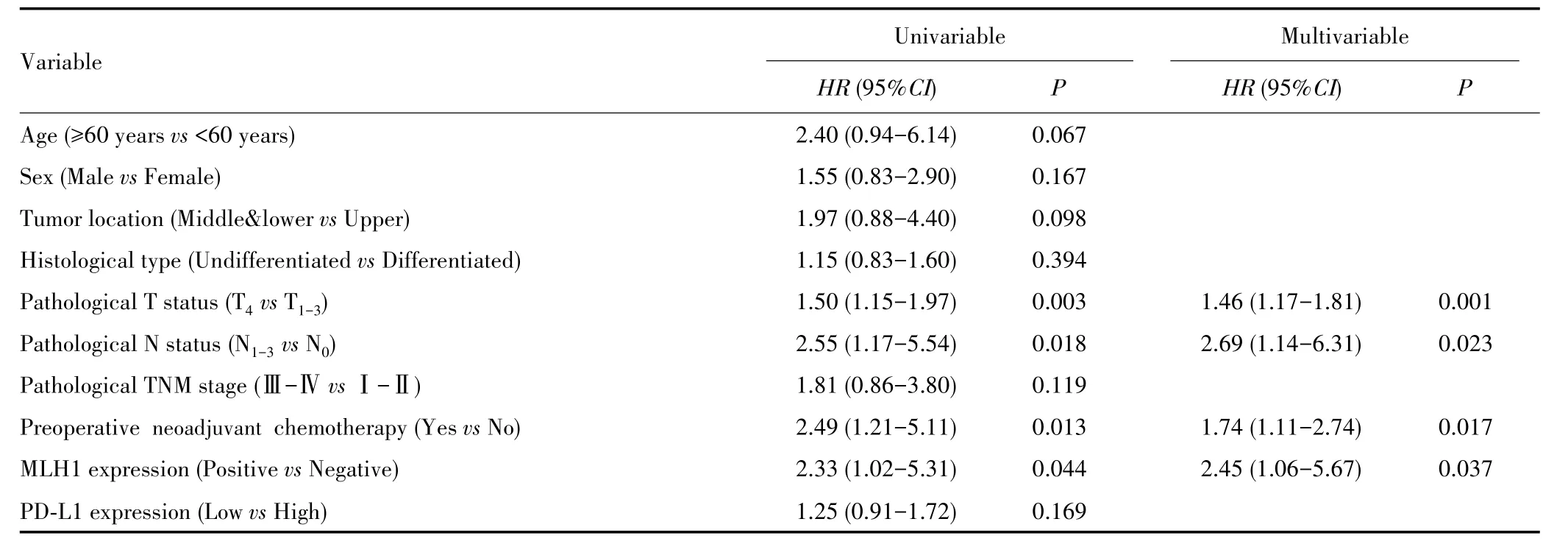
表2 无复发生存期的Cox回归分析Tab.2 Cox regression analysis of recurrence-free survival
3 讨论
本研究表明,MLH1表达的缺失可能预测可切除胃癌患者预后良好和术前新辅助化疗阴性反应。在未行术前新辅助化疗的患者中,MLH1阴性组和MLH1阳性组的无复发生存率差异较大,但在行术前新辅助化疗的患者中,两组则没有差异,这一结论可解释为术前新辅助化疗改善了MLH1阳性患者的预后。
免疫组化被认为是检测MMRD和MSI-H的可靠方法[13]。因此,本研究进一步通过免疫组化评估MLH1状态能否作为MSI状态的替代生物标志物,结果发现在32例MLH1阴性表达的患者中84.3%为MSI-H。既往研究也报道大约85%的MLH1阴性胃癌是 MSI-H[9,12],与本研究结果一致,说明MLH1表达状况与MSI状态高度一致性。目前已有多项研究显示仅接受手术治疗的MSI-H胃癌患者预后优于MSI-L/MSS患者[14-15]。考虑原因可能是肿瘤细胞周围淋巴细胞浸润增加进而促使MSI-H肿瘤患者的预后更好[16-17]。
既往在结直肠癌和胃癌研究中发现MSI-H是基于氟尿嘧啶化疗负反应的预测因子,因此MSI-L/MSS的患者能从基于氟尿嘧啶的辅助化疗中获益,但MSI-H肿瘤患者未能获益[5,7-9]。这可能与MSI-H通过减弱细胞检测DNA损伤和激活细胞凋亡的能力而导致对氟尿嘧啶的抗性有关[7]。此外,还有研究发现MLH1表达缺失的胃癌细胞系对顺铂相对耐药,且MSI-H与铂类药物耐药有关[18]。本研究中所有患者术前均接受了以氟尿嘧啶为基础的化疗(主要包括顺铂或奥沙利铂),这也可能是较少的MLH1阴性表达患者对术前化疗产生反应的原因。
本研究也存在一定局限:⑴本研究为单中心回顾性研究,可能存在回顾性偏倚和选择偏倚。⑵本研究没有在术前及化疗前使用活检样本评估MLH1表达预测化疗反应,可能对结果有一定影响,后续需要进一步评估活检样本的预测价值。
综上所述,MLH1缺失与胃癌患者化疗耐药相关,且不会延长新辅助化疗后的RFS。MLH1与MSI状态高度相关,提示对于MLH1阴性胃癌,免疫检查点抑制剂可能优于常规化疗。根据这些结果建议MLH1阴性胃癌患者单独接受手术治疗,其他患者采取手术治疗联合术前或术后化疗可能获得更好预后。
