5-脂加氧酶在胃癌中的表达与环氧化酶-2和甲酰肽受体2的关系及其临床意义
2022-03-17李里香
李 庆,徐 芬,雷 浪,李里香,郝 华,3
1.南昌大学第二附属医院病理科,江西 南昌 330006;
2.南昌大学第二附属医院全科医学科,江西 南昌 330006;
3.同济大学附属杨浦医院病理科,上海 200090
胃癌是我国最常见的消化道肿瘤之一,其发病率在男性居第2位,女性居第3位[1],晚期胃癌患者5年生存率低,预后差[2],手术是其治疗的主要手段[3]。而其发病机制未完全阐明,研究胃癌侵袭、转移过程中的关键分子对胃癌的防治具有重要意义。众所周知,慢性炎症与肿瘤的关系密切,长期慢性炎症经久不愈、持续刺激可导致上皮细胞增殖过程中的恶性转化,如慢性结肠炎与结肠癌,慢性病毒性肝炎与肝癌。而且研究表明,幽门螺旋杆菌的感染参与了胃癌的发生过程。胃炎发展过程中伴有炎症因子的释放,炎症因子又可激活炎症细胞,导致活性氧类(ROS)生成增多,进而诱导上皮细胞增生。花生四烯酸(AA)代谢通路的激活参与了胃炎的发生发展过程。研究结果发现,AA 通过环氧合酶途径(COX)或脂氧合酶(LOX)两种途径代谢产生了较多的AA 类产物,而这些产物在肿瘤的发生发展中发挥着重要的作用[3]。本课题组既往的研究发现,脂氧素(lipoxin,LX),通过跨细胞途径,脂加氧酶催化生成,是体内最重要的抗炎、促消退物质具有抗肿瘤作用,而其受体为甲酰肽受体2(FPR2)。本研究采用免疫组化法检测胃癌组织中5-脂加氧酶(5-LOX)、环氧化酶-2(COX-2)与FPR2 的表达,探讨5-LOX 的表达与胃癌临床病理学特征及COX-2和FPR2 表达的关系,旨在为胃癌的防治提供实验依据。
1 材料与方法
1.1 材料
收集2015 年1 月—2016 年12 月南昌大学第二附属医院病理科存档的胃癌手术切除标本70例(均通过院伦理委员会审核)。所有患者临床及病理资料完整,术前均未行放化疗。研究对象中≤45 岁25例,>45 岁45 例,病理类型中,低分化管状腺癌15例,中-高分化管状腺癌45 例,黏液腺癌10 例。根据第八版AJCC 胃癌病理分期标准对病例进行分期,其中Ⅰ-Ⅱ期患者48 例,Ⅲ-Ⅳ期患者22 例;其中有淋巴结转移者31例,无淋巴结转移者39例。
1.2 试剂与方法
所有标本经固定、脱水,包埋处理,4 μm 厚连续切片,进行苏木精-伊红(HE)及免疫组化染色。免疫组化染色采用En Vision 两步法,采用高温高压法修复抗原,DAB 显色。5-LOX 为兔抗单克隆抗体,甲酰肽受体2(FPR2)为鼠抗单克隆抗体,均购自美国Abcam 公司,稀释浓度均为1∶100;COX-2兔抗单克隆抗体(为即用型)购于北京中杉公司。人胃癌细胞株SGC-790l 购自中科院上海细胞生物学研究所,5-LOX 沉默质粒由南通麦杰生物科技有限公司设计并合成,sh5-LOX 沉默靶点序列为5’-CGGGAGATGAGAACCCTATTT-3’, shRNANC 序列为5’-TTCTCCGAACGTGTCACGT-3’,RNA 提取试剂盒、反转录试剂盒、Taq 酶购自日本TaKaRa 公司,Lipofectamine2000购自Invitrogen公司。
1.3 结果判断
胃癌的诊断由两位高年资病理医生双盲阅片。各指标的阳性表达以胞膜或胞质内出现浅黄色或棕黄色颗粒为阳性,结果判断采用二级计分法。阳性细胞数计分标准:<5%为0 分、5%~25%为1 分、26%~50%为2分、51%~75%为3分、>75%为4分;染色强度计分标准:0为阴性、浅黄色为1分、黄色或深黄色为2 分,褐色或深褐色为3 分。最终评分将阳性细胞数计分和染色强度计分两者相乘,结果判断标准为:0~3分为阴性,>3分为阳性。
1.4 细胞实验
SGC-7901 细胞用含10%小牛血清的RPMI 1640 培养液在37℃、5%CO2环境下培养,24 h 后更换培养液,培养、传代。选择第3代对数生长期细胞接种于六孔板,采用Lipofectamine2000进行转染,具体操作按说明书进行。将细胞分为空白对照组、空质粒组(shNC)、转染组(sh5-LOX)。
1.5 RT-PCR检测细胞mRNA表达
采用Trizol 试剂提取细胞总RNA,具体操作按说明书进行。紫外分光光度计测定RNA 含量及纯度,先将RNA 逆转录为cDNA,再进行PCR 扩增。PCR 扩增体系总体积为25 μL,具体反应条件见表1。
1.6 统计学分析
免疫组化结果采用SPSS 13.0 软件进行统计学分析。5-LOX 表达与患者临床病理特征的关系采用χ2检验,以P<0.05 为差异具有统计学意义。5-LOX 表达与COX-2、FPR2 表达的相关性采用χ2检验,以P<0.05 为差异具有统计学意义。所有检验P值均为双侧。
2 结果
2.1 5-LOX 表达与患者年龄、胃癌肿块大小及病理类型的关系
5-LOX 在≤45 岁组与>45 岁组中的阳性表达率分别为76.0%和84.4%;在肿块直径<3 cm 组与肿块直径>3 cm 组中的阳性表达率分别为82.1%和81.0%;在低分化管状腺癌、中-高分化管状腺癌及粘液腺癌中的阳性表达率分别为80.0%、80.0%和90.0%(图1,表2),不同组别间差异经统计学分析均无统计学意义(P>0.05)。
2.2 5-LOX表达与淋巴结转移及TNM分期的关系
5-LOX 在无、有淋巴结转移组阳性率分别为71.8%和93.5%(图1,表2);在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期胃癌组织中5-LOX 的阳性表达率分别为75.0%和95.5%(图1,表1),差异经统计学分析提示均有统计学意义(P<0.05)。
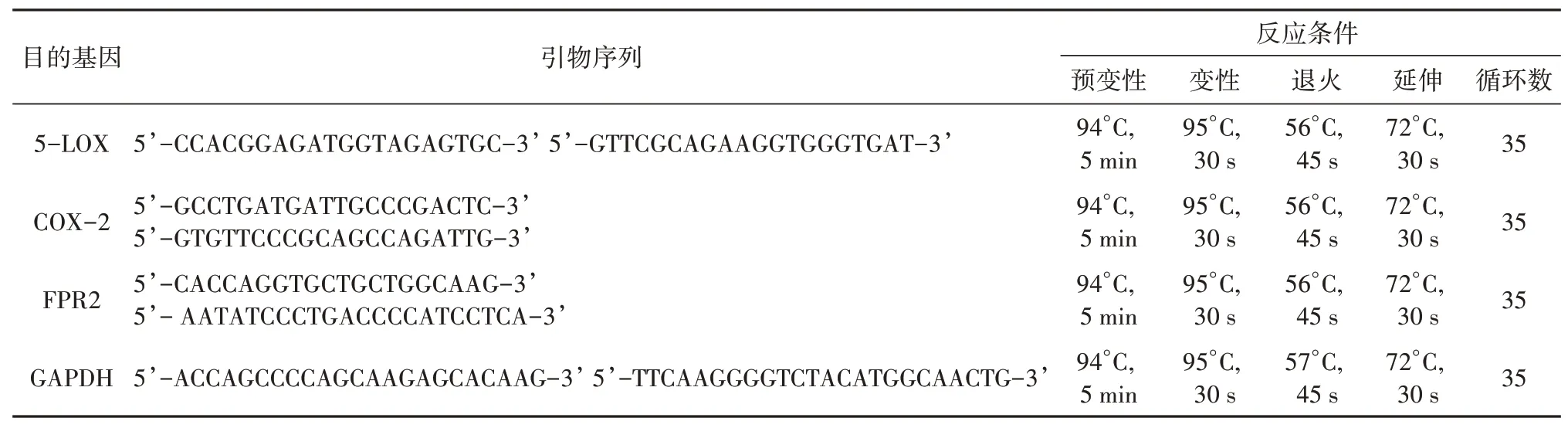
表1 引物序列及反应条件Tab.1 PCR primer sequences and reaction conditions
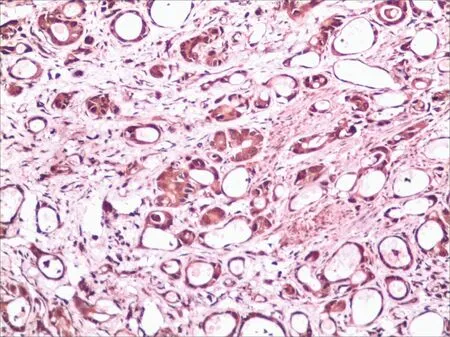
图1 5-LOX在腺癌中的表达Fig.1 The expression of 5-LOX in adenocarcinoma
2.3 5-LOX表达与COX-2、FPR2表达的相关性
5-LOX 在COX-2 阳性和阴性病例中阳性率分别为81.6%和81.0%(图1、2,表2);5-LOX 在FPR2阳性和阴性病例中阳性率分别为78.1%和84.2%(图1、3,表2),差异经统计学分析提示均无统计学意义(P>0.05)。
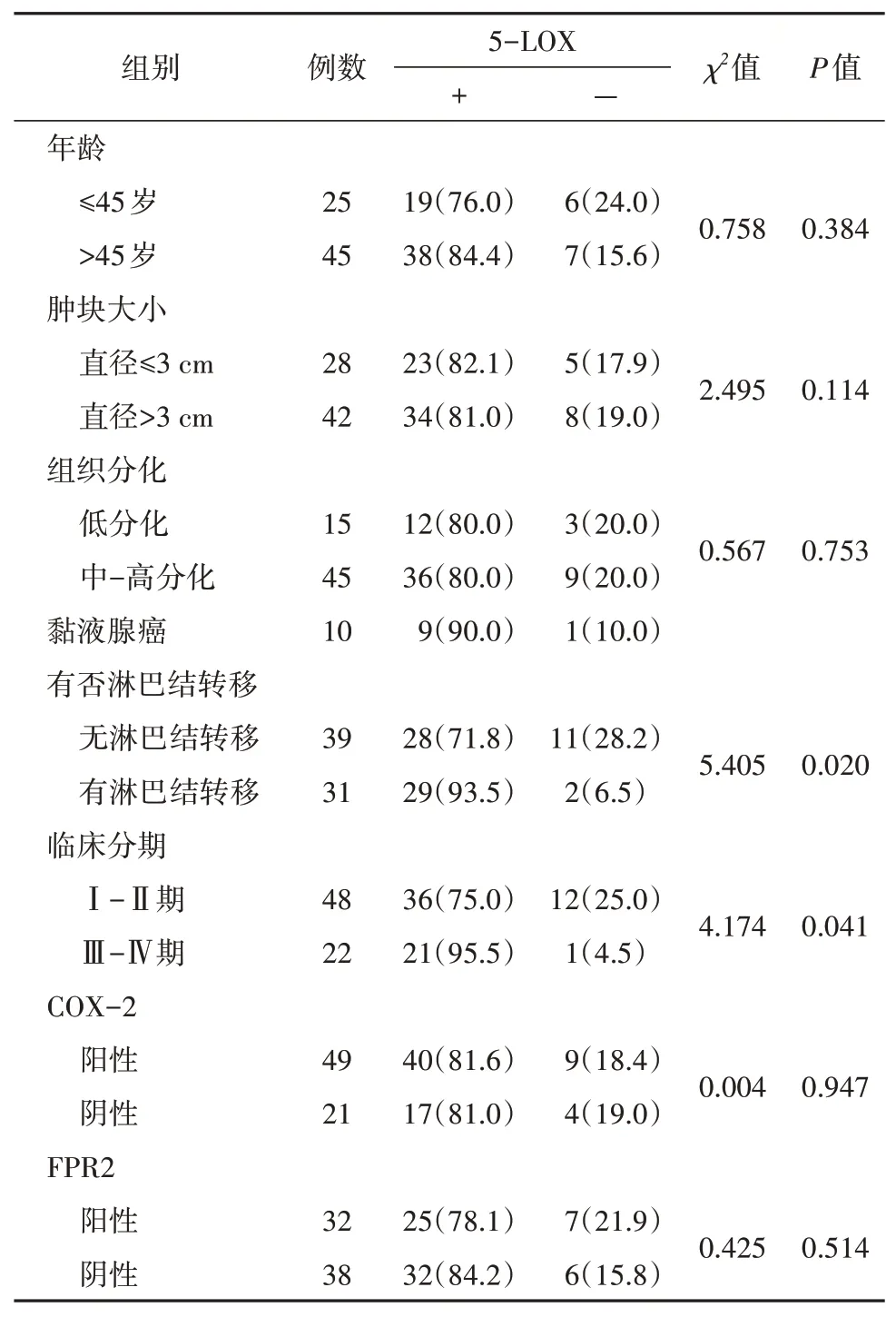
表2 5-LOX 表达与临床病理特征、COX-2 及FPR2 表达的关系 [n (%)]Tab. 2 The relationships of 5-LOX expression with clinicopathological features, COX-2, and FPR2 expressions [n (%)]
2.4 沉默5-LOX 基因表达后对COX-2 及FPR2 mRNA表达的影响
沉默5-LOX 基因后,5-LOX mRNA 几乎不表达,但 对COX-2 及FPR2 mRNA 表 达 没 有 影 响,COX-2 及FPR2 mRNA 在SGC-790l 细 胞 中依 旧 高表达(图4)。这说明,5-LOX 与COX-2 及FPR2 不存在相互作用,与临床标本检测结果一致。
3 讨论
流行病学研究发现,长期服用非甾体类抗炎药(NSAIDs)可明显降低实体瘤的发生率。NSAIDs 具有明显的抗炎作用,需要通过作用于AA 的代谢途径而发挥其功能。AA 是属于二十碳不饱和脂肪酸,为细胞膜磷脂的组成部分。当致炎因子和抗原刺激机体时,可引起细胞膜代谢紊乱,直接导致了膜磷脂酶A2(PLA2)被激活,细胞膜中的磷脂被水解进而生成游离的AA。AA接着被少许摄取再一次成为酯化的AA,大部分则通过代谢酶转化为其他产物。AA 的代谢有3 条途径:(1)通过脂氧合酶途径(LOXs)生成白三稀(LTs)、氢二十碳四稀酸(HETEs)和脂氧素,最重要的酶是5-LOX;(2)通过环氧合酶途径(COXs)生成各种前列腺素(PGs),最重要的酶是COX-2;(3)合成环氧化二十碳四稀酸(EETs)(细胞色素P450途径)。AA代谢所产生的产物统称为类花生酸,这些产物与肿瘤的生长及侵袭密切相关[4]。
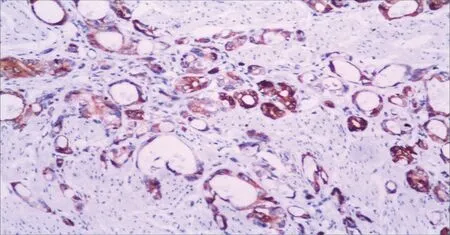
图2 COX-2在腺癌中的表达Fig.2 The expression of COX-2 in adenocarcinoma
LOXs可催化花生四烯酸和亚油酸的氧化,氧化的脂质可以通过细胞表面受体或生成的脂质介质激活细胞信号通路而引起生物学效应(促肿瘤或抑肿瘤)。根据LOXs 对底物作用位置的不同,分为5-LOX,8-LOX,12-LOX 及15-LOX 四个亚型,其中5-LOX是LOXs中的重要一员。人5-LOX 基因位于10号染色体,包含外显子和内含子分别为14 个和13个。通过对5-LOX 启动子分析,5-LOX 启动子与一些看家基因的启动子序列相似,其核心启动子有一独特的富含GC 区,包含5 个spl 结合序列串。启动子区还包含转录因子NF-κB,AP-2和c-myb癌基因的共有序列。5-LOX 是AA 代谢的关键酶,催化AA生成5-羟基二十碳四烯酸(5-HETE),5-HETE进而转化为白三烯A4(LTA4),LTA4在LTA4水解酶的作用下转化为白三烯B4(LTB4)。研究[5]表明LOXs 与许多肿瘤有关,例如肺癌、前列腺癌、结肠癌、乳腺癌及胰腺癌,然而其导致肿瘤的机制研究的比较少。Hennig 等[6]研 究 表 明 在 胰 腺 癌 细 胞 株AsPC-1、PANC-1 及MiaPaCa2 中有5-LOX mRNA,然而正常胰管细胞株中则没有,通过进一步研究发现5-LOX及其下游代谢产物LTB4 在胰腺癌中的表达明显高于正常胰腺组织。Ding等[7]研究发现,5-HETE可以激活MEK/ERK 及PI3K/AKT 通路。雒钰杰等[8]研究发现,敲低花生四烯酸5 脂加氧酶(Alox5)基因促进K562/ADM 细 胞 凋 亡。徐 晓 萌 等[9]研 究 发 现,5-LOX/COX-2 双重抑制剂Darbufelon 对胃癌SGC-7901 裸鼠移植瘤的生长有明显的抑制作用,说明单一的5-LOX 通路和单一的COX-2 通路在促进肿瘤演进方面可能作用点并不一样,联合抑制两条通路可能作用更佳,这与研究结果相符。本实验结果显示,5-LOX 在胃癌组织中高表达,但在患者的不同年龄、性别、肿瘤大小及肿瘤病理类型组比较,差异无统计学意义,而其阳性率与患者临床分期、淋巴结转移密切相关,说明5-LOX 主要参与了胃癌的侵袭、转移过程。盛烨华[10]研究发现,5-LOX mRNA表达阳性率及相对表达量与胃癌的分化程度有关,而我们的研究发现,5-LOX 的表达与胃癌的分化程度并不相关,可能与检测方法不同有关(分别采用的RT-PCR法检测mRNA和免疫组化法检测蛋白)。
环氧化酶(cyclooxygenase,COX)是细胞内的重要酶类,是AA 代谢生成产物的限速酶。COX 主要有三种亚型:COX-1、COX-2及COX-3(COX-1的剪接体)。COX-1 及COX-3 在此不赘述。COX-2 属于诱导酶,即只在病理状态下产生,主要在炎症和肿瘤部位,在细胞因子及生长因子的诱导下表达[11],因此它对调控炎症及肿瘤微环境非常重要[12]。研究表明,COX-2 在包括结肠癌、胰腺癌在内的多种恶性肿瘤中均高表达[5]。临床研究方面,COX-2 抑制剂能预防治疗结肠肿瘤[13]。COX-2 在功能上具有环氧化和过氧化酶的作用。它能够引起多种前致癌物激活,通过癌基因的激活和抑癌基因的突变引起肿瘤发生。COX-2 的过表达进而引起PGE2 的生成增加,而PGE2 具有促进凋亡、抑制增殖并且促进血管形成的作用[14]。有研究表明,COX2 可以通过上调MMP-2 的表达促进肿瘤侵袭,提示MMP-2 可能是COX-2 的下游分子,参与胃癌的侵袭与转移。本实验结果显示,在胃癌组织及细胞中,COX-2 的表达与5-LOX 表达不相关,提示COX-2 和5-LOX可能为两条彼此独立的信号通路,但作用均是促进胃癌的发生发展。Liu 等[15]研究发现,毛柳甙通过重塑巨噬细胞内COX-2,5-LOX 和P450 介导的花生四烯酸代谢可以减轻痛风性关节炎的症状。
LX是体内AA经脂氧合酶代谢途径产生的内源性脂类物质,最常见的亚型是LXA4和LXB4,它们具有很强的抗炎和促进炎症消退的作用,促进炎症及时消退,而慢性炎症与很多肿瘤的发生密切相关。LX 主要是通过与FPR2 结合而发挥作用,FPR2 是G蛋白偶联受体超家族成员,具有7次跨膜结构,属于甲酰肽受体(FPR)的第二个成员,此外FPR2也可归于前列腺素类受体,属于化学引诱剂受体家族。LX与FPR2 结合后可以通过细胞外调节蛋白激酶(ERK)途径、p38 途径及Jun 氨基末端激酶(JNK)途径等发挥抗炎作用。赵志辉等[16]的研究表明FPR2在正常大肠组织、大肠腺瘤组织及大肠癌组织中表达逐渐降低,三组间比较差异有统计学意义。王教学等[17]研究发现在胃癌中的结果与肠癌并不相同,他们研究发现,FPR2是影响胃癌患者预后的独立因素,FPR2 阳性的患者的生存时间短于FPR2 阴性的患者,这说明,FPR2可能具有组织特异性,与胃癌的进展密切相关。而李远美等[18]则通过细胞实验和动物实验证实,FPR2促进胃癌细胞侵袭及转移。本实验研究结果表明,虽然FPR2 在胃癌中的表达率也较高,但与5-LOX 的表达表达并不相关,提示可能二者在胃癌的发生发展中涉及不同的信号通路。
为了验证临床标本的结果,在细胞实验中,采用沉默5-LOX 基因的方法,观察对COX-2 及FPR2 mRNA 表达是否有作用。结果显示COX-2 及FPR2 mRNA 表达并无变化,与临床标本免疫组化检测结果相符。
本研究结果显示5-LOX、COX2 与FPR2 三者虽然在LX 生成及抗肿瘤过程中都发挥着重要作用,但在胃癌组织表达却不存在相关性,表明这三种蛋白各自有其特有的诱导表达机制及发挥效应机制。Chang 等[19]研究发现,降低5-LOX 及COX-2 的表达抑制结肠癌的演进,其通路是通过促进PTEN 并抑制PI3K/AKT 通路。而 且5-LOX 及COX-2 为AA 的两条主要代谢通路,二者虽然不存在相关性,但两个酶有如此相近作用原理和酶底物,也极有可能出现一个酶途径被阻断而激活另一酶途径,提示在治疗胃癌时采用两个代谢途径的共同抑制较仅用一种基因抑制效果更好,同时针对这两种酶的抑制剂有望成为治疗胃癌的新策略。
