抗真菌剂三峡肽素抑制指状青霉的转录组学研究
2022-03-17权雯婧薛艳红刘士平
权雯婧,刘 超,李 奥,薛艳红,刘士平
(三峡大学生物与制药学院,中国轻工业功能酵母重点实验室,湖北宜昌 443002)
柑橘是我国南方地区农村经济的支柱产业之一[1],每年都有大量的柑橘因指状青霉(P.digitatum)等采后致腐真菌的影响而发生腐败和品质劣变[2],造成巨大经济损失[3]。化学杀菌剂百可得、咪鲜胺等虽对柑橘的防腐有一定的效果[4],但处理后的果品品质发生劣变,糖份降低,而且对人体有毒副作用,残留时间长且对环境有污染,许多国家已禁止化学杀菌剂在果蔬采后处理中使用[5-6]。因此,开发出一种绿色健康的保鲜剂显得极为紧迫[7-8]。
近年来抗真菌肽(Antifungal Peptide,AFP)因其抑菌能力强、结构多样、无毒副作用受到了人们的广泛关注,如表面活性素、芬荠素、伊枯草菌素、杆菌霉素和羊毛硫肽等[9],在医药、食品、农业和饲料添加剂等领域中发挥着越来越大的作用[10]。这类物质因其作用的靶点多与传统的抗生素不一样,因此微生物不易产生抗药性,如羊毛硫肽通过在质膜上形成膜孔而达到杀菌的效果[11]。抗真菌肽的作用机制比较复杂,其可能的作用靶点为:a.影响细胞壁上的几丁质或者聚糖代谢,阻碍细胞壁的功能[12];b.作用于细胞膜,使细胞膜通透性增加,内容物流出[13];c.作用于细胞内的细胞器或物质(如线粒体、蛋白质、核酸等),使细胞生长和繁殖受到抑制,从而达到抑菌的目的[14-15]。
在前期研究中,本实验室从三峡河岸地区分布的草酸青霉(Penicillium oxalicum)中分离到一种新型的线性五肽,命名为三峡肽素(Sanxiapeptin),研究发现它在离体条件下或柑橘体内均对柑橘的主要采后致腐菌指状青霉具有强烈的抑制作用[16],而且其抑菌能力远优于目前市场上广泛应用的化学杀菌剂百可得[17]。为了明确三峡肽素的抑菌机理,本研究通过形态学观察、保护剂的抑菌效果以及转录组测序的方法,初步确定了三峡肽素可能的抑菌靶点。本研究不仅有助于丰富抗真菌肽的作用机理,还将有助于新型绿色健康的柑橘保鲜剂的研发,对促进我国农业经济的发展具有重要意义。
1 材料与方法
1.1 材料与仪器
新鲜土豆 市售;葡萄糖 科密欧化学试剂有限公司;琼脂、麦角固醇、山梨醇 金燕海洋生物股份有限公司;色谱级乙腈 美国天地有限公司;真菌RNA提取试剂盒 美国Omega Bio-Tek公司;百可得上海日曹达贸易有限公司;反转录试剂Goldenstar™RT6 cDNA Synthesis Kit Ver.2、T3 Super PCR Mix北京擎科新业生物技术有限公司。
BS-224s电子天平 德国赛多利斯有限责任公司;SW-CJ-2FD型双人实验操作台 苏州净化设备厂;XPX-9052 MBE数显培养箱 上海博讯实业有限公司医疗设备厂;ZQZY-85BN全自动控温摇床上海知楚仪器有限公司;Master-s15纯水仪 上海和泰仪器有限公司;MyCyclerTM Thermal PCR仪 美国BIO-RAD公司;GDS-8000凝胶成像系统 美国UVP公司;Allegra 64R台式高速冷冻离心机 美国BECKMAN公司;DYCP-31DN水平电泳仪 北京市六一仪器厂;YM30F不锈钢智能型立式电热蒸汽消毒器 上海三申医疗器械有限公司;光学显微镜下观察 奥林巴斯株式会社;S3000N扫描电子显微镜、H-7500透射电子显微镜 Hitachi日本。
1.2 菌株及培养条件
本实验所使用的菌株为指状青霉P.digitatum(CICC 41633),本实验室自行分离鉴定[18-19]。菌株保藏于4 ℃的PDA固体培养基斜面中,培养基配方:土豆 200 g,葡萄糖20 g,琼脂15~20 g,水 1000 mL,pH自然,121 ℃灭菌20 min。菌株经活化后,采用不加琼脂的PDA液体培养基进行培养,培养温度为28 ℃,摇床转速控制在120 r/min。
1.3 三峡肽素对菌株形态的影响
将指状青霉在上述条件下培养3 d后,分别添加0~50 μg/mL的三峡肽素和正对照百可得,继续培养12 h[20]。在光学显微镜观察时,将培养物在5000 r/min离心5 min后,收集菌丝制备玻片进行观察[21]。扫描电子显微镜和透射电子显微镜的观察委托百奥生物科技有限公司(湖北,武汉)按照文献所示方法完成[22],每次试验重复3次。
1.4 麦角固醇和山梨醇的补偿分析
为了初步判断三峡肽素抑制指状青霉的可能作用靶点,本研究分别采用丝状真菌细胞膜的保护剂麦角固醇和细胞壁的保护剂山梨醇进行补偿实验。将0、31.25、62.5、125、250、500、1000 μg/mL 的麦角固醇或山梨醇添加在PDA固体培养基中,在培养皿中央放置含有1 mg/mL的三峡肽素或百可得的牛津杯[23-24],在28 ℃的培养箱中培养3 d后测定抑菌圈直径,通过抑菌圈大小的变化判断可能的补偿效应。每次试验设置4个重复。
1.5 转录组学分析
将指状青霉在1.2所述培养条件下培养3 d后,分别添加15 μg/mL的正对照百可得(PD-2)和三峡肽素(PD-3),继续培养6 h,同时设置相同时长生长的指状青霉作为正常组(PD-1)。将培养物在5000 r/min离心5 min后,收集菌丝提取RNA后,送至华大基因进行转录组测序。将获得的转录组数据使用华大基因自主研发的过滤软件SOAPnuke(v1.4.0)进行统计,使用 Trimmomatic进行过滤,得到clean reads,并将过滤后的数据中大于20个碱基的序列所占的比例数进行统计;使用Bowtie2(v2.2.5)软件将clean reads进行比对,并将能相互比对上的净数据比例进行统计。根据比对结果,利用RSEM(RNA-Seq by Expectation Maximization,v1.2.8)软件进行定量分析,并以FPKM(Fragments Per Kilobase Per Million reads)计算基因的表达水平,差异表达基因默认定义为 FDR(False Discovery Rate)≤0.001且倍数差异在1倍以上的基因。将筛选到的差异表达基因,采用 GO(Gene Ontology)和 KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对结果进行注释分类,同时使用R软件中的phyper函数进行富集分析,同时将检测到的基因进行在NR(Nucleotide Sequence Database)和 NT(Non-Redundant Protein Sequence Database)数据库中进行注释和归类,判断基因可能的功能[25]。
1.6 RT-PCR验证
使用Oligo7软件设计引物,由生工生物工程(上海)股份有限公司合成,使用反转录试剂盒Goldenstar™RT6 cDNA Synthesis Kit Ver.2将所提RNA反转录成cDNA,测定并调整cDNA浓度之后,采用半定量RT-PCR结合电泳条带的亮度进行验证[26],所用的引物序列见表1。PCR反应体系为模板DNA:2 μL,T3 Super PCR Mix:20 μL,上游和下游引物各 1 μL,总体系 50 μL。PCR 程序 95 ℃ 3 min,然后是 95 ℃变性20 s,依据各引物的不同将退火温度设置为Tm+5 ℃,复性 20 s,72 ℃ 延伸 20 s,经过 30~35 循环后再在72 ℃延伸5 min。将PCR产物采用1.2%琼脂糖凝胶进行电泳检测。
2 结果与分析
2.1 三峡肽素对指状青霉菌丝的形态影响
在培养条件下,三峡肽素可以显著抑制指状青霉的生长(图1),而且在同等浓度下其抑制能力优于市场上广泛使用的农药百可得(双胍三辛烷苯基磺酸盐,一种以细胞膜为靶点的杀真菌剂)[27-28]。为了进一步了解三峡肽素对指状青霉菌丝形态的影响,本实验采用百可得为阳性对照,设置了0~50 μg/mL的浓度梯度,光学显微镜观察显示,三峡肽素和百可得在浓度超过20 μg/mL时均会导致指状青霉的菌丝发生消融,在15 μg/mL时,不同组别的菌丝的形态变化是最为明显的,因此选用此浓度处理后的菌丝进行扫描电子显微镜和透射电子显微镜的观察。观察结果显示:三峡肽素和百可得两者都使指状青霉的菌丝明显变粗,但经三峡肽素处理后,菌丝体明显形成结节扭曲状(图2A~图2C)。
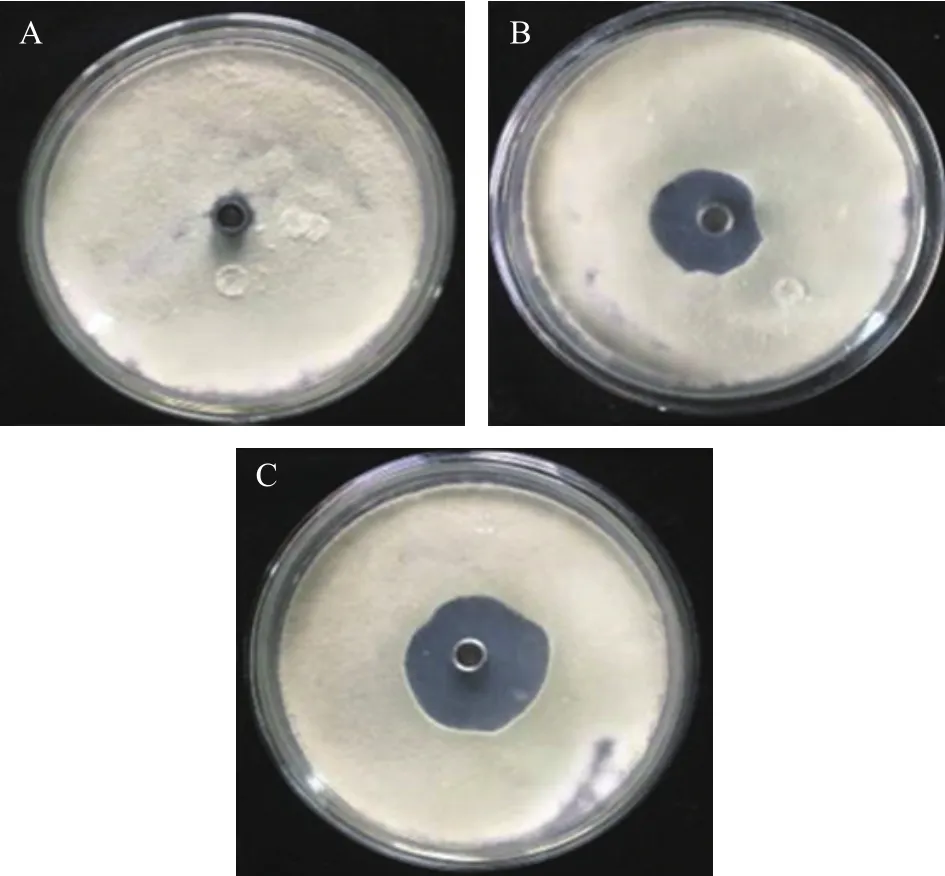
图1 三峡肽素对指状青霉的拮抗作用Fig.1 Antagonistic effect of Sanxiapeptin on P.digitatum
为了进一步了解指状青霉的显微形态变化,在相同浓度处理后分别进行了扫描电镜和透射电镜观察。扫描电镜结果发现,在添加百可得后,菌丝体的扭曲程度和正常生长的指状青霉没有明显形态差异,而三峡肽素可以明显导致菌丝体发生结节和扭曲(图2D~图2F)。透射电镜观察结果显示,经三峡肽素处理后的指状青霉细胞内部出现了空腔,细胞边缘发生破裂、不完整,而作用于细胞膜的物质百可得处理后细胞边缘仍然较为完整,细胞内部也没有出现空腔(图2G~图2L)。上述结果表明,三峡肽素与百可得的作用机理可能不一样,可能通过破坏细胞壁,造成渗透压紊乱,使得胞内物质外流,从而导致胞内空腔的形成。
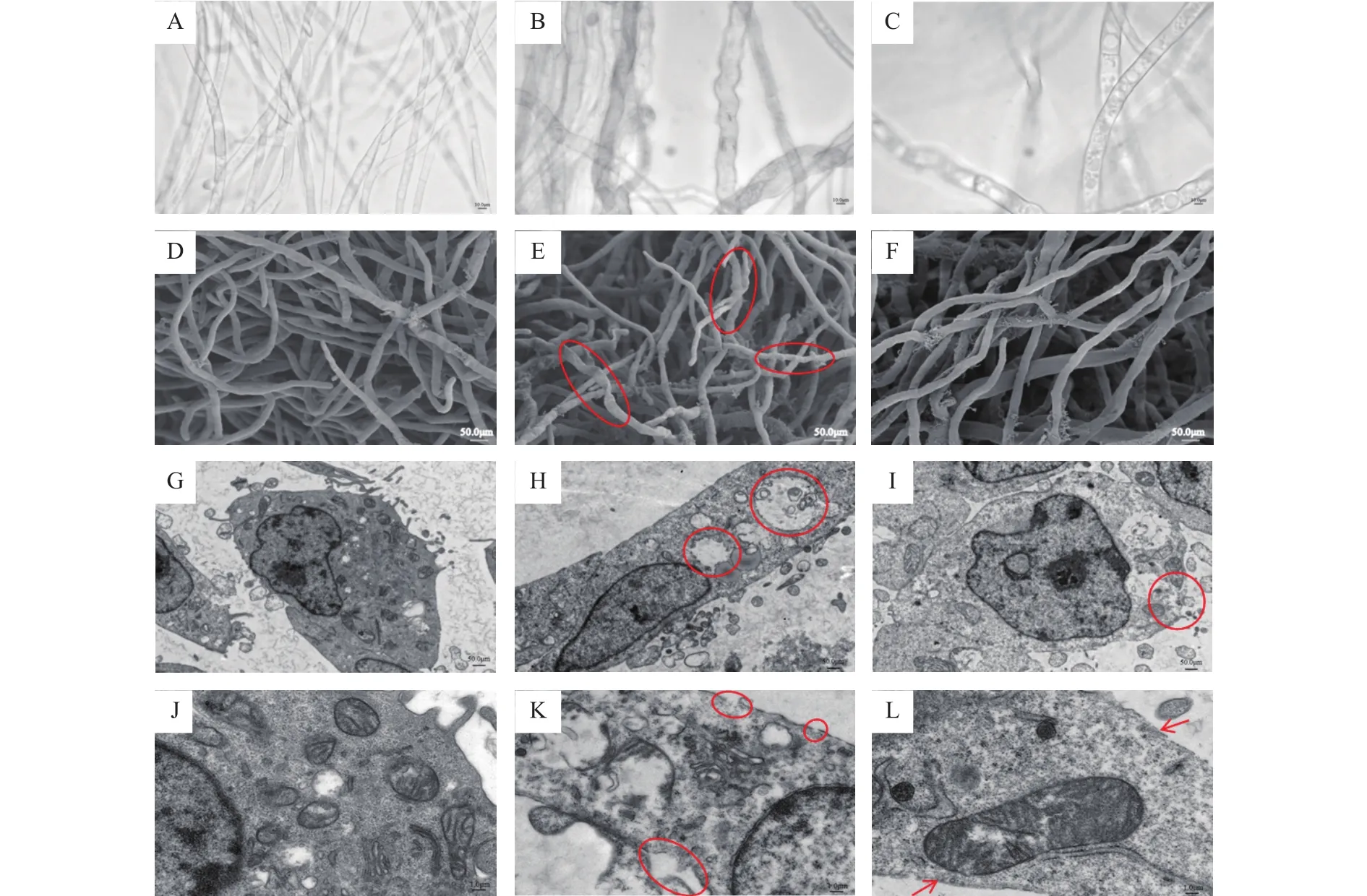
图2 三峡肽素对指状青霉的形态变化影响Fig.2 Morphological responses of P.digitatum induced by Sanxiapeptin
2.2 麦角固醇和山梨醇对三峡肽素介导的抑菌作用的补偿作用
麦角固醇是真菌细胞膜的重要组成成分,该化合物的结构稳定,专一性强;山梨醇是一种渗透保护剂,可以用于稳定真菌的原生质体,这两种物质在许多研究中分别用作细胞膜和细胞壁的保护剂[29]。为了明确三峡肽素抑制指状青霉的可能靶点,本研究分析了麦角固醇和山梨醇在不同浓度下对其抑菌能力的影响。实验结果表明:在低浓度下上述物质均没有明显的效果,但是1 mg/mL浓度下的山梨醇对三峡肽素的抑菌能力不仅没有补偿效应,反而会促进三峡肽素的抑菌能力(图3A)。而麦角固醇则相反,在1 mg/mL的浓度下,会显著(P<0.05)缓解三峡肽素对指状青霉的抑制程度,表现出一种明显的补偿效应(图3B)。相比正对照百可得,在同浓度下,山梨醇和麦角固醇均未对百可得的抑菌能力造成影响(图3C~图3D)。以上结果表明,三峡肽素与百可得的作用机理不一致,但可能通过影响细胞膜中麦角固醇的变化来达到抑制真菌的能力;同时,细胞壁及渗透压的变化也会影响到三峡肽素的抑菌能力。

图3 山梨醇和麦角固醇对三峡肽素抑菌能力的补偿效应Fig.3 Compensatory effect of sorbitol and ergosterol on the antifungal ability of Sanxiapeptin
2.3 转录组测序质量分析
将测序产生的原始数据(raw reads)中低质量、接头污染以及未知碱基含量过高的数据过滤后,平均每个菌株产生了4253万条净序列(clean reads),平均容量达6.38兆碱基(Gb),高质量数据约96%。将所获得的的clean reads使用HISAT进行参考基因组序列比对,平均比对率达到93.66%。上述结果表明(表2),此次测序的质量有保证,结果可靠[30]。

表2 转录组测序数据概况Table 2 Overview of transcriptome sequencing data
2.4 差异表达基因分析
为了进一步分析三峡肽素抑菌作用的分子机理,按照差异的倍数|log2(FoldChange)|和错误发现率(FDR)来筛选差异表达基因,分析中将同时满足|log2(FoldChange)|≥1 且 FDR≤0.001 的转录本确定为差异表达基因[31]。三个转录组中的表达发生显著变化的基因数如表3。

表3 差异表达的基因数Table 3 Number of differentially expressed genes
上述结果表明,加入三峡肽素处理后的菌株(PD-3)和正常生长的菌株(PD-1)相比,其差异表达的基因数有13.07%,该结果与百可得处理后的菌株结果非常接近,即PD-1对PD-2的差异基因为13.27%,从数量上反应二者作用的趋同性。但是这些差异表达的基因大多数并不相同(图4),且由于二者作用后的显微观察结果及麦角固醇和山梨醇的补偿实验存在明显差异,说明二者的作用途径明显不同,因此,我们对于差异基因的研究集中在两者的交集({PD-1对PD-3}∩{PD-3对PD-2})包含的530个基因中,即聚焦在仅由三峡肽素引起的表达差异的基因上。
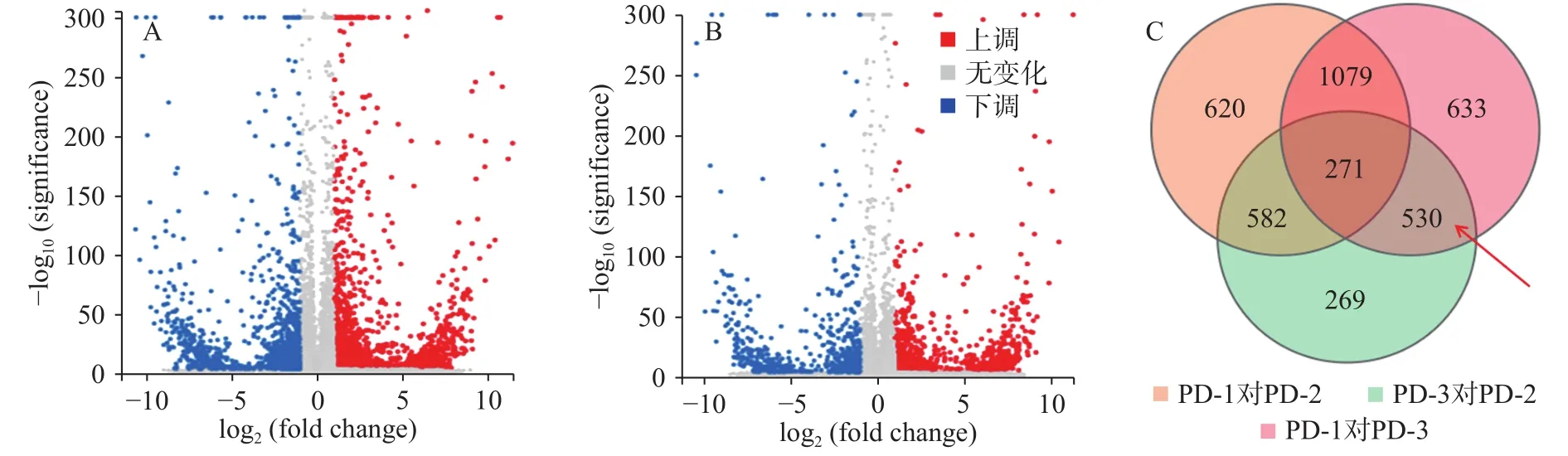
图4 差异表达基因的火山图分布Fig.4 Volcano figure of differentially expressed genes
2.5 差异表达基因的功能注释
对不同处理下差异表达的基因,分别采用GO和KEGG分类富集分析。对照百可得处理后的指状青霉(PD-2)和正常生长的菌株(PD-1)相比,糖类、脂质的代谢、能量代谢、遗传过程和细胞自噬等途径发生了变化(图5A~图5B)。三峡肽素处理后的菌株(PD-3),其差异基因也主要集中在上述途径(图5C~图5D),不管是基因的数量还是基因可能的功能,暗示三峡肽素和百可得在抑制真菌的代谢通路上可能有部分重叠。
为了深入分析三峡肽素和百可得抑菌机理的差异,根据三峡肽素所导致的指状青霉的形态变化以及相关保护剂的补偿实验结果,将仅由三峡肽素影响的530个基因进行了代谢通路分析,结果发现很多基因与聚糖、鞘脂类物质、固醇、疏水蛋白及GPI(糖基磷脂酰肌醇,Glycosylphosphatidylinositol)的代谢相关(图5E~图5F,表4),说明了三峡肽素有可能影响了细胞膜和细胞壁等细胞表面的功能。
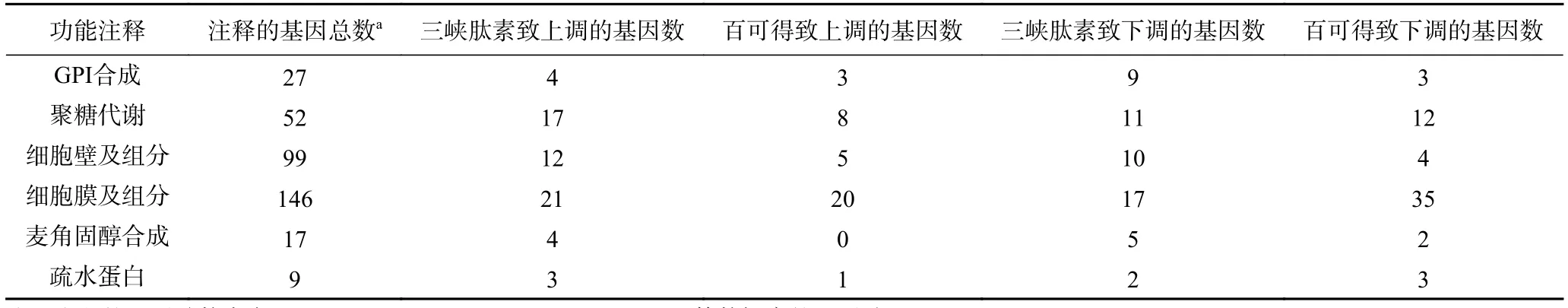
表4 部分可能参与细胞表面功能的差异表达的基因Table 4 Some differentially expressed genes possibly involved in cell surface metabolism

图5 差异表达基因的注释分析Fig.5 Annotation of differentially expressed genes
2.6 差异表达基因的验证分析
为了验证上述转录组测序分析的准确性,本研究选取了三峡肽素影响指状青霉表达变化的17个候选基因(表5)进行RT-PCR半定量表达验证,这些基因的功能大多与细胞表面的代谢相关。在进行RT-PCR之前,先选择P450基因CL1226.Contig2作为管家基因,因为它在不同时期、不同条件下均可稳定的表达,是一种较为理想的内参基因[32-33]。
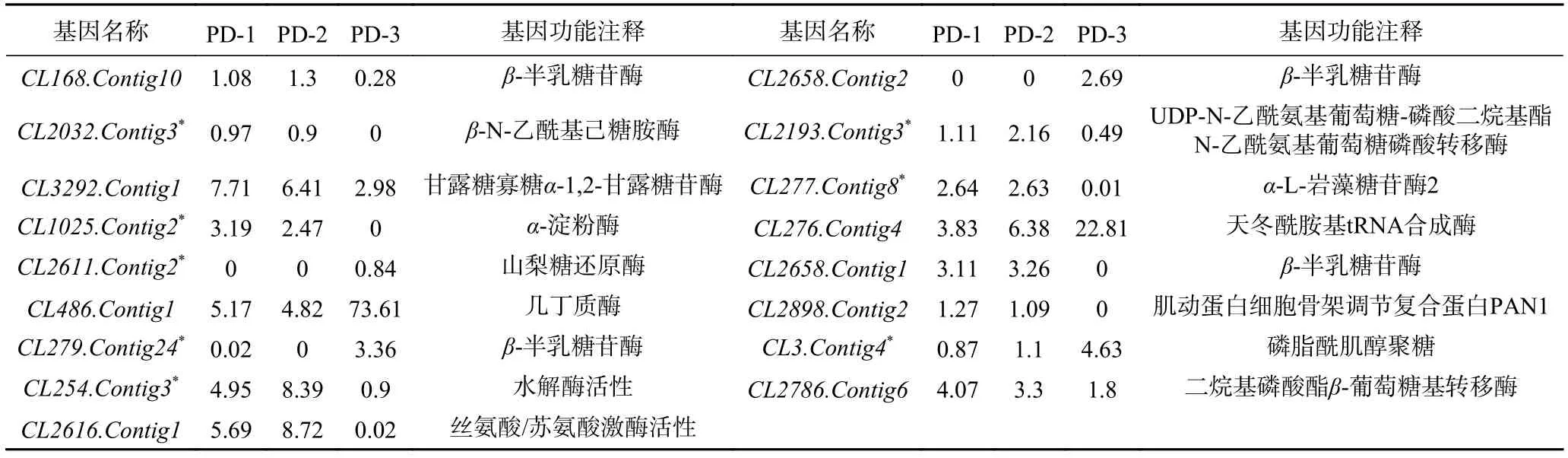
表5 指状青霉中候选基因的表达量及注释Table 5 Expression and annotation of candidate genes in P.digitatum
半定量RT-PCR结果显示,有8个参与细胞表面代谢的基因CL254.Contig3、CL279.Contig24、CL1025.Contig2、CL2611.Contig2、CL3.Contig4、CL2032.Contig3、CL2193.Contig3、CL277.Contig8基因的表达与转录组测序结果完全一致(表5、图6)。功能预测结果表明,这些基因大部分位于细胞壁或细胞膜中,可能与细胞表面的磷脂酰肌醇聚糖的合成和代谢的生物活动相关,从而影响了细胞表面的完整性,导致细胞内溶物外溢,从而起到抑菌的作用。

图6 候选基因的RT-PCR表达验证Fig.6 RT-PCR expression verification of the candidate genes
3 结论
本研究分析了三峡肽素对指状青霉的形态学影响,明确了细胞膜保护剂麦角固醇及细胞壁保护剂山梨醇对三峡肽素抑菌作用的补偿效应,同时基于BGISEQ-500测序平台,分析比较了指状青霉在三峡肽素处理后的无参转录组测序数据,并对差异表达基因进行了分析,将可能的抑菌代谢途径初步聚焦在530个差异基因中。重点对影响细胞表面的候选基因进行了分析和验证,初步确定三峡肽素通过影响疏水蛋白、麦角固醇合成酶、聚糖及GPI代谢途径相关的蛋白等细胞膜及细胞壁等细胞表面的功能蛋白来发挥作用,所有这些尝试为明确其抑菌真菌的机理奠定了基础。后续工作的主要内容将集中在对上述候选基因在草酸青霉中进行超表达或者基因敲除以构建突变体,在明确基因功能的基础上,通过分析突变体对三峡肽素敏感程度的变化解析其作用机理,进一步确定三峡肽素的作用靶点。
